Hipersexualidad y parafilias asociadas a la terapia de reemplazo de dopamina en el trata-miento de la enfermedad de Parkinson
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
1Lázaro Salomón-Lara, 2Luis Isauro García, 2Deissy Herrera-Covarrubias, 2Jorge Manzo, 2Jaime Fisher, 2*Genaro A Coria-Ávila
1Doctorado en Investigaciones Cerebrales, Universidad Veracruzana; 2Instituto de Investigaciones Cerebrales, Universidad Veracruzana
Resumen
Abstract
Introducción
Desarrollo
Conclusión
Conflicto de intereses
Agradecimientos
Referencias
Correspondencia
La enfermedad de Parkinson es una afección neurológica crónica que se caracteriza por la presencia de anormalidades en el movimiento, tales como la bradicinesia, rigidez, temblor, inestabilidad postural, trastorno de la marcha y del habla. En lo que respecta al tratamiento, por años ha sido aceptado que la terapia de reemplazo de dopamina es la opción a seguir rumbo a la disminución de sus síntomas, que incluye la administración de fármacos como la levodopa y otros agonistas dopaminérgicos. El tratamiento crónico con levodopa o con agonistas dopaminérgicos se encuentra asociado con una diversidad de complicaciones motoras y no motoras secundarias, entre las que se suele añadir a la categoría amplia de desorden del control de impulsos. Dentro de ésta, la denominada conducta sexual compulsiva, que incluye a la hipersexualidad y las parafilias, encuentra un incremento del riesgo de desarrollo, con importantes características ansiogénicas para los pacientes o sus familiares y con especial importancia dadas las dificultades legales y daños a terceros que podría suscitar. Por lo anterior, en esta revisión abordaremos brevemente las características de tales perturbaciones conductuales y su relación con la terapia de remplazo de dopamina en la enfermedad de Parkinson.
Palabras clave: Hipersexualidad, parafilias, enfermedad de Parkinson, terapia de remplazo de dopamina.
Parkinson's disease is a chronic neurological disease characterized by the presence of movement abnormalities such as bradykinesia, rigidity, tremor, postural instability, gait, and speech disorders. In terms of treatment, for years, it has been accepted that dopamine replacement therapy is the option to follow in order to reduce its symptoms, which includes the administration of drugs such as levodopa and other dopamine agonists. Chronic treatment with levodopa or dopamine agonists is associated with various secondary motor and non-motor complications, among which the broad category of impulse control disorder is often added. Within this, the so-called compulsive sexual behavior, which includes hypersexuality and paraphilias, finds an increased risk of development, with important anxiogenic characteristics for patients or their families and with special importance given the legal difficulties and damages to third parties that could arise. Therefore, in this review, we will briefly address the characteristics of such behavioral disturbances and their relationship with dopamine replacement therapy in Parkinson's disease.
Keywords: Hypersexuality, paraphilias, Parkinson's disease, dopamine replacement therapy.
1. Introducción
La enfermedad de Parkinson (EP) es una afección neurológica crónica que se caracteriza por la presencia de anormalidades en el movimiento, tales como la bradicinesia, rigidez, temblor, inestabilidad postural, trastorno de la marcha y del habla, así como toda una variedad de síntomas no motores que lo acompañan, como deterioro cognitivo, trastornos del sueño, disfunción autonómica, depresión e incluso hiposmia.1 La EP es considerada el segundo trastorno neurodegenerativo más común después de la enfermedad de Alzheimer, con una prevalencia en los países industrializados estimada en hasta 3% de la población total y alrededor del 1% en personas que sobrepasan los 60 años.2Con etiología aún desconocida, la EP es la manifestación clínica de una serie de factores genéticos y ambientales que se encuentran relacionados con la pérdida progresiva y sistemática de neuronas dopaminérgicas de la sustancia negra pars compacta (SNpc) ubicada en el mesencéfalo. Dicha pérdida se encuentra asociada con la presencia de cuerpos de Lewy intracelulares, inclusiones compuestas por agregaciones de la proteína α-sinucleína en el cuerpo neuronal.3 Esto conduce a una disminución paulatina y progresiva de las proyecciones dopaminérgicas hacia la porción dorsolateral de los ganglios basales, particularmente hacia el núcleo estriado, cuya expresión encuentra su desenlace en las manifestaciones motoras y no motoras antes mencionadas.4
Actualmente los tratamientos disponibles para la EP controlan únicamente la expresión de síntomas, aunque diversos estudios preclínicos han sido capaces de identificar estrategias terapéuticas que presentan resultados prometedores en cuanto a neuroprotección en modelos animales de EP; hasta ahora, no se ha confirmado el éxito en ensayos clínicos con humanos.5-8 Por lo tanto, durante años se ha aceptado que la terapia de reemplazo de dopamina (TRD) es la opción a seguir rumbo a la disminución de los síntomas discapacitantes de la EP, principalmente en sus etapas más precoces.1 En esta categoría se incluye la levodopa, precursor de la dopamina, de administración oral, que actualmente es considerado el “gold-standard” y el tratamiento más eficaz para la disminución de las manifestaciones motoras de la EP.6 Sin embargo, hoy en día existen otros fármacos que han demostrado su utilidad como estrategias de monoterapia o de acompañamiento a la levodopa, con efecto de TRD, tales como los agonistas dopaminérgicos (AD) sintéticos, los inhibidores selectivos de la monoamino oxidasa (IMAO) y los inhi-bidores de la catecol-O-metiltransferasa (ICOMT),9 que tienen como objetivo, ya sea incrementar la señalización dopaminérgica (principalmente de tipo D2), o la biodis-ponibilidad de la dopamina y sus substitutos.10 Por otro lado, tratamientos distintos a la TRD como la estimulación cerebral profunda (ECP) de núcleos del cerebro, o el ultrasonido focal de alta intensidad (UFAI) guiado por resonancia magnética, han demostrado excelentes resultados al evidenciar su superioridad en comparación con el tratamiento farmacológico en términos de mejoría de manifestaciones motoras y calidad de vida, particularmente en etapas avanzadas de la EP y en casos de resistencia al tratamiento farmacológico. Sin embargo, diver-sas variables técnicas, económicas y procedimentales mantienen a la TRD, y no la ECP o el UFAI, como el principal procedimiento para tratar la mayoría de los casos.11-13
Cabe mencionar que el tratamiento cró-nico con levodopa o con AD se encuentra asociado a una diversidad de complicaciones motoras secundarias en 30% de los pacientes con EP posterior a 2-3 años de tratamiento y 50% posterior a 5 años. Entre los factores de riesgo se encuentran la administración de dosis elevadas de levodopa o AD, una mayor duración del cuadro clínico y una edad temprana de diagnóstico. Las complicaciones motoras antes mencionadas incluyen las discinesias, movimientos involuntarios repentinos cuya naturaleza se mantiene regulada por los ciclos “on-off”, o alternancias cíclicas de activación psicomotriz, sintomática motora, y de estado emocional producto de los ciclos de biodis-ponibilidad de la levodopa o AD en sangre.1 Adicional a esto, otra clase de sintomatología no motora está fuertemente asociada con el consumo crónico de levodopa o AD, y se suele añadir a la categoría amplia de desorden del control de impulsos (DCI), pero que no es limitativa a éste.14 Tal espectro conductual incluye: hiperactividad nocturna, somnolencia diurna, desórdenes alimenticios (atracones), juego patológico, conductas de riesgo, compras compulsivas, síndrome de desregulación de dopamina (SDD), adicción a la dopamina, pasatiempos obsesivos, fenómeno de “Punding” (rituales motores automáticos), hipersexualidad y parafilias. Estos dos últimos, en ocasiones suelen agruparse en la categoría inclusiva llamada conducta sexual compulsiva (CSC).15,16
De éstos, la hipersexualidad se suele añadir al DCI en la literaturadel área, ocupando un lugar presente pero mínimo en el contexto de las patologías conductuales y psiquiátricas relacionadas con la TRD en la EP. Adicionalmente, el tema de las parafilias se encuentra aún menos presente, ocupando el lugar de referencias anecdóticas en la literatura. No obstante, las dificultades de naturaleza sexual son un tema de preocupación para las personas con EP, y sumadas a las dificultades primarias motoras y no motoras propias de la enfermedad, repercuten negativamente en la calidad de vida del paciente.17 Así mismo, la conducta sexual adquiere una nueva dimensión de relevancia al encontrarse implicada en una diversidad de aspectos legales,18 ya que existen casos documentados de actos delictivos asociados al uso crónico de TRD.19
2. Hipersexualidad
Diferentes conductas de preocupación sexual y disfunciones sexuales han sido relacionadas con la EP, entre ellas la disfunción eréctil y la eyaculación precoz en hombres, dificultades orgásmicas en hombres y mujeres, síndrome genital inquieto, y disminución de la libido y actividad sexual poco antes y después del diagnóstico; lo que conduce a una marcada insatisfacción sexual en dos tercios de los hombres y un tercio de las mujeres con EP entrevistados.17 Paradójicamente, hasta el 8.8% de los participantes informaron de un interés incrementado por las actividades sexuales,20 y la frecuencia de la hipersexualidad relacionada a la TRD alcanzó un rango de entre 1.7 a 3.5%, siendo de hasta 0.9% en pacientes tratados con levodopa, y de hasta 2.7% en pacientes tratados con AD.21
El efecto de la hipersexualidad relacionada con la TRD puede resultar devastador, tanto en el contexto de pareja como familiar, para las personas con EP. Además, puede incrementar el estrés de los cuidadores de los pacientes de forma considerable, quienes ya están sometidos a un nivel muy alto de estrés debido a los síntomas primarios de la enfermedad.17 Asimismo, la conducta hipersexual puede generar dificultades adicionales en materia de salud sexual, que pueden incluir enfermedades de transmisión sexual, embarazos no planificados y consecuencias legales tales como deman-das por acoso o abuso sexual.19
Otro factor importante, aunque menos discutido, es la dificultad de diagnóstico de la hipersexualidad en el contexto de los pacientes con EP. De hecho, entrevistas sexuales exhaustivas son capaces de revelar que diferentes tipos de disfunciones sexuales pueden confundirse con hipersexualidad. Esto subraya la importancia de evaluar cuidadosamente cada caso en particular, preferentemente con el apoyo de un equipo multidisciplinario, con el fin de evitar errores diagnósticos y confusiones.22
2.1 Erecciones involuntarias
El espectro completo de hipersexualidad en la TRD abarca una variada sintomatología, entre las que se encuentra el incremento de erecciones involuntarias e incontrolables, de entre 5 y 60 minutos, que suelen presentarse en conjunción con el aumento en la dosificación de levodopa o de algún AD.20 Existen casos documentados de los fármacos: apomorfina, ropinirol, pergolida y lisurida, en respuesta inducida por dosis.23,24 Este incremento de erecciones involuntarias, aunque en algunas ocasiones de forma inicial el paciente las puede considerarlo como una mejora puntual de sus funciones sexuales, en muchos casos se acompaña de un aumento concomitante de la libido, así como de malestar físico y psicológico, ya que el paciente es incapaz de controlar su estado emocional y su respuesta fisiológica.25
2.2 Deseo sexual incrementado
Una de las consecuencias más representativas y paradigmáticas en la hipersexualidad relacionada con la TRD es el incremento casi ubicuo de la libido,20 que generalmente acompaña a las otras formas de hiperse-xualidad ligada al consumo de levodopa y AD.22 Aunque en el peridiagnóstico y fases iniciales de la EP se reporta un decremento significativo del deseo sexual,16 en fases avanzadas del tratamiento o en los periodos habituales de incremento de dosis o cambio de AD los informes de pacientes muestran un marcado aumento de la libido, acompañado por una preocupación persistente por la gratificación sexual, aventuras y relaciones extramatrimoniales, así como un aumento de la frecuencia y variedad de la actividad sexual.26
2.3. Desinhibición sexual
Por otra parte, el deseo sexual incrementado relacionado a la TRD frecuentemente se presenta junto con algunos indicadores de desinhibición sexual, comúnmente verbales; en los que el paciente, que en múltiples estudios de casos ha incrementado la dosis de consumo ya sea de levodopa o de AD,27 bien por prescripción médica o por auto prescripción, expresa, sin su habitual pudor, intentos de seducción a cuidadores, obscenidades inusuales, deseos de participar en actividades sexuales no habituales y revelación de deseos sexuales secretamente guardados durante años.28
2.4. Adicción a la pornografía
Una forma también común de hipersexua-lidad en la TRD es la adicción a la pornografía, que se expresa principalmente según diversos estudios de casos, comprando revistas y videos pornográficos, invirtiendo tiempo excesivo en el consumo de tal material, con o sin masturbación.22En la literatura analizada se pone de manifiesto la relación entre estas actividades con el uso de pramipexol en monoterapia y la combinación levodopa-ropinirol.28,29
2.5. Masturbación compulsiva
La masturbación compulsiva es otra manifestación de hipersexualidad común en los casos de alteraciones conductuales por TRD.22 De igual forma que en el caso de adicción a la pornografía, tanto el tratamiento en monoterapia de pramipexol como la conjunción de levodopa-ropinirol parecen susceptibles de causar alteraciones conductuales de la actividad masturbatoria, ya sea en solitario o en público.28-30
2.6. Solicitudes sexuales compulsivas e intrusivas
Unas de las formas más comúnmente conocidas de hipersexualidad en entrevistas psiquiátricas sobre los efectos adversos de la TRD en pacientes con EP son las solicitudes sexuales compulsivas, recurrentes e intrusivas dirigidas hacia los cónyuges;28 aunque en ocasiones también hacia los cuidadores no familiares. En diferentes estudios de casos, se ha observado que el aumento en la dosificación de pramipexol y pergolida han desatado aparentes periodos de deseo sexual incrementado muy por encima del estado basal histórico del paciente, en el que se recurren a solicitaciones reiteradas, insistentes, y en ocasiones agresivas, de contacto sexual.19 Esto generalmente provoca estrés psico-social en los cónyuges de los pacientes y hace que sean ellos los que frecuentemente comuniquen al médico tratante las dificultades relacionadas con la dosificación del tratamiento.27
2.7. Uso excesivo de servicios de prostitución
Por último, la asistencia regular a prostíbulos para contratar servicios sexuales ha sido señalado en los estudios de caso como otra importante manifestación de hipersexualidad detonada por modificaciones en la TRD de pacientes con EP. El uso de cambios en la dosificación de pramipexol ha sido encontrado como aparente iniciador de tal con-ducta.28
3. Parafilias
Cada vez son más los estudios de casos en los que, de forma aún anecdótica, describen el curso de la aparición de parafilias durante la TRD, entendiendo éstas como comportamientos intensos o impulsos que implican la fantasía o la realización de comportamientos e interés sexuales estadísticamente atípicos.31 Las parafilias referidas por pacientes, o familiares de éstos, con EP en TRD se presentan como íntimamente relacionadas a los DCI o incluso al SDD.32 Además, por término general, la intensidad de los impulsos parafílicos en este tipo de desórdenes conductuales adquiridos suele verse atenuada con la reducción de las dosis de los fármacos, ya sea levodopa, AD o en ciertos casos IMAO o ICOMT.33
3.1. Exhibicionismo
En algunos casos se ha reportado la adquisición de conductas relacionadas con la parafilia, denominada exhibicionismo.29Se ha observado que algunos pacientes con EP que reciben tratamiento con fármacos exhiben parcial o totalmente sus genitales en lugares públicos y, en ocasiones también realizan movimientos masturbatorios.18 En los casos de los que se tiene conocimiento se ha encontrado levodopa en monoterapia, la combinación de levodopa-ropinirol, levodopa-bromocriptina, levodopa-pergolida y levodopa-pramipexol, como el tratamiento seguido en la ventana temporal de los incidentes.33
3.2. Frotteurismo
Aunque menos frecuente, también se han reportado casos de frotteurismo en pacientes con EP, en el transcurso de TRD.18 En el frotteurismo el sujeto encuentra excitación sexual al frotar los genitales contra el cuerpo de quien se dirige el episodio, estando esa persona vestida y en un lugar público. En este caso, se tiene noticia del uso de pergolida en monoterapia durante este periodo de hipersexualidad y parafilia.19
3.3. Fetichismo travestista
Con mayor frecuencia que el frotteurismo, en los reportes de casos de parafilias durante la TRD se encuentra el fetichismo,29 que en la mayoría de los casos reportados es una tipología denominada fetichismo travestista, la cual se caracteriza por una recurrente e intensa excitación sexual generada por el uso de prendas de vestir de otra persona, generalmente del sexo opuesto. En la literatura se reportan estos incidentes relacionados al periodo en el que se encuentran presentes los efectos de varios fármacos, incluyendo la monoterapia de pramipexol, las combinaciones de levodopa-pergolida, levodopa-ropinirol, levodopa-lisurida, levodopa-selegilina, levodopa-bromocriptina, selegilina-pramipexol, y la triada selegilina-ropinirol-pramipexol.33-37
3.4. Zoofilia
Otra de las complicaciones conductuales aparentemente causadas por el cambio o modificación de dosis de levodopa o AD es la zoofilia,29 caracterizada por excitación sexual intensa y recurrente, fantasías sexuales o actos que impliquen a animales para satisfacer el deseo sexual.33 Los fármacos dopaminérgicos administrados durante tales episodios parafílicos reportados son: levodopa-pergolida, levodopa-pramipexol, la triada levodopa-entacapona-selegilina, y levodopa-bromocriptina.38-40
3.5. Pedofilia
La pedofilia se caracteriza por excitación sexual intensa y recurrente, deseos y fantasías sexuales que involucran a niños. Dentro de las anomalías conductuales caracterizadas como parafilias durante la TRD existen casos reportados de tal pedofilia,18 particularmente de ofensas sexuales hacia menores. En algunos casos, se menciona que los pacientes con EP muy comúnmente se auto administraban cantidades de levodopa o AD muy por arriba de la dosis suministrada por el médico tratante, generando un tipo de SDD.29 Específicamente, en un caso se reportó la exacerbación de una "corriente lateral pedófila" de la que el paciente era consciente, y manifestaba fantasías masturbatorias, a pesar de que nunca las había ejecutado en el plano del comportamiento.33 En los reportes de caso se mencionan como erapias al momento de los incidentes: levodopa-bromocriptina, levodopa-pergolida, levodopa-cabergolina y la triada levodopa-entacapona-pramipexol.41
3.6. Sadismo sexual
Otro de los espectros conductuales de tipo parafílico en la TRD es el sadismo sexual, el cual se caracteriza por excitación sexual, fantasías y deseo recurrente relacionado a causar dolor, sufrimiento o malestar físico o psicológico a otros. En los casos reportados a la fecha se informan de pacientes con EP tratados con una combinación de levodopa-pergolida.29
3.7. Otras parafilias
Existen otras parafilias reportadas con menor frecuencia, y en ocasiones como casos únicos, que han sido relacionados con la TRD.29 Entre ellas se encuentran: el masoquismo sexual, reportado bajo tratamiento de levodopa-selegilina y levodopa-bromocriptina; el incesto, bajo tratamiento de monoterapia de levodopa y la combinación de levodopa-pramipexol; y la clismafilia, bajo tratamiento combinado de levodopa-pergolida.34
4. Factores de riesgo de la conducta sexual compulsiva
Diferentes factores de riesgo para la adquisición de la CSC bajo TRD en pacientes con EP han sido reportados con anterioridad; aunque los diferentes reportes coinciden en lo fundamental, algunos factores permanecen desconocidos e incluso contradictorios.
4.1 Género
En un estudio, se encontró que la CSC está presente en 5.2% de los hombres y 0.5% de las mujeres con EP bajo TRD, encontrando que el género masculino resulta más propenso a la adquisición, tanto de hipersexualidad como de parafilias cuando son sometidos a tratamiento, ya sea con levodopa o con AD.42
4.2 Consumo de fármacos de TRD
El uso de drogas dopaminérgicas es un im-portante factor de riesgo para el desarrollo de DCI en general y CSC en particular.14 El consumo de AD, particularmente de pramipexol y ropinirol, se encuentra asociado con de 2 y hasta 3.5 veces más probabilidades de adquirir un DCI. En cuanto a los CSC, en la totalidad de casos analizados en este estudio los pacientes con EP se encontraban bajo tratamiento TRD, y también en la totalidad de dichos casos se reportó cese de la conducta sexual anómala o importante mejoría con la suspensión o disminución de dosis de AD.43
4.3 Edad de diagnóstico de EP
La edad de inicio de los síntomas motores y cognitivos de la EP también resulta relevante como factor de riesgo. Se ha reportado que a edad más joven de inicio y diagnóstico de la EP se incrementa la probabilidad de desarrollar alguna CSC.42
4.4 Síndrome de desregulación de dopamina
El SDD, similar a la desregulación homeostática hedonística, se caracteriza por un patrón de consumo, en el que algunos pacientes con EP toman cantidades de fármacos TRD muy superiores a las necesarias para tratar sus discapacidades motoras.14 Alrededor del 4% de los pacientes con EP parece caer en este tipo de patrón de consumo, en el que insisten reiteradamente en un rápido aumento del fármaco dopaminérgico, que-jándose de síntomas motores y afectivos intolerables.44 A pesar de las advertencias de sus médicos tratantes, pronto se desarrolla un patrón de búsqueda e ingesta de dosis diarias totales muy altas de levodopa o de AD. Tal sobreuso de los fármacos TRD se ha encontrado en numerosos casos de CSC, en los que se toma como una comorbilidad más de tipo DCI, pero que podría resultar en un factor de riesgo dada las altas cantidades de fármacos TRD autoadministradas (tabla 1).33,45,46
5. Mecanismos implicados
La CSC es parte de un grupo mayor de alteraciones conductuales mayor, ampliamente representado por los DCI, los cuales están fuertemente relacionados con el consumo de fármacos dopaminérgicos, como se ha mencionado anteriormente.22 Los mecanismos implicados en dicha relación incluyen aquéllos estrechamente vinculados con la vía mesocorticolímbica, que desempeña un importante papel en la motivación, el apren-dizaje asociativo y en el desarrollo de compulsiones conductuales.14 En condiciones fisiológicas los estímulos novedosos y recompensantes, tales como la comida, el sexo o los reforzadores condicionados no naturales promueven la estimulación del sistema mesocorticolímbico, que involucra regiones cerebrales tales como el núcleo accumbens (NA), la amígdala y el hipocampo, donde una liberación fásica de dopamina desde el área tegmental ventral ha sido relacionada con la facilitación del aprendizaje asociativo, y en condiciones patológicas, con la generación de compulsiones conductuales.47
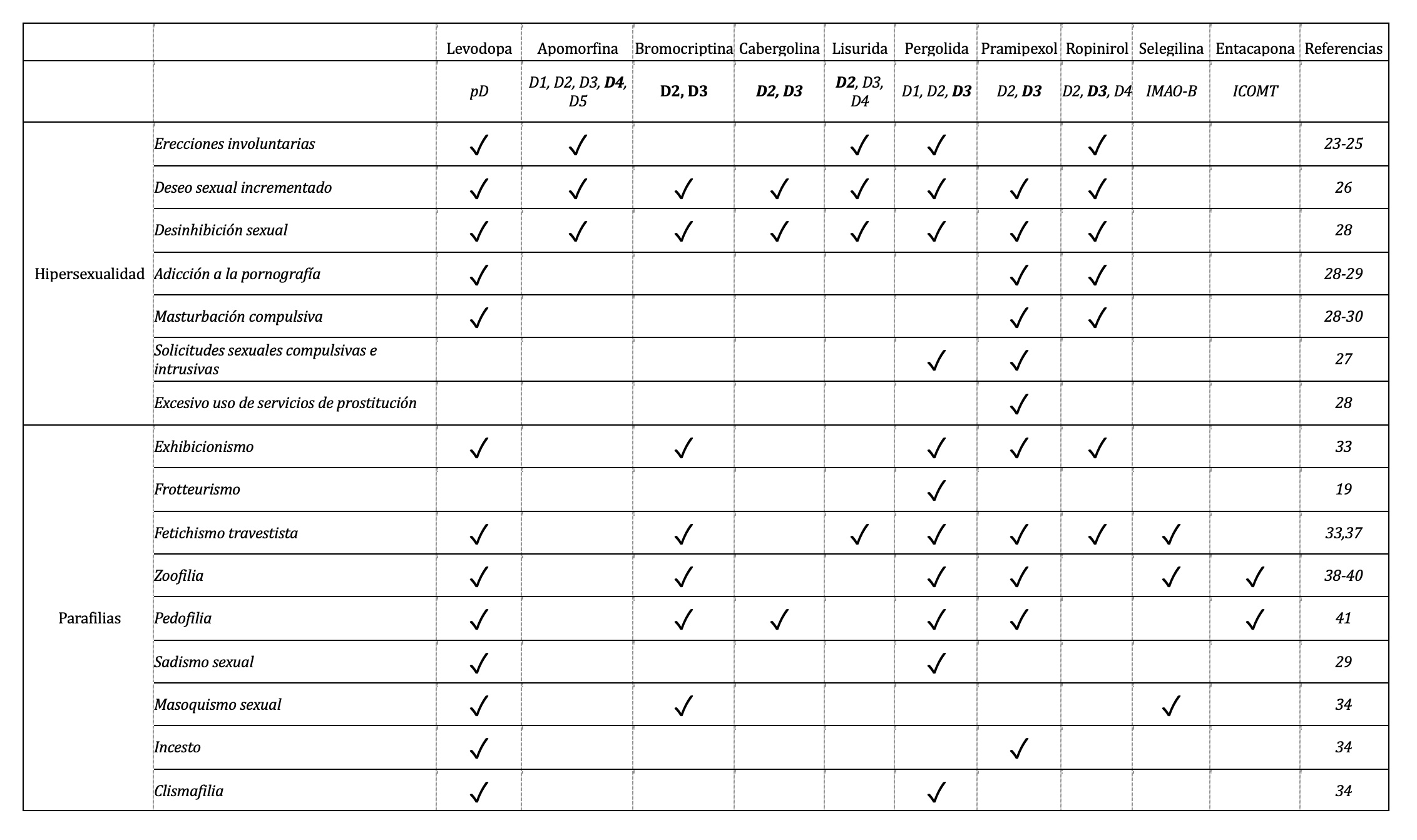
Tabla 1. Manifestaciones clínicas de hipersexualidad y parafilias durante la TRD en pacientes con EP, y los fármacos reportados que son utilizados durante los periodos de aparición de los síntomas, ya sea en monoterapia o tratamiento combinado. pD= precursor metabólico de dopamina, D1-5= actividad agonista sobre los receptores dopaminégicos 1-5, IMAO-B= Inhibidor de monoaminooxidasa B, ICOMT= inhibidor de la catecol-o-metiltransferasa. Se indica en negritas el tipo de receptor con más afinidad.
5.1 Receptores D3
De los AD frecuentemente usados en la TRD, exceptuando la apomorfina, todos ellos presentan una afinidad selectiva por los receptores dopaminérgicos de la familia D2, pero muy especialmente por el receptor D3.22 De hecho, el pramipexol y el ropinirol presentan una afinidad de al menos 100 veces mayor por el receptor D3 que por el D2.16Adicionalmente, el receptor encuentra su distri-bución principalmente localizada en el sistema límbico, particularmente en el NA, lo que apoya la suposición de que juega un papel importante en los cambios de la conducta motivada en los DCI, y específicamente en la CSC.48
5.2 Decremento de la recaptura de dopamina
La pérdida neuronal por la EP afecta múltiples sistemas y es el resultado de modificaciones de la fisiología celular que se desarrollan en unos pocos tipos de neuronas susceptibles. La pérdida lenta, pero progresiva, de neuronas dopaminérgicas proyectadas desde el mesencéfalo no es limitativa a la SNpc, existe un patrón progresivo de neu-rodegeneración que afecta en menor escala a las neuronas del área tegmental ventral (ATV), también del mesencéfalo.5 Es así como la pérdida de terminales dopaminérgicas conduce a una reducción de la capacidad presináptica de almacenamiento y recaptura de dopamina en el estriado ventral, particularmente el NA, dando lugar a una liberación de dopamina no regulada. De esta forma, la administración cíclica a lo largo del día de levodopa y otros AD causa una activación pulsátil de los receptores dopaminérgicos postsinápticos, que se encuentra fuera de la escala regular de funcionamiento fisiológico, dando lugar, presumiblemente, a las concomitantes alteraciones conductuales antes mencionadas.14
6. Conclusión
La terapia de remplazo de dopamina es un medio actualmente no prescindible para controlar sintomáticamente las alteraciones motoras y cognitivas de la enfermedad de Parkinson. Sin embargo, su uso trae consigo aparejados algunos riesgos, entre los cuales destacan el aumento del riesgo de desarrollar desórdenes del control de impulsos, el síndrome de desregulación de dopamina y la conducta sexual compulsiva, que presenta sus principales alteraciones dentro de las categorías de hipersexualidad y parafilias. Estas alteraciones de la conducta traen importantes fuentes de estrés psicosocial, tanto para los pacientes con EP como para sus familiares y cuidadores. Aunque la literatura científica crece con el paso de los años y los reportes de casos se añaden, todavía sigue siendo una colección de reportes anecdóticos sobre el desarrollo de alteraciones conductuales relacionadas tangencialmente con la misma terapia de remplazo de dopamina. Es así como cobra especial importancia el aumento del interés público y científico sobre un tema cuya consideración por parte de los pacientes y familiares es en ocasiones tabú, pero que encuentra mayor relevancia, en tanto que tales perturbaciones de la conducta motivada pueden ocasionar infracciones, a veces graves, de la ley y agresiones contra personas vulnerables.
7. Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la publicación del artículo.
8. Agradecimientos
Se agradece al Consejo Nacional de Humanidades, Ciencia y Tecnología (CONAHCyT) de México por el apoyo otorgado a través del Programa de Becas Nacionales (No. CVU: 960522), y al Instituto de Investigaciones Cerebrales (IICE) de la Universidad Veracruzana.
9. References
- Poewe, W., Seppi, K., Tanner, C. M., Halliday, G. M., Brundin, P., Volkmann, J., Schrag, A.-E., & Lang, A. E. (2017). Parkinson disease. Nature Reviews Disease Primers, 3(1), 17013. https://doi.org/10.1038/nrdp.2017.13
- de Lau, L. M. L., & Breteler, M. M. B. (2006). Epidemiology of Parkinson’s disease. Lancet Neurology, 5(6), 525–535. https://doi.org/10.1016/S1474-4422(06)70471-9
- Martínez-Fernández., R., Gasca-Salas C., C., Sánchez-Ferro, Á., & Ángel Obeso, J. (2016). Actualización en la enfermedad de Parkinson. Revista médica Clínica Las Condes, 27(3), 363–379. https://doi.org/10.1016/j.rmclc.2016.06.010
- Dauer, W., & Przedborski, S. (2003). Parkinson’s disease. Neuron, 39(6), 889–909. https://doi.org/10.1016/s0896-6273(03)00568-3
- Braak, H., Del Tredici, K., Rüb, U., de Vos, R. A. I., Jansen Steur, E. N. H., & Braak, E. (2003). Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiology of Aging, 24(2), 197–211. https://doi.org/10.1016/s0197-4580(02)00065-9
- Devos, D., Hirsch, E., & Wyse, R. (2021). Seven solutions for neuroprotection in Parkinson’s disease. Movement Disorders: Official Journal of the Movement Disorder Society, 36(2), 306–316.
- Jung, U. J., Leem, E., & Kim, S. R. (2014). Naringin: a protector of the nigrostriatal dopaminergic projection. Experimental Neurobiology, 23(2), 124–129. https://doi.org/10.5607/en.2014.23.2.124
- Nebrisi, E. E. (2021). Neuroprotective activities of curcumin in Parkinson’s disease: A review of the literature. International Journal of Molecular Sciences, 22(20). https://doi.org/10.3390/ijms222011248
- Schlesinger, I., & Korczyn, A. D. (2016). Catechol-O-methyltransferase inhibitors in the management of Parkinson’s disease. En N. Galvez-Jimenez, H. H. Fernandez, A. J. Espay, & S. H. Fox (Eds.), Parkinson’s Disease (pp. 76–82). Cambridge University Press.
- Schapira, A. H. (2011). Monoamine oxidase B inhibitors for the treatment of Parkinson’s disease: a review of symptomatic and potential disease-modifying effects: A review of symptomatic and potential disease-modifying effects. CNS Drugs, 25(12), 1061–1071. https://doi.org/10.2165/11596310-000000000-00000
- Deuschl, G., Schade-Brittinger, C., Krack, P., Volkmann, J., Schäfer, H., Bötzel, K., Daniels, C., Deutschländer, A., Dillmann, U., Eisner, W., Gruber, D., Hamel, W., Herzog, J., Hilker, R., Klebe, S., Kloss, M., Koy, J., Krause, M., Kupsch, A., Lorenz D., Lorenzl S., Mehdorn M., Moringlane J., Oertel W., Pinsker M., Reichmann H., Reuss A., Schneider G., Schnitzler A., Steude U., Sturm V., Timmermann L., Tronnier V., Trottenberg T., Wojtecki L., Wolf E., Poewe W., & Voges J. (2006). German Parkinson Study Group, Neurostimulation Section. A randomized trial of deep-brain stimulation for Parkinson’s disease. The New England Journal of Medicine, 355(9), 896–908. https://doi.org/10.1056/NEJMoa060281
- Bauer, R., Martin, E., Haegele-Link, S., Kaegi, G., von Specht, M., & Werner, B. (2014). Noninvasive functional neurosurgery using transcranial MR imaging-guided focused ultrasound. Parkinsonism & Related Disorders, 20 Suppl 1, S197-9. https://doi.org/10.1016/S1353-8020(13)70046-4
- Schlesinger, I., Eran, A., Sinai, A., Erikh, I., Nassar, M., Goldsher, D., & Zaaroor, M. (2015). MRI guided focused ultrasound thalamotomy for moderate-to-severe tremor in Parkinson’s disease. Parkinson’s Disease, 2015, 219149. https://doi.org/10.1155/2015/219149
- Béreau, M., Fleury, V., Bouthour, W., Castrioto, A., Lhommée, E., & Krack, P. (2018). Hyperdopaminergic behavioral spectrum in Parkinson’s disease: A review. Revue Neurologique, 174(9), 653–663. https://doi.org/10.1016/j.neurol.2018.07.005
- Grall-Bronnec, M., Victorri-Vigneau, C., Donnio, Y., Leboucher, J., Rousselet, M., Thiabaud, E., Zreika, N., Derkinderen, P., & Challet-Bouju, G. (2018). Dopamine agonists and impulse control disorders: A complex association. Drug Safety: An International Journal of Medical Toxicology and Drug Experience, 41(1), 19–75. https://doi.org/10.1007/s40264-017-0590-6
- Ahlskog, J. E. (2011). Pathological behaviors provoked by dopamine agonist therapy of Parkinson’s disease. Physiology & Behavior, 104(1), 168–172. https://doi.org/10.1016/j.physbeh.2011.04.055
- Bronner, G., Hassin-Baer, S., & Gurevich, T. (2017). Sexual preoccupation behavior in Parkinson’s disease. Journal of Parkinson’s Disease, 7(1), 175–182. https://doi.org/10.3233/JPD-160926
- Berger, C., Mehrhoff, F. W., Beier, K. M., & Meinck, H.-M. (2003). Sexual delinquency and Parkinson’s disease. Der Nervenarzt, 74(4), 370–375. https://doi.org/10.1007/s00115-003-1505-6
- Cannas, A., Solla, P., Floris, G., Tacconi, P., Loi, D., Marcia, E., & Marrosu, M. G. (2006). Hypersexual behaviour, frotteurism and delusional jealousy in a young parkinsonian patient during dopaminergic therapy with pergolide: A rare case of iatrogenic paraphilia. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 30(8), 1539–1541. https://doi.org/10.1016/j.pnpbp.2006.05.012
- Meco, G., Rubino, A., Caravona, N., & Valente, M. (2008). Sexual dysfunction in Parkinson’s disease. Parkinsonism & Related Disorders, 14(6), 451–456. https://doi.org/10.1016/j.parkreldis.2007.10.008
- Voon, V., Hassan, K., Zurowski, M., de Souza, M., Thomsen, T., Fox, S., Lang, A. E., & Miyasaki, J. (2006). Prevalence of repetitive and reward-seeking behaviors in Parkinson disease. Neurology, 67(7), 1254–1257. https://doi.org/10.1212/01.wnl.0000238503.20816.13
- Bronner, G., & Hassin-Baer, S. (2012). Exploring hypersexual behavior in men with Parkinson’s disease: is it compulsive sexual behavior? Journal of Parkinson’s Disease, 2(3), 225–234. https://doi.org/10.3233/JPD-2012-012098
- Fine, J., & Lang, A. E. (1999). Dose-induced penile erections in response to ropinirole therapy for Parkinson’s disease. Movement Disorders: Official Journal of the Movement Disorder Society, 14(4), 701–702. https://doi.org/10.1002/1531-8257(199907)14:4<701::aid-mds1026>3.0.co;2-r
- O’Sullivan, J. D. (2002). Apomorphine as an alternative to sildenafil in Parkinson’s disease. Journal of neurology, neurosurgery, and psychiatry, 72(5), 681–681. https://doi.org/10.1136/jnnp.72.5.681
- Kaňovský, P., Bareš, M., Pohanka, M., & Rektor, I. (2002). Penile erections and hypersexuality induced by pergolide treatment in advanced, fluctuating Parkinson’s disease. Journal of Neurology, 249(1), 112–114. https://doi.org/10.1007/pl00007840
- Béreau, M. (2018). Hypersexuality in Neurological Disorders: From Disinhibition to Impulsivity. In Frontiers of Neurology and Neuroscience (pp. 71–76). S. Karger AG.
- Munhoz, R. P., Fabiani, G., Becker, N., & Teive, H. A. G. (2009). Increased frequency and range of sexual behavior in a patient with Parkinson’s disease after use of pramipexole: A case report. The Journal of Sexual Medicine, 6(4), 1177–1180. https://doi.org/10.1111/j.1743-6109.2008.00861.x
- Custodio, N., Montesinos, R., Lira, D., & Torres, H. (2011). Hipersexualidad asociada a pramipexol, en el tratamiento de síntomas parkinsonianos: Revisión de la literatura, a propósito de 3 casos. Anales de la Facultad de Medicina, 71(1), 51. https://doi.org/10.15381/anales.v71i1.72
- Cannas, A., Solla, P., Floris, G. L., Serra, G., Tacconi, P., & Marrosu, M. G. (2007). Aberrant sexual behaviours in Parkinson’s disease during dopaminergic treatment. Journal of Neurology, 254(1), 110–112. https://doi.org/10.1007/s00415-006-0285-x
- Rocha, F. L., & Hara, C. (2015).Compulsive Masturbation With Pramipexole for Antidepressant Augmentation in Major Depression: A Case Report. Journal of Clinical Psychopharmacology, 35(4), 485. https://doi.org/10.1097/JCP.0000000000000363
- Sánchez Herrero, N., Lopez Perez, R. M., & Domínguez Muñoz, A. (2018). Parafilias: Una revisión comparativa desde el DSM-5 y la CIE-10. Behavior & Law Journal, 4(1). https://doi.org/10.47442/blj.v4.i1.58
- American Psychiatric Association (2013) En Manual diagnóstico y estadístico de los trastornos mentales (5 ª ed.). http://doi:10.1176/appi.books.9780890425596.807874
- Solla, P., Bortolato, M., Cannas, A., Mulas, C. S., & Marrosu, F. (2015). Paraphilias and paraphilic disorders in Parkinson’s disease: A systematic review of the literature: Paraphilias in PD. Movement Disorders, 30(5), 604-613. https://doi.org/10.1002/mds.26157
- Solla, P., Cannas, A., Marrosu, M. G., & Marrosu, F. (2012). Dopaminergic-induced paraphilias associated with impulse control and related disorders in patients with Parkinson disease. Journal of Neurology, 259(12), 2752-2754. https://doi.org/10.1007/s00415-012-6691-3
- Riley, D. E. (2002). Reversible Transvestic Fetishism in a Man With Parkinson’s Disease Treated With Selegiline: Clinical Neuropharmacology, 25(4), 234-237. https://doi.org/10.1097/00002826-200207000-00008
- Tajima-Pozo, K., Bardudo, E., Aguilar-Shea, A. L., & Dolores, M. (2010). Pramipexole: Paraphilia as adverse drug reaction. Journal of Neurology and Neuroscience, 2(1), 2.
- Shapiro, M. A., Chang, Y. L., Munson, S. K., Okun, M. S., & Fernandez, H. H. (2006). Hypersexuality and paraphilia induced by selegiline in Parkinson’s disease: Report of 2 cases. Parkinsonism & Related Disorders, 12(6), 392-395. https://doi.org/10.1016/j.parkreldis.2006.01.010
- Raina, G., Cersosimo, M. G., & Micheli, F. (2012). Zoophilia and impulse control disorder in a patient with Parkinson disease. Journal of Neurology, 259(5), 969-970. https://doi.org/10.1007/s00415-011-6270-z
- Almeida, K. J., de Oliveira Filho, M. C. S., Lopes Nery, P. C., Guimarães Silva, J. S., & Campos Sousa, R. N. (2013). Zoophilia and Parkinson’s disease. Parkinsonism & Related Disorders, 19(12), 1167-1168. https://doi.org/10.1016/j.parkreldis.2013.07.015
- Fornelos, A., & Roque, M. (2017). Zoophilia in a Patient with Parkinson’s Disease. European Psychiatry, 41(S1), S632-S632.https://doi.org/10.1016/j.eurpsy.2017.01.1032
- Foley, S. R., Arthur, K., & Kelly, B. D. (2006). Psychiatric sequelae of Parkinson disease: A case report. European Psychiatry, 21(3), 211-213. https://doi.org/10.1016/j.eurpsy.2005.05.007
- Santa Rosa Malcher, C. M., Roberto da Silva Gonçalves Oliveira, K., Fernandes Caldato, M. C., Lopes dos Santos Lobato, B., da Silva Pedroso, J., & de Tubino Scanavino, M. (2021). Sexual Disorders and Quality of Life in Parkinson’s Disease. Sexual Medicine, 9(1), 100280. https://doi.org/10.1016/j.esxm.2020.10.008
- Weintraub, D., Koester, J., Potenza, M. N., Siderowf, A. D., Stacy, M., Voon, V., Whetteckey, J., Wunderlich, G. R., & Lang, A. E. (2010). Impulse control disorders in Parkinson disease: a cross-sectional study of 3090 patients: A cross-sectional study of 3090 patients. Archives of Neurology, 67(5), 589–595. https://doi.org/10.1001/archneurol.2010.65
- Lawrence, A. D., Evans, A. H., & Lees, A. J. (2003). Compulsive use of dopamine replacement therapy in Parkinson’s disease: Reward systems gone awry? The Lancet Neurology, 2(10), 595-604. https://doi.org/10.1016/S1474-4422(03)00529-5
- Evans, A. H., & Lees, A. J. (2004). Dopamine dysregulation syndrome in Parkinson’s disease. Current Opinion in Neurology, 17(4), 393-398. https://doi.org/10.1097/01.wco.0000137528.23126.41
- Giovannoni, G., O’Sullivan, J. D., Turner, K., Manson, A. J., & Lees, A. J. (2000). Hedonistic homeostatic dysregulation in patients with Parkinson’s disease on dopamine replacement therapies. Journal of Neurology, Neurosurgery, and Psychiatry, 68(4), 423–428. https://doi.org/10.1136/jnnp.68.4.423
- Probst, C., & van Eimeren, T. (2013). The functional anatomy of impulse control disorders. Current Neurology and Neuroscience Reports, 13(10). https://doi.org/10.1007/s11910-013-0386-8
- Sokoloff, P., Giros, B., Martres, M. P., Bouthenet, M. L., & Schwartz, J. C. (1990). Molecular cloning and characterization of a novel dopamine receptor (D3) as a target for neuroleptics. Nature, 347(6289), 146–151. https://doi.org/10.1038/347146a0
| Recibido: 07 de septiembre, 2023 | Aceptado: 13 de aoctubre, 2023 |
Dr. Genaro Alfonso Coria-Ávila. Instituto de Investigaciones Cerebrales, Universidad Veracruzana. Xalapa, Ver. México. C.P. 91010, Tel: 52 (228) 8 418900 ext. 13066. E-mail: gcoria@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creamasal@unam.mxtivecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
