Efectos de la avulsión unilateral de las raíces ventrales lumbosacras (L6-S2) sobre la conducta postural de la coneja: una propuesta de análisis
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Victor Manuel Castillo-Castillo1, Guadalupe Leonel Rodríguez-Alvarado2, Miguel Angel Bello-Zamora3, Dora Luz Corona-Quintanilla3, Martin Alejandro Serrano-Meneses4 y Kenia López-García4*
1Doctorado en Ciencias Biomédicas, Centro de Investigaciones Biomédicas. Universidad Veracruzana, Xalapa, Veracruz; 2Doctorado en Investigaciones Cerebrales, Centro de Investigaciones Cerebrales. Universidad Veracruzana, Xalapa, Veracruz; 3Centro Tlaxcala de Biología de la Conducta, Universidad Autónoma de Tlaxcala, Tlaxcala, México; 4Departamento de Ciencias Químico-Biológicas, Universidad de las Américas Puebla, San Andrés Cholula, Puebla.
Resumen
Abstract
Introducción
Materiales y métodos
Resultados
Discusión
Conclusión
Conflicto de intereses
Agradecimientos
Referencias
Mail
El mantenimiento de la postura es una conducta motora fundamental de los mamíferos donde participan los sistemas nervioso y músculo esquelético. Un daño/alteración en la comunicación entre estos es capaz de modificarla. Se ha observado que lesiones directas o indirectas a nivel de médula espinal como la avulsión ventral lumbosacra (ARV) modifican la generación de patrones rítmicos formados por la actividad alternada entre un músculo flexor y un extensor (p. ej. locomoción y postura). Como objetivo de nuestra investigación buscamos evaluar el efecto de la avulsión unilateral derecha de las raíces ventrales lumbar 6 a sacro 2 (L6-S2) sobre la conducta postural de la coneja. Se utilizaron 12 conejas vírgenes (6 ± 2 meses de edad) divididas en dos grupos: 1) Sham (S) (n= 6), con simulación de la avulsión; y 2) Avulsionado (ARV L6-S2) (n= 6), con avulsión unilateral derecha a nivel lumbosacro (L6-S2). Quince días después de la cirugía se realizó el registro de la postura aplicando tinta en las huellas de las cuatro extremidades para ser registradas sobre papel doble carta. Las huellas fueron digitalizadas para medir las distancias y los ángulos entre ellas. La avulsión unilateral derecha L6-S2 afectó significativamente la conducta postural de la coneja mostrando diferencias significativas entre las distancias (p˂ 0.05) y los ángulos formados entre sus extremidades (p˂ 0.05). Nuestra conclusión es que la avulsión unilateral derecha L6-S2 en la coneja modifica su conducta postural y anula la locomoción debido al daño sobre la comunicación entre el sistema nervioso y el músculo esquelético.
Palabras clave: Postura, Avulsión de raíces ventrales, Nivel lumbosacro, Médula espinal, Locomoción.
Posture maintenance is a fundamental motor behavior of mammals involving the skeletal muscle and nervous systems. Damage/alteration in the communication between them is capable of modifying it. It has been observed that direct or indirect injuries to the spinal cord, such as lumbosacral ventral root avulsion (VRA), modify the generation of rhythmic patterns formed by the alternating activity between a flexor muscle and an extensor (e.g., locomotion and posture). The aim, evaluate the effect of the right-sided unilateral avulsion of ventral roots lumbar 6 to sacral 2 (L6-S2) on the posture behavior of the rabbit doe. Twelve virgin rabbit does (6 ± 2 months old) were used in this study and divided into two groups: i) Sham (S) (n= 6), with simulated avulsion; and ii) Avulsion (VRA L6-S2) (n= 6), with right-sided unilateral lumbosacral avulsion. 15 days after surgery, posture was registered by applying ink to all four paws and recorded on tabloid size paper. The prints were digitalized to measure distances and angles between them. We concluded that right-sided unilateral avulsion L6-S2 significantly affected the posture behavior of rabbit does, which showed significant differences in the distances (p< 0.05) and angles formed between their extremities (p< 0.05).
Keywords: Posture, Ventral root avulsion, Lumbosacral level, Spinal cord, Locomotion.
En los vertebrados, el músculo esquelético interviene en algunas conductas básicas y vitales como la locomoción y la postura, entre otras. La locomoción y la postura se llevan a cabo gracias a los músculos de las extremidades fundamentales para los individuos bípedos/cuadrúpedos y vertebrados/invertebrados, ya que les permite mantenerse de pie y producir la marcha proporcionándoles apoyo y equilibrio.1,2
La postura (posición y orientación de los miembros por el sistema locomotor) y el mantenimiento del equilibrio (capacidad que tiene un individuo de mantener la estática relacionada con la posición) involucran una unidad motora básica en los organismos bípedos (p. ej. humano) y cuadrúpedos (p. ej. conejo). 2,3 En estos últimos, donde encontramos al conejo, la postura más común se orienta con el dorso hacia arriba y la regulación nerviosa será activada por señales de retroalimentación sensorial, en donde participan los propioceptores (corpúsculos de Paccini, husos musculares, órganos tendinosos de Golgi y terminales libres de Ruffini), lo que compensa las desviaciones de la orientación corporal produciendo así respuestas motoras correctivas.4,5
Esta respuesta correctiva está mediada por circuitos nerviosos de regulación sensomotora que se localizan en la médula espinal, tálamo y la corteza motora a través del tracto espino-talámica-cortical, vía aferente o sensorial, y viceversa, por el tracto cortico-talámica-espinal, vía eferente o motora. Estos participan en el mantenimiento de la postura y la locomoción6 La distribución de las funciones posturales entre estos centros y la función específica para el control de la postura no están del todo claros1,22 Por una parte, estudios de lesiones completas en médula espinal han evidenciado que existe una ausencia de tono excitatorio supraespinal (los reflejos supraespinales no son lo suficientemente activados) y, por lo tanto, no se pueden compensar las perturbaciones posturales censadas por los propioceptores; mientras que a nivel medular suceden eventos bioquímicos y metabólicos que conducen a la destrucción completa de los reflejos posturales (cortico-tálamo-espinal). 7,8 Por otra, se ha determinado después de lesiones crónicas como la descerebración en modelos animales como gatos y conejos, no impide la capacidad de estos para pararse y caminar cuando se colocan posados de lado; con esto se ha comprobado que los animales exhiben un conjunto de reflejos de corrección y asumen rápidamente una postura sin perder el equilibrio.2,4,9 En conejos se ha demostrado que después de lesionar las astas ventrales de niveles torácicos (T12) ya no es posible recuperar la conducta postural, comprometiendo así la calidad de vida de los individuos. Esto nos permite suponer que una parte sustancial del sistema que controla la postura y el equilibrio del cuerpo se encuentra por debajo de los segmentos espinales torácicos, es decir, a nivel de los segmentos espinales lumbares y sacros y no a niveles del tallo encefálico, cerebelo y/o segmentos espinales cervicales.4,6,8
Parte de la regulación de la postura es generado por mecanismos a nivel de médula espinal. Algunos de estos mecanismos son impulsados por la entrada de información proveniente de los propioceptores en las extremidades que permiten el tono muscular, el estiramiento de los ligamentos y mecanismos reflejos segmentarios locales (arco reflejo), lo que sugiere que para compensar alteraciones posturales es necesaria la generación de respuestas motoras correctivas a nivel supraespinal (tálamo y corteza) y espinal.1,4,5
En la coneja, los circuitos nerviosos que controlan la micción y la musculatura estriada del piso pélvico se localizan a nivel L6-S2 de la médula espinal, así como las motoneuronas que regulan la activación/inhibición de los músculos estriados de las extremidades inferiores (p. ej. los músculos pertenecientes al cuádriceps, tríceps sural o los flexores y extensores de los dedos del pie).10,11 Con esto último podríamos pensar que una lesión en las vías de comunicación entre médula espinal-nervio-músculo estriado es capaz de provocar alteraciones en el control postural. Estudios de lesiones como la avulsión de la raíz ventral (ARV) a nivel lumbo-sacro L6-S2 han reportado alteraciones en el equilibrio de la extremidad inferior avulsionada y de los movimientos voluntarios.12 Asimismo, se ha observado que la ARV a nivel L4-L6 produce una muerte marcada y progresiva de las motoneuronas axotomizadas en ratas adultas,13 mientras que a nivel L6-S2 la ARV produce vejiga hipotónica y afecta el reflejo de micción en conejas virgenes.10 En dichos modelos de estudio no se encontraron discrepancias en los segmentos espinales con lo que se demuestra que el control de estos es semejante.11
Otros estudios reportan que la ARV disminuye axones motores que regulan la contracción de los miembros afectados,12 aumenta la expresión del péptido relacionado con el gen de la calcitonina (gen encargado del dolor), produce disfunción sensorial y dolor neuropático. 14,15 Dado que la ARV disminuye el número de axones motores, es probable que se modifiquen las características morfológicas, bioquímicas y metabólicas del músculo estriado de las extremidades produciendo alteraciones motoras y un consecuente desuso muscular,16,17 que cambiaría la postura del animal. Por lo anterior, el objetivo del presente trabajo fue evaluar el efecto de la ARV L6-S2 sobre la conducta postural de la coneja (Oryctolagus cuniculus).
Se utilizaron 12 conejas hembras vírgenes de la raza Chinchilla (Oryctolagus cuniculus) de 6 ± 2 meses de edad (adultas) alojadas en jaulas individuales de acero inoxidable (50 x 60 x 40 cm) en condiciones de iluminación 16h/8h (luz/ oscuridad) y con una temperatura de 22 ± 2°C. Las conejas tuvieron acceso a alimento en pellets (Purina®, México) y agua ad libitum. Todos los procedimientos experimentales fueron realizados en el Centro Tlaxcala Biología de la Conducta (CTBC) de la Universidad Autónoma de Tlaxcala (UATx), bajo los lineamientos de la NOM-62-ZOO-1999.
Los animales se dividieron aleatoriamente en dos grupos, cada uno con una n= 6. Al grupo Sham (S) se le realizó una laminectomía entre las vértebras óseas L5-L7 para localizar las raíces ventrales derechas de los segmentos medulares L6-S2; y al Avulsionado (ARV L6-S2), posterior a la laminectomía y, con ayuda de un gancho avulsionador (beacham tenaculum fórceps), se rompieron unilateralmente las raíces ventrales de los segmentos medulares derechos L6-S2. Después de 15 días de haber realizado la cirugía, tomando en consideración el tiempo de los procesos de regeneración/degeneración muscular y los eventos restaurativos de la médula espinal tras una lesión, se realizó el análisis de la conducta postural en ambos grupos.
2.1. Cirugía de avulsión unilateral derecha L6-S2
Los animales fueron pesados previo a la ARV; posteriormente fueron anestesiados con ketamina (Anesket®, 50 mg/kg, i.m) y pentobarbital de sodio (Cheminova®, 45 mg/kg, i.p) con un intervalo de 5 min entre cada administración. Una vez anestesiadas, se realizó la tricotomía de la parte dorso lumbar y se inició monitoreo de los signos vitales (frecuencia cardiaca y respiratoria) durante el preoperatorio, transoperatorio y postoperatorio. Estas fueron colocadas en una mesa quirúrgica en posición prona para comenzar la antisepsia (lavado quirúrgico) mediante la aplicación de un antiséptico sobre la piel, el cual se aplicó desde el sitio de la incisión hacia la periferia en el sentido de las manecillas del reloj. Posteriormente se colocaron campos quirúrgicos para dar inicio al procedimiento, se realizó una incisión (2 cm) en el dorso entre las vértebras óseas L5-L7 para romper, con el gancho avulsionador, las raíces ventrales derechas de los segmentos de la médula espinal a nivel de L6-S2. Después de la avulsión se le colocó gelfoam y se suturó la incisión quirúrgica con cátgut crómico calibre 3/0, aguja de 1/2 círculo ahusada, de 36.4 mm (mh) por planos, a músculos y piel dorsal con sutura continua bloqueante. Durante la recuperación de los animales, se les aplicó solución salina PiSA® subcutánea al 0,9% (10 ml), antibiótico (bencilpenicilina procaína con bencilpenicilina, Lab. AMSA®; 800,000 UI; 1 ml durante 3 días, i.m) y analgésico (Meloxicam 0.6 mg / kg durante 3 días Mobicox®, i.m); aunado a la aplicación de un anestésico local (lidocaína; 2 ml por s.c y top).
2.2. Análisis de la conducta postural
El análisis de la conducta postural se realizó 15 días después de la cirugía en ambos grupos. Las huellas de las cuatro extremidades fueron entintadas con un cojín para sellos empapado con tinta oscura. Cada coneja fue sujetada del dorso con una mano para posteriormente ser dejada de manera libre sobre una hoja blanca doble carta (27.94 X 43.17 cm), marcados con una escala de 20 cm, dejándola libremente hasta que pudiera mantener su postura durante al menos 15s. Posteriormente, las conejas son retiradas y las huellas marcadas durante el mantenimiento de la postura (15s) fueron utilizadas para el análisis. Este procedimiento se realizó por triplicado. Posteriormente las hojas con las huellas marcadas fueron digitalizadas para llevar a cabo el análisis de las imágenes en el programa ImageJ para Windows 2016 (versión 1.45S, NIH). De las imágenes digitalizadas se tomaron medidas de las distancias y ángulos entre las extremidades.
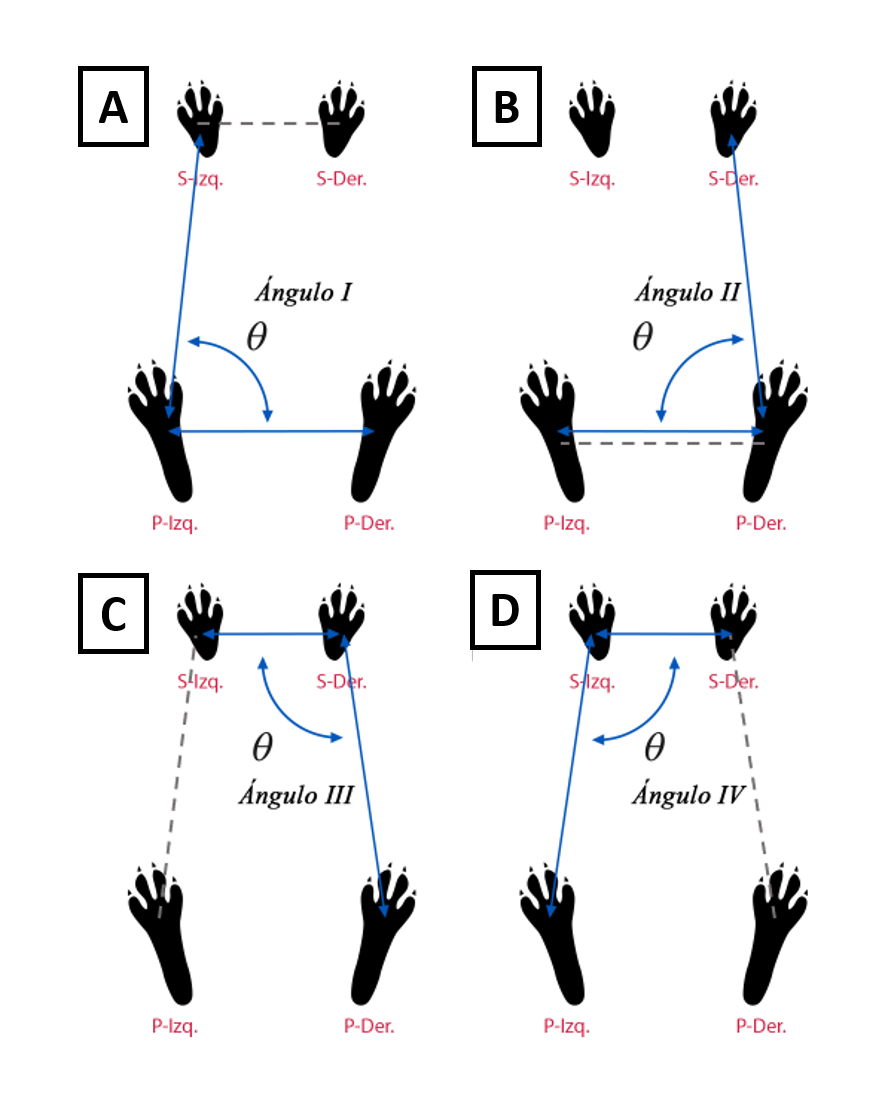
De las huellas marcadas se realizaron mediciones entre distancias y ángulos de las extremidades tomando en cuenta la parte central de cada huella de la siguiente manera: 1) de la extremidad superior izquierda (S-Izq) a la superior derecha (S-Der), 2) de la posterior izquierda (P-Izq) hacia la posterior derecha (P-Der), 3) de S-Izq a P-Izq, y 4) de S-Der a P-Der (líneas punteadas, Fig. 1). Asimismo, se realizaron las medidas de los ángulos correspondientes considerando tres de las huellas marcadas como se menciona a continuación: ángulo I: S-Izq, P-Izq y P-Der; ángulo II: P-Izq, P-Der y S-Der; ángulo III: S-Izq, S-Der y P-Der; y, ángulo IV S-Der, S-Izq y P-Izq (flechas, Fig. 1).
Figura 1. Representación esquemática de los parámetros morfométricos: distancias (líneas punteadas) y ángulos (flechas), tomados para el análisis de la conducta postural. A) Distancia entre extremidades S-Izq y S-Der, y ángulo I (S-Izq, P-Izq y P-Der); B) distancia entre extremidades P-Izq y P-Der, y ángulo II (P-Izq, P-Der y S-Der); C) distancia entre extremidad S-Izq y P-Izq, y ángulo III (S-Izq, S-Der y P-Der); D) distancia entre extremidades S-Der y P-Der, y ángulo IV (S-Der, S-Izq y P-Izq.).
2.3. Análisis estadístico
Una vez obtenidos los datos paramétricos de ambos grupos (S y ARV L6-S2) fueron sometidos a una prueba de Kolmogorov-Smirnov para probar si tenían una distribución normal. Para los datos paramétricos se utilizó una prueba t de Student para datos independientes; y para los no-paramétricos, una U de Mann-Withney tomando como variables dependientes las distancias y los ángulos entre las extremidades; y como la variable independiente el protocolo de simulación de la avulsión (Sham) y la ARV para cada grupo. Se utilizó el programa estadístico GraphPad Prism 7.0 para Windows 2016 y se consideraron diferencias significativas cuando se obtuvo un valor de p≤ 0.05. Los datos muestran la media ± e.e de cada grupo.
Cualitativamente, la posición de las extremidades para el mantenimiento de la postura en el grupo Sham tiene una distribución simétrica (Fig. 2A). Asimismo, las marcas de las huellas tienen dimensiones similares, lo que podría decirnos que la distribución del peso del animal es equitativa.
3.1. Análisis de las distancias entre las extremidades
Los resultados del análisis de las distancias entre extremidades posterior izquierda (P-Izq) a posterior derecha (P-Der) fue significativamente mayor en el grupo ARV L6-S2 comparado con el grupo S (16.61 ± 1.45 vs. 11.22 ± 1.20 cm; t10= 2.85, p= 0.017) (Fig. 2D). Mientras, la distancia entre extremidades superior izquierda (S-Izq) a posterior izquierda (P-Izq) fue significativamente menor en el grupo ARV L6-S2 (18.97 ± 0.76 vs. 25.08 ± 1.52 cm; U= 4, p= 0.026) (Fig. 2E). Asimismo, la distancia entre extremidades superior derecha (S-Der) a posterior derecha (P-Der) disminuyó significativamente (ARV L6-S2, 8.38 ± 1.08 vs. S, 24.14 ± 1.17 cm; t10= 9.85, p˂ 0.001) (Fig. 2F). Para las extremidades superior izquierda (S-Izq) a superior derecha (S-Der) no se encontraron diferencias significativas entre ambos grupos (Fig. 2C).
Figura 2. Digitalización de las huellas tomadas para el análisis de la conducta postural y análisis de las distancias entre las extremidades. A) Huellas del grupo Sham (S); B) huellas del grupo avulsionado (ARV L6-S2); distancias entre las extremidades (cm): C) S-Izq a S-Der, D) P-Izq a P-Der, E) S-Izq a P-Izq y F) S-Der a P-Der. Los datos muestran la media ± e.e. t de Student, diferencias significativas p˂ 0.05 (* p˂0.05, ***p˂ 0.0001). Escala, 20 cm.
3.2. Análisis de los ángulos entre las extremidades
Los resultados para el análisis entre las medidas de los ángulos formados entre las extremidades para el grupo ARV L6-S2 mostró una disminución significativa en el ángulo I (S-Izq, P-Izq y P-Der) comparado con el grupo S (48.33 ± 5.10 vs. 88.54 ± 3.33 θ; t10= 6.78, p˂ 0.0001) (Fig. 3A). Mientras, el ángulo II (P-Izq, P-Der y S-Der) fue significativamente mayor en el grupo ARV L6-S2 (127.5 ± 3.99 vs. 90.61 ± 2.66 θ; t10= 7.89, p˂ 0.0001) (Fig. 3B). Las medidas de los ángulos III (S-Izq, S-Der y P-Der) y IV (S-Der, S-Izq y P-Izq) no mostraron diferencias significativas entre grupos (Fig. 3C, D).
Figura 3. Análisis de los ángulos (θ) formados entre las extremidades entre los grupos Sham (S) y avulsionado (ARV L6-S2). A) Ángulo I: S-Izq, P-Izq y P-Der; B) ángulos II: P-Izq, P-Der y S-Der; C) ángulo III: S-Izq, S-Der y P-Der y D) ángulo IV: S-Der, S-Izq y P-Izq. Los datos muestran la media ± e.e. t de Student, diferencias significativas *p˂ 0.05.
La médula espinal alberga una red de neuronas que comunica las señales eléctricas de vías aferentes y eferentes con estructuras cerebrales y órganos efectores (p. ej. los músculos esqueléticos). En caso de que la médula espinal sufra una lesión, la interacción médula espinal-nervio-músculo estriado modifica funciones básicas como la sensibilidad (p. ej. el dolor neuropático), el movimiento y la postura, a nivel de los segmentos medulares L4-L6 y L6-S2.12-13,17 En este trabajo evaluamos el efecto de la ARV L6-S2 sobre la conducta postural de la coneja, donde encontramos diferencias significativas en la posición: distancias y ángulos entre las extremidades. Las diferencias fueron mayores en las extremidades ipsilaterales a la avulsión que en las contralaterales.
Las lesiones medulares traumáticas inducen a afecciones de los circuitos del tracto cortico-talámico-espinal, afectando la comunicación médula-nervio-músculo. Cuando existe una lesión medular, se induce a la muerte neuronal, cambios bioquímicos y metabólicos, que inducen a la degeneración Walleriana de los axones, afectando la postura y la locomoción.18-20 Estos cambios también se han visto en modelos animales con daño medular en cuadrúpedos como conejos y gatos.4,6 En nuestro modelo, la ARV L6-S2 corta la comunicación periférica de la médula espinal hacia los músculos, con lo que podemos sugerir que ocurre un evento similar a la lesión reportada en los modelos anteriores, ya que las distancias y los ángulos entre las extremidades de la coneja, con el fin de mantener la conducta postural se modifican. Si bien existen otros protocolos para el análisis de la postura utilizando planchas de inclinación para la evaluación del control del balance después de distintos protocolos experimentales donde se sugiere que el control del balance corresponden a los circuitos neuronales que residen en el nivel del tronco encefálico, cerebelo y médula espinal (cervicales) y la respuesta de excitación de los músculos extensores que permiten que la extremidad asuma la carga adicional provocada por un desplazamiento del centro de masa proporcionando un soporte para el tronco hasta que vuelve a la posición inicial con igualdad de cargas entre las dos extremidades.4,9 Nuestro protocolo del análisis de la postura es un protocolo poco invasivo, económico y fácil de realizar en el laboratorio; pero sobre todo, nos proporciona información relevante acerca de las alteraciones posturales y sus respuestas de compensación para su mantenimiento (distancias y ángulos de las extremidades). Nuestros resultados sirven como antecedente para realizar un estudio más profundo y en tiempos posteriores del análisis de la conducta postural y la locomoción, y evaluar así su evolución. Esto provee información más precisa sobre cómo y en qué grado la ARV L6-S2 afecta esas conductas básicas a través de la inhibición en la comunicación del circuito médula-nervio-músculo estriado. Lo que nos sugiere profundizar sobre los procesos morfofisiológicos (bioquímicos y metabólicos) en la médula espinal y las motoneuronas, así como los posibles cambios fenotípicos y metabólicos de los músculos estriados que estas inervan, aunado a que la ARV unilateral derecha no sólo causa alteraciones ipsilaterales, sino que ocasiona un consecuente desuso muscular contralateral.
La inervación de músculos estriados como el sóleo (músculo de posición plantar) y el EDL (músculo de extensión del 2-4 dedo del pie), son importantes para el desarrollo de conductas básicas como la locomoción y la postura, esta proviene de los segmentos medulares de L6-S3. Específicamente, sus motoneuronas se encuentran en la lámina IX de Rexed, con nuestro protocolo de ARV pudimos corroborar un efecto claro en la alteración del desarrollo de las funciones básicas que estos músculos desempeñan.11 Considerando la inhibición en la locomoción y los cambios en la posición de las extremidades, se sugiere que esta respuesta es una conducta de protección inducida por disfunciones sensoriales como lo es el dolor neuropático, con lo que se modifica la distribución del peso necesario para el mantenimiento de la postura en cada una de estas. Por lo cual, podemos deducir que los músculos han perdido parte de la comunicación nerviosa sensomotora y el tono muscular, lo cual sugiere disfunciones en las vías motora y sensorial, las cuales son indispensables para mantener la postura y distribuir el peso corporal de manera equitativa. En nuestro modelo de estudio fue posible observar como la falta de tono muscular, induce a una compensación del peso en las extremidades contralaterales a la ARV e inclusive estos cambios de peso pueden inducir a mecanismos de plasticidad muscular.21
Con lo anterior, el siguiente paso es analizar las alteraciones de dicho protocolo (ARV) sobre las características morfofisiológicas en los músculos estriados. Esto nos daría información sobre las alteraciones musculoesqueléticas en relación con los procesos de lesión/regeneración por las que están cursando. En otros estudios se ha demostrado que los músculos de las extremidades inferiores presentan alteraciones en sus características morfofisiológicas y propiedades contráctiles en modelos de daño al hipocampo en gatos y ratas, por lo que es muy probable que, en nuestro modelo, un modelo de lesión a un nivel más inferior en la escala de comunicación médula espinal-nervio-músculo estriado provoque también diferencias morfofisiológicas, e incluso metabólicas en los músculos involucrados.20,22
La ARV L6-S2 unilateral en la coneja afecta su conducta postural evidenciado por los cambios en la distancia y ángulos entre sus extremidades posteriores con el fin de mantener un equilibrio. Lo que nos hace suponer que el control espinal de la postura se localiza en los segmentos L6-S2.
Los autores declaran no tener conflicto de intereses.
Este trabajo recibió apoyo de financiamiento de los proyectos CB2015 2566990 y CF1311312 de DLCQ (CONACYT) y del SNI No. 63806 de KLG. Los estudiantes VMCC y GLRA están recibiendo una beca CONACYT de Doctorado (CVUs: 560896 y 960979, respectivamente).
1. Macpherson JM, Fung J, Jacobs R. Postural orientation, equilibrium, and the spinal cord. Adv Neurol 1997 72:227‐232.
2. Lyalka VF, Orlovsky GN, Deliagina TG. Impairment of postural control in rabbits with extensive spinal lesions. J Neurophysiol 2009 101(4): 1932-1940.
3. Pollock AS, Durward BR, Rowe PJ, Paul JP. What is balance? Clin Rehabil 2000 14(4): 402-6.
4. Musienko EP, Deliagina TG, Gerasimenko PY, Orlovsky GN, Zelenin VP. Limb and trunk Mechanisms for balance control during locomotion in quedrupeds. J. Neurosci 2014 34(16): 5704-5716.
5. Henry M, Baudry S. Age-related changes in leg proprioception: implications for postural control. J Neurophysiol. 2019 122(2): 525-538.
6. Brown RA, Martinez M. From cortex to cord: motor circuit plasticity after spinal cord injury. Neutral regenerations research 2019 14(12): 2054-2062.
7. Deliagina TG, Beloozerova IN, Popova LB, Sirota MG, Swadlow H, Grant G, Orlovsky GN. Role of different sensory inputs for maintenance of body posture in sitting rat and rabbit. Motor Control 2000 4:439-452.
8. Lyalka VF, Zelenin PV, Karayannidou A, Orlovsky GN, Grillner S, Deliagina TG. Impairment and recovery of postural control in rabbits with spinal cord lesions. J Neurophysiol 2005 94:3677–90.
9. Karayannidou A, Zelenin VP, Orlovsky NG, Sirota GM, Beloozerova NI, Deliagina GT. Maintenance of lateral stability during standing and walking in the cat. J neurophysiol 2009a 101: 8-19.
10. Corona-Quintanilla DL, López-Juárez R, Pacheco P, Romero-Ortega MI, Castelán F, Martínez-Gómez M. Bladder and urethral dysfunction in multiparous and mature rabbits correlates with abnormal activity of pubococcygeus and bulbospongiosus muscles. Neurourol Urodyn. 2020 39(1): 116‐124.
11. Portal JJ, Corio M, Viala D. Localization of the lumbar pools of motoneurons which provide hindlimb muscles in the rabbit. Neurosci Letters 1991 124: 105-107.
12. Horak F, Macpherson J. Postural orientation and equilibrium. In: Handbook of Physiology. Exercise: Regulation and Integration of Multiple Systems. Shepard J, Rowell L. New York: Oxford, 1996 255–292.
13. Torres-Espín A, Corona-Quintanilla DL, Forés J. Allodi I, González F, Udina E y Navarro J. Neuroprotection and axonal regeneration after lumbar ventral root avulsion by re-implantation and mesenchymal stem cells transplant combined therapy. Neurotherapics 2013 10: 354-368.
14. Sindou M, Mertens P. Wael M. Microsurgical DREZotomy for pain due to spinal cord and /or cauda equina injuries: long-term results in a series of 44 patients. Pain 2001 92: 159-171.
15. Chew DP, Bhatt DL, Topol EJ. Oral glycoprotein IIb/IIIa inhibitors: why don’t they work? Am J Cardiovasc Drugs 2001 1(6):421-8.
16. Collins J, Ishihara Y, Thoma A. Management of digital tendon avulsion at the musculotendinous junction of the forearm: a systematic review. Hand (NY). 2012 7(2):134–142.
17. Ganzer, PD, Darrow, MJ, Meyers, EC, Solorzano, BR, Ruiz, AD, Robertson, NM, Adcock, KS, James, JT, Jeong, HS, Becker, AM, Goldberg, MP, Pruitt, DT, Hays, SA, Kilgard, MP y Rennaker, RL. Closed-loop neuromodulation restores network connectivity and motor control after spinal cord injury. Elife. 2018 7: e32058.
18. Diogo CC, da Costa LM, Pereira JE, Filipe V, Couto PA, Geuna S, Armada-da-Silva PA, Maurício AC, Varejão ASP. Kinematic and kinetic gait analysis to evaluate functional recovery in thoracic spinal cord injured rats. Neurosci Biobehav Rev 2019 98: 18-28.
19. McCrea DA, Rybak IA. Modeling the mammalian locomotor CPG: insights from mistakes and perturbations. Prog Brain Res 2007 165: 235–253.
20. Vega-Avelaira D, Géranton SM, Fitzgerald M. Differential regulation of immune responses and macrophage/neuron interactions in the dorsal root ganglion in young and adult rats following nerve injury. Mol Pain 2009 5: 70.
21. Blaauw B., Schiaffino S. y Reggiani C. Mechanisms modulating skeletal muscle phenotype. Comprehensive Physiology 2013 3: 1645-1687.
22. Rossignol S, Giroux N, Chau C, Marcoux J, Brustein E, Reader TA. Pharmacological aids to locomotor training after spinal injury in the cat. J Physiol 2001 533(1): 65–74.
| Recibido: 8 de agosto, 2020 | Aceptado: 19 de mayo, 2021 |
*Correspondencia: Kenia López García. Departamento de Ciencias Químico-Biológicas, Universidad de las Américas Puebla, San Andrés Cholula, C. P. 72810, Puebla, México. Teléfono: (246) 1344050. E-mail: kenia.lopez@gmail.com
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creamasal@unam.mxtivecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.