Interacción entre la hormona del crecimiento y el sistema glutamatérgico: Implicaciones para la plasticidad cerebral
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Isaac Zamora-Bello1, María-Leonor López-Meraz1
1Centro de Investigaciones Cerebrales, Universidad Veracruzana Xalapa, Veracruz, México.
Resumen
Introducción
Metodología
Generalidades sobre la hormona del crecimiento
Hormona del crecimiento y plasticidad cerebral
Generalidades sobre el sistema glutamatérgico
El sistema glutamatérgico regula la liberación de la hormona del crecimiento
La hormona del crecimiento modula a los receptores a glutamato
Conclusión
Agradecimientos
Conflicto de intereses
References
Mail
Resumen: La hormona del crecimiento (HC) es una hormona proteica que posee efectos pleiotrópicos, tanto a nivel sistémico como cerebral. La HC participa en el desarrollo del sistema nervioso al regular el crecimiento, la proliferación, la diferenciación y la supervivencia celular. Además, la HC está involucrada en procesos de plasticidad cerebral como el aprendizaje y la memoria, e incluso de neuroprotección. Sin embargo, en dichos procesos, la participación del sistema glutamatérgico es fundamental. La evidencia apunta a que la HC y el glutamato mantienen una relación estrecha de modulación para promover dichos cambios plásticos, por lo que la presente revisión compila la relación que existe entre ambos sistemas.
Palabras clave: Hormona del crecimiento, memoria, glutamato, receptor AMPA, receptor NMDA.
The growth hormone (HC) is a protein hormone with body and brain pleiotropic effects. HC participates in the development of the nervous system by regulating cell growth, proliferation, differentiation, and survival. Furthermore, HC is involved in processes of brain plasticity such as learning and memory, and neuroprotection. However, in such effects, the role of the glutamatergic system is essential. The evidence suggests that there is a close modulation relationship between the HC and the glutamate system to promote those plastic changes. This review compiles the information available nowadays on this topic.
Keywords: Growth hormone, memory, glutamate, AMPA receptor, NMDA receptor.
La hormona del crecimiento (HC) es la hormona más abundante en humanos y es secretada por la adenohipófisis. Su liberación se regula de forma positiva por la hormona liberadora de la hormona del crecimiento (GHRH, siglas en inglés para Growth-Hormone-Releasing Hormone), y de forma negativa por la somatostatina (SS). Después de su liberación por las células somatotróficas, la HC se distribuye a través de la sangre hacia los órganos blanco en varios tejidos periféricos, en los que se une a su receptor para promover el crecimiento y el metabolismo.1 En las últimas décadas se ha recopilado información que muestra que el cerebro, en particular estructuras del sistema límbico, son sitios diana de la HC. Lo anterior se ha relacionado con lo observado en personas con deficiencia en la producción de HC, quienes exhiben alteraciones en su salud mental, así como con pérdida de memoria y de capacidades cognitivas.2 Por otro lado, el glutamato es un neurotransmisor excitador distribuido ampliamente en todo el cerebro y la médula espinal, tanto en neuronas como en la glía,3
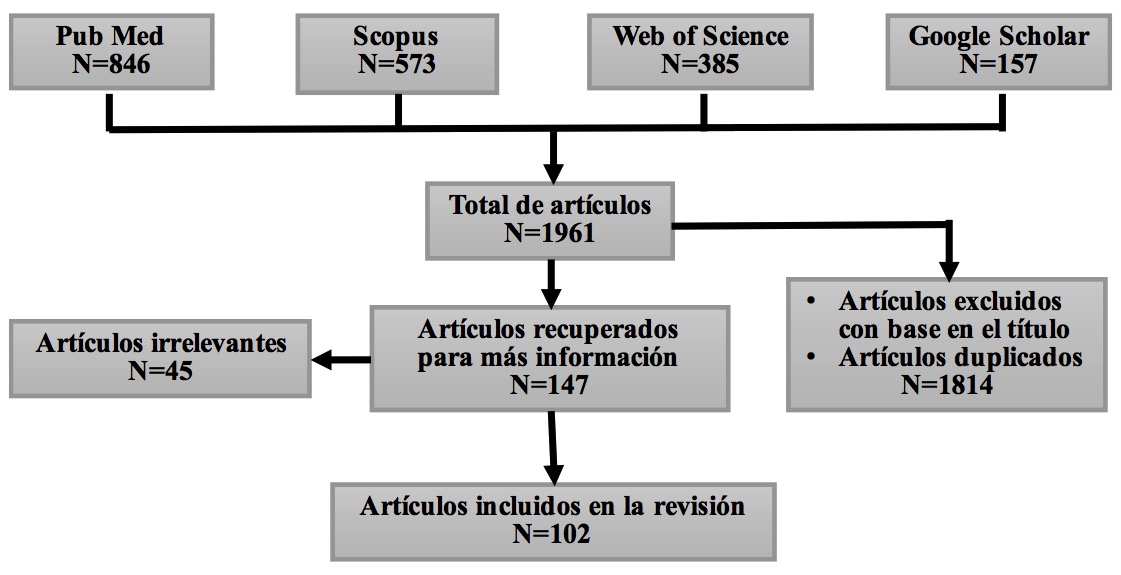
En el presente manuscrito se revisaron las evidencias científicas que relacionan a la HC y el sistema de neurotransmisión glutamatérgico. La revisión bibliográfica consideró artículos originales y de revisión referentes a la modulación de la HC sobre el sistema glutamatérgico y viceversa. Se siguieron las recomendaciones PRISMA-P para el reporte de revisiones sitemáticas,4 y se realizaron búsquedas exhaustivas en las bases de datos electrónicas Scopus, PubMed, Web of Science y Google Scholar, en un intento por identificar estudios realizados en personas, en animales de experimentación, así como realizados tanto in vivo como in vitro. Se emplearon las siguientes palabras clave (en idioma español e inglés): “hormona del crecimiento”, “growth hormone”, “glutamato”, “glutamate”, “receptores de glutamato”, “glutamate receptors”, “hormona del crecimiento y glutamato”, “growth hormone and glutamate” y “secretagogo”. De esta búsqueda se obtuvieron 1962 referencias bibliográficas publicadas entre 1957 y 2019, de las cuales se seleccionaron 108 para este trabajo de revisión. En la figura 1 se muestra el diagrama de flujo que se siguió para identificar las publicaciones que cumplieron los criterios de elegibilidad y fueron incluidas en la presente revisión.
Figure 1. Diagrama de flujo que muestra el procedimiento que se siguió para identificar las publicaciones que cumplieron los criterios de elegibilidad y fueron incluidas en la revisión.
3. Generalidades sobre la hormona del crecimiento
La HC es una proteína de 191 aminoácidos y con un peso molecular de 21.5 kDa. Se sintetiza en la adenohipófisis por las células somatótropas.1,5-7 El gen de esta hormona se encuentra codificado en el brazo largo del cromosoma 17 y está constituido por 1.65 Kb que incluyen 5 exones y 4 intrones.1,6 En el torrente sanguíneo, cerca de la mitad de la HC circula unida a una proteína de transporte de alta afinidad (GHBP, de las siglas en inglés para Growth hormone-binding protein), lo que aumenta su vida media, para posteriormente llegar a su célula blanco y unirse a su receptor especifico, el receptor de la hormona del crecimiento (RHC).1,8,9 Este receptor se encuentra distribuido en varios órganos y tejidos del cuerpo humano, tales como el hígado, el pulmón, el riñón, las glándulas mamarias, el músculo estriado, el tejido adiposo, el hueso y el cartílago. En el cerebro, el RHC tiene presencia en estructuras como la amígdala, la corteza, el tálamo, el estriado, la formación reticular y el hipocampo.10-17 Algunas de estas estructuras forman parte del sistema límbico y son responsables de las emociones y formación de la memoria (principalmente el hipocampo y la amígdala).18
La HC promueve una compleja cascada de señalización cuando interacciona con su receptor, lo que ha complicado atribuir la participación específica de tales moléculas a cada una de sus funciones fisiológicas. La HC puede generar sus efectos periféricos directamente a través de la activación de su receptor (vía de señalización JAK-STAT), o indirectamente, a través del factor de crecimiento parecido a la insulina I (IGF-I, por sus siglas en inglés insulin-like growth factor-1).6,15,19,20
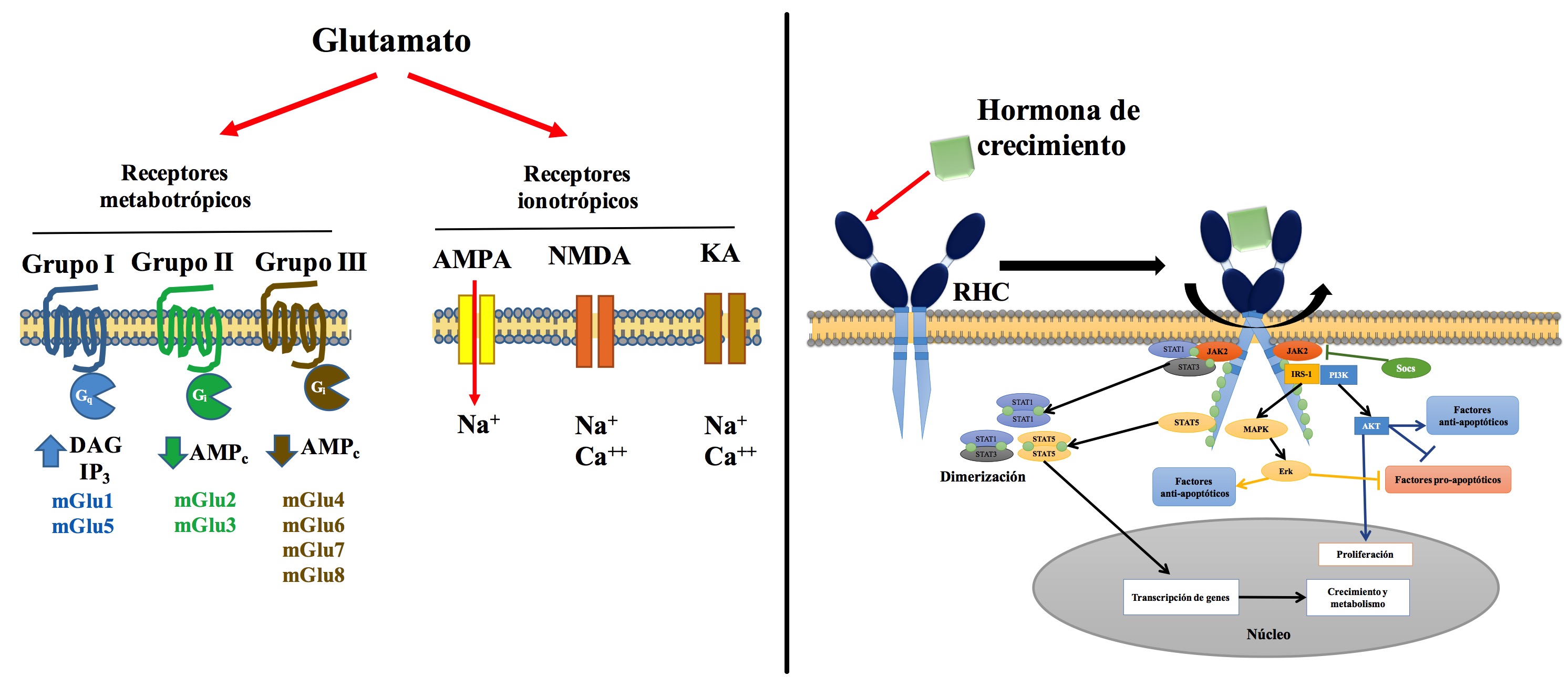
El RHC es miembro de los receptores a citoquinas tipo I y utiliza la vía de señalización de JAK-STAT.16,21,22 Estructuralmente, el RHC está conformado por un dominio extracelular (DEC), un dominio intracelular (DIC) y un dominio transmembranal (DTM); El DIC se encuentra asociado a moléculas de actividad tirosina cinasa como JAK2 (Janus Kinase 2).21-24 El RHC existe predominantemente de forma dimérica, unido por sus hélices transmembranales, mismas que se encuentran de forma paralela en estado basal y de forma cruzada o de tijera (crossover) en estado activo.22,23 La interacción de la HC con su receptor, promueve que las proteínas JAK2 que se encuentran acopladas en la secuencia Box1 del DIC se transfosforilen por su cercanía y fosforilen sustratos como los IRS-1 y IRS-2 (por las siglas en inglés para Insulin receptor substrate),25 mismos que activan la vía de la proteína cinasa B (Akt), la cual, conduce a una respuesta proliferativa y antiapoptótica.26,27 Posteriormente, las fosfotirosinas distales del DIC, por medio de interacciones con los dominios SH-2 Stat, activan al traductor de señal y activador de la trascripción STAT (por las siglas en inglés para signal transducer and activator of transcription) 1, 3, 5a y 5b.22,24,28 Las STATs se dimerizan y translocan al núcleo celular, se unen a secuencias específicas de ácido desoxirribonucleico y promueven la transcripción de genes.22,24,28 Sin embargo, existen otros mecanismos transduccionales relacionados con la HC, tal es el caso vía de señalización que implica al proto-oncogén c-Src y que es independiente de JAK2. Esta vía implica la activación de MAPK y ERK 1 y 2.29 Por otro lado, existen también moléculas supresoras de la señal de transducción de receptores de citoquinas o “Socs” (por las siglas en inglés para suppressor of cytokine signaling), quienes regulan negativamente el mecanismo transduccional desencadenado por la unión de HC a su receptor (Figura 2).30
Figure 2. Esquema reepresentativo de los receptores glutamatérgicos (panel izquierdo) y del mecanismo transduccional que resulta de la activación del receptor de la hormona de crecimiento (panel derecho). El glutamato posee receptores ionotrópicos (AMPA, NMDA y Kainato) y metabotrópicos (mGlu1 a 8) cuya activación promueve cambios en las concentraciones intracelulares de los iones sodio y calcio (Na+ y Ca++) y de los segundos mensajeros inositoltrifosfato (IP3) y diacilglicerol (DAG). La unión de la hormona de crecimiento con su receptor (RHC) promueve un cambio conformacional en éste y el inicio de una cascada de señalización mediada por JAK/STAT/IRS, misma que favorece la proliferación celular y factores anti-apoptóticos, y un efecto contrario sobre factores pro-apoptóticos. Abreviaciones: mGlu, receptor metabotrópico; JAK2, cinasa Janus 2; PI3K, fosfatidil inositol 3 cinasa; Akt, proteína cinasa B; Erk, cinasa regulada por señales extracelulares; IRS-1, sustrato del receptor de insulina 1; MAPK, proteína cinasa activada por mitógeno; STAT, traductor de señal y activador de la trascripción; Socs, supresor de señalización de citoquinas (ver el texto para más detalle).
4. Hormona del crecimiento y plasticidad cerebral
La función principal de la HC está relacionada con el crecimiento corporal y el metabolismo de carbohidratos.1,31,32 Además, se sugiere que la HC tiene un papel importante tanto en el desarrollo embrionario como en el desarrollo del sistema nervioso central (SNC), relacionado con la proliferación, la diferenciación y la supervivencia neuronal.13,33-35 La HC también se ha involucrado con la plasticidad cerebral a diferentes niveles.
Pero ¿qué es la neuroplasticidad? También llamada plasticidad cerebral o neural, es un proceso adaptativo que implica cambios en la función del sistema nervioso o del cerebro, que pueden ocurrir a nivel estructural, funcional o de conexiones y que tienen lugar en respuesta a estímulos intrínsecos o extrínsecos.36,37 La neuroplasticidad puede dividirse en dos mecanimos principales: 1) Regeneración neuronal/arborización colateral, que implica a la plasticidad sináptica y la neurogénesis y 2) reorganización funcional, que implica la equipotencialidad (considera que cuando un área del cerebro se daña, la misma región pero del hemisferio contralateral puede llevar a cabo la función pérdida), la vicariación (capacidad del cerebro de reorganizar regiones cerebrales para llevar a cabo una función que originalmente no realizaba) y la disquiasis (pérdida de la función en una región distante a la que ha sido dañada debido a las conexiones existentes entre ambas.36
De interés para el desarrollo de esta revisión es la plasticidad sináptica, misma que puede definirse como la capacidad de promover cambios a largo plazo en la fuerza de las conexiones neuronales dependientes de la experiencia37 La plasticidad implica la capacidad que tiene el sistema nervioso de modificar su funcionalidad o morfología a través de los circuitos neuronales desarrollados por el aprendizaje, la memoria o un daño a su integridad.38,39
En este sentido, un estudio reciente reportó que la HC favorece la espinogénesis en las dendritas de las neuronas hipocampales y corticales de ratas.40 En dicho estudio la HC se administró i.c.v. (120 ng al día, por 7 días) y promovió un aumento en la longitud dendrítica total, tanto en la región CA1 del hipocampo dorsal, como en la corteza prefrontal; además, la HC favoreció también la presencia de espinas dendríticas con forma de hongo en la región de CA1 del hipocampo. Este tipo de espinas dendríticas son indicadores de sinapsis excitatoria funcional, 41 lo que podría explicar la participación de la HC en la cognición, la memoria de trabajo y a largo plazo.40 En concordancia con estos hallazgos, desde hace décadas se detectó por inmunoreactividad la presencia del RHC en las células piramidales del hipocampo, en las neuronas del hipotálamo y en astrocitos de ratas neonatas, lo que sugiere que la HC puede ejercer acciones directas sobre estas células. 11 Adicionalmente, se sabe que la aplicación sistémica de la HC aumenta la transcripción de varios genes neuronales y gliales en el hipocampo y en la corteza de ratas hipofisectomizadas a las que se les infundió la HC de forma continua a través de minibombas osmóticas o de la aplicación diaria de dos inyecciones de ésta hormona durante 7 días. La HC específicamente incrementa la transcripción de los genes Ghr, Cx43 y Hbb (que codficican para el RHC, la proteína alfa-1 de las uniones comunicantes y la neurohemoglobina beta, respectivamente) en la corteza de estas ratas; mientras que en el hipocampo la HC aumenta la transcripción sólo de Hbb.42 Considerando estos hallazgos, la HC puede modular la plasticidad sináptica del hipocampo, y entonces la sobreexpresión de la HC podría conducir a una mejora de su función. 43
Por otra parte, el hipocampo está relacionado con la memoria espacial, un tipo de memoria declarativa que codifica, almacena y recupera información acerca de rutas y localizaciones espaciales; así como con la memoria de trabajo, un tipo de memoria a corto plazo necesaria para realizar operaciones cognitivas complejas, como el aprendizaje y el razonamiento.44,46 La HC está presente en el hipocampo, debido a su síntesis extra hipofisaria, misma que se lleva a cabo por las neuronas hipocampales, donde puede actuar como un neuromodulador local.43,47 De hecho, la HC se considera un factor relevante en la función hipocampal, cuya secreción puede modificarse debido a la edad, al sexo, al estrés o incluso a las crisis epilépticas.43,48-50 La presencia de la HC en el hipocampo sugiere que está relacionada con procesos cognitivos de aprendizaje y memoria. En este sentido, personas con deficiencia de HC presentan trastornos neurológicos y cognitivos como son la pérdida de memoria, alteraciones del sueño, trastornos del estado de ánimo y déficits de atención.2 Además, la disminución de la secreción de HC durante la vejez se relaciona con las consecuencias cognitivas propias de la edad, como la pérdida de memoria.2 Por otro lado, a nivel experimental se ha documentado que el estrés crónico (estrés por inmovilización) afecta la memoria y el aprendizaje en ratas, y disminuye los niveles de HC en el hipocampo.43 La restauración de los niveles de HC en el hipocampo dorsal de dichas ratas (a través de infusiones intra-hipocampales de la HC) revirtió las deficiencias asociadas al estrés crónico.43
La señalización intracelular desencadenada por la HC es compleja y no se conoce el mecanismo preciso por el cual la HC participa en los procesos de plasticidad y memoria; no obtante, la evidencia sugiere que podría ser directamente a través de la activación de su receptor RHC, similar a como lo hace de forma periférica (es decir, a través de la vía de señalización JAK-STAT), o indirectamente a través del factor de crecimiento parecido a la insulina I (IGF-I, por sus siglas en inglés insulin-like growth factor-1).6,15,19,20 Una forma de estudiar los efectos de la HC independientes del IGF-I es a través de la vía de señalización STAT5, pues la activación del RHC recluta la vía de señalización STAT5 mientras que IGF-I no lo hace.51 STAT5 juega un papel importante en la acción de la HC para el crecimiento corporal posnatal, la participación en la transcripción del gen IGF-I inducida por HC en el hígado y se requiere de STAT5 para los procesos de aprendizaje y memoria.51,52 En un estudio realizado por Furigo y colaboradores utilizaron ratones knockout a STAT5, los cuales presentaron problemas de aprendizaje y formación de memoria en la prueba de reconocimiento de objetos, el laberinto de Barnes, así como en la prueba de condicionamiento del miedo.51 Además, existió una disminución de IGF-I en el hipocampo de estos ratones, lo que sugiere que la producción de IGF-1 mediada por HC en el hipocampo es importante para mantener la memoria.51
El efecto benéfico de la HC se extiende incluso a procesos neurodegenerativos. Debe recordarse que la excitotoxicidad es un proceso dependiente en gran medida, pero no exclusivamente, de la liberación excesiva de glutamato, quien al activar sus receptores ionotrópicos altera la homeostasis de Ca++, lo que promueve la producción de radicales libres, estrés oxidativo, disfunción mitocondrial y la activación de cascadas de señalización que provocan muerte neuronal.53,54.55 Este fenómeno se considera relevante en enfermedades neurodegenerativas como el Alzheimer, así como en el accidente cerebrovascular. 53,54.55
En modelos animales de la enfermedad de Alzheimer, la administración periférica de la HC redujo los déficits de aprendizaje y memoria provocados por la administración i.c.v. del péptido β-amiloide o la lesión eléctrica del núcleo basal de Meynert.26,57 La HC también mostró efectos neuroprotectores ante el daño cerebral producido por hipoxia e isquemia moderada y severa en ratas neonatas y juveniles.34,58,59 De esta manera, se ha propuesto que el mecanismo por el cual la HC ejerce este efecto se debe a su capacidad de modular el proceso de apoptosis neuronal subsecuente al insulto cerebral.34,58,59 La HC incluso ha mostrado tener efectos benéficos ante la privación prolongada del sueño en ratas, pues su aplicación sistémica protegió a los precursores neurales del giro dentado del hipocampo del efecto deletéreo de este insulto.60
Resulta importante mencionar que las personas con deficiencia de HC también presentan diversas alteraciones metabólicas y endocrinas, entre las que resaltan un mayor riesgo cardiovascular, resistencia a la insulina, una reducción de la masa magra y la densidad ósea, niveles elevados de colesterol total, de lipoproteínas de baja densidad y de triglicéridos, así como niveles elevados de fibrinógeno.61 Lo anterior dificulta definir si los efectos son a causa de la falta de señalización del RHC o por un factor indirecto, como lo es la disminución de los niveles del IGF-I por la deficiencia de HC.62
5. Generalidades sobre el sistema glutamatérgico
El glutamato es el principal neurotransmisor excitador del sistema nervioso.3 Aproximadamente el 33% del glutamato del sistema nervioso actúa como neurotransmisor y el resto participa en otras funciones tales como el metabolismo de proteínas, la detoxificación de amoniaco y la transaminación.63 Al menos 30 proteínas están involucradas en el control de la sinapsis glutamatérgica. Estas proteínas participan como receptores o transportadores y se encuentran en la membrana de las neuronas presinápticas y postsinápticas, en los astrocitos, así como en las neuronas inhibidoras cercanas que usan al ácido γ-aminobutírico (GABA) como neurotransmisor.3
Los receptores de glutamato se clasifican en ionotrópicos (canales sensibles a ligando) que incluyen al receptor NMDA (por las siglas de su agonista N-Metil D-Aspartato), el receptor AMPA (por las siglas en inglés de su agonista el ácido α-amino-3-hidroxi-5-metilo-4-isoxazolpropiónico) y el receptor a kainato (cuyo agonista es el ácido kaínico, KA); y metabotrópicos o receptores de 7 dominios transmembranales acoplados a proteínas G, denominados mGluR1 a 7.64-68 La relevancia de los receptores inotrópicos a glutamato radica en la capacidad de generar cambios rápidos y directos en el potencial de membrana; al ser activados por glutamato, permiten el influjo de los cationes Na+ y Ca++ [comúnmente: AMPA, Na+; NMDA, Na+ y Ca++; KA, Na+ y Ca++], lo cual promueve despolarización neuronal y la activación de señales dependientes de Ca++. Quizás el receptor más ampliamente relacionado con los procesos de plasticidad neuronal es el receptor NMDA, cuya característica principal es ser un receptor dependiente de ligando y de voltaje (bloqueado en condiciones basales por el ión Mg++) con mayor sensibilidad al glutamato que sus pares ionotrópicos. Por su parte, los receptores metabotrópicos ejercen sus efectos indirectamente, modulan la excitabilidad neuronal ya sea promoviendo efectos inhibitorios o excitatorios de forma lenta. Estos receptores se agrupan en 3 familias: 1) Grupo I, receptores acoplados a Gq (aumentan los niveles intracelulares de diacilglicerol e inositol trifosfato), incluye a mGlu1 y mGlu5; 2) Grupo II, receptores acoplados a Gi (disminuyen los niveles intracelulares de adenosintrifostafo cíclico), incluye a mGlu2 y mGlu3; 3) Grupo III, receptores acoplados a Gi (disminuyen los niveles intracelulares de adenosiltrifostafo cíclico), incluye a mGlu4, mGlu6, mGLu7 y mGlu8 (Figura 2).69
Los receptores glutamatérgicos están presentes en las neuronas presinápticas y postsinápticas, así como en las células gliales, por lo que los efectos del glutamato están determinados por la localización y el subtipo de receptor presente, además de las interacciones con diversas proteínas de andamiaje y señalización en la postsinapsis.70,71 Así, la activación de los receptores a glutamato participa en fenómenos de plasticidad sináptica, tales como la potenciación a largo plazo (comúnmente conocida como LTP, Long Term Potentiation ) y la depresión a largo plazo (LTD, Long Term Depression ).70,71
Considerando lo anterior, no es de sorprenderse que el glutamato participe en la regulación de la liberación de la HC y sus efectos plásticos. Estos aspectos se revisan en los siguientes apartados enfatizando la interacción entre la HC y los receptores glutamatérgicos ionotrópicos.
6. El sistema glutamatérgico regula la liberación de la hormona del crecimiento
El eje hipotálamo-hipófisis es una vía compleja de información cuya función principal es la regulación y equilibrio de los niveles de las hormonas hipofisarias en el organismo.72 La hipófisis secreta la hormona estimulante de la tiroides (TSH), la hormona adrenocorticotrópica (ACTH), la prolactina (PRL), la hormona luteinizante (LH), la hormona folículo estimulante (FSH) y la HC. La secreción de estas hormonas es pulsátil y refleja el estímulo ejercido por un conjunto de factores liberadores hipotalámicos específicos.72 La secreción de la HC está controlada por señales centrales como GHRH y SS, y señales periféricas, como las hormonas gonadales.72-74 La GHRH estimula la proliferación de las células somatótropas de la hipófisis y regula la capacidad de secreción de HC, a través de su receptor acoplado a proteínas G, y su efectividad está modulada por la secreción testicular.72-74 La SS se sintetiza en neuronas localizadas en el hipotálamo anterior y en el área preóptica e inhibe la secreción de HC a través de sus propios receptores, al inhibir la síntesis y secreción hipotalámica de GHRH.72
Como se mencionó anteriormente la HC es secretada por la adenohipófisis y ésta a su vez es regulada por el hipotálamo, el cual posee gran cantidad de neuronas glutamatérgicas.75,76 Por ejemplo, el glutamato regula al núcleo paraventricular hipotalámico (PVN), una región crucial en el control de la regulación homeostática, la función pituitaria-adrenocortical, el tono cardiovascular, el equilibrio metabólico, el parto y la lactancia.77 El PVN expresa el ARNm de las subunidades NR1, NR2A y NR2B del receptor NMDA, tanto en su región perinuclear como en la zona subparaventricular. Mientras que el ARNm de la subunidad GluA1-4 del receptor AMPA y la subunidad GluK1-5 del receptor KA se expresaron de manera heterogénea en el PVN y el entorno. Lo anterior sugiere la capacidad para la regulación multifacética de la función de PVN por glutamato.77 La participación del glutamato en la regulación de la secreción hipofisaria se reforzó al comprobar que la administración intermitente de NMDA, aceleró el inicio de la pubertad en ratas hembra, al mejorar la liberación de la LH a través de la hormona liberadora de LH (LHRH).78 Además, el 2-amino-5-fosfono-valerato (AP-5), un antagonista competitivo de los receptores NMDA, tuvo un efecto supresor sobre la secreción pulsátil de gonadotropina.79 Estos datos implicaron un papel fisiológico del glutamato en la liberación episódica de LHRH, ejercida a través de una acción sobre los receptores NMDA.79
Fue hace poco más de tres décadas que por primera vez se sugirió el control de la secreción de la HC por el glutamato.80 Ratas adultas e infantes (21 días de edad) que recibieron L-glutamato monosódico (MSG, siglas en inglés para monosodium glutamate, 1 mg/Kg) presentaron trastornos conductuales, metabólicos y endocrinológicos, caracterizados por obesidad y retraso de crecimiento. Además, el MSG alteró la secreción rítmica de HC en ratas infantes.80 Posteriormente, se demostró que el tratamiento de ratas neonatas con MSG (4 mg/g de peso corporal vía s.c. en los días 2, 4, 6, 8 y 10 de vida) destruyó las neuronas que secretan GHRH dentro del núcleo arqueado hipotalámico, disminuyendo así las concentraciones séricas de HC y del IGF-I, lo que produjo un retraso en el crecimiento de las ratas.81 La participación del sistema glutamatérgico en la secreción de la HC se fortaleció con la utilización de farmacología dirigida a sus receptores. Así, se identificó que los receptores NMDA, KA y AMPA están involucrados en el control de secreción HC.82 El uso de MK-801 (antagonista del receptor NMDA) en ratas hembras jóvenes redujo su tasa de crecimiento y los niveles del HC hipofisaria, además de los niveles plasmáticos de la GHRH, la HC y el FGF-I.83 En concordancia con estos datos, la administración de NMDA (15 mg/kg s.c.) aumentó los niveles de HC en el plasma de las ratas.84 Una reducción de la producción de SS, debido a la administración crónica de MK-801, dio como resultado una disminución de la liberación pulsátil de HC, con una consecuente disminución en la tasa de crecimiento.84 La administración de NMDA (15 mg/kg i.p.) estimuló la secreción de HC en machos neonatos, prepúberes y adultos, efecto que fue bloqueado por MK-801. En machos adultos, la secreción pulsátil de HC fue suprimida después de la administración de MK-801 y AP-5, ambos antagonistas de los receptores NMDA.85 El contenido de GHRH en el núcleo amigdalino medial y el ARNm de GHRH hipotalámico se redujo significativamente en ratas de 21 días de edad tratadas con MK-801.86 Sin embargo, experimentos realizados in vitro no mostraron el mismo efecto. La aplicación de NMDA y MK-801 no modificó la liberación de HC de cultivos primarios de células de la hipófisis.84 Por lo tanto, parece que las neuronas productoras de GHRH son el blanco probable del efecto liberador de HC generado por NMDA y que una reducción de la función hipotalámica de GHRH es la causa principal de la tasa de crecimiento deteriorada de las ratas tratadas con MK-801.84 Dado que el MK-801 afecta la secreción de gonadotropina por una acción sobre la pituitaria, es probable que también sus efectos en la secreción de HC se deban a su acción indirecta sobre las neurohormonas reguladoras hipotalámicas, es decir, la SS, quien inhibe la síntesis y/o secreción de la HC y la GHRH.83
Otro receptor glutamatérgico que también está implicado en la regulación de la liberación de HC hipofisaria es el AMPA. González y colaboradores mostraron que los receptores AMPA participan en la secreción de PRL y HC en ratas hembra prepúberes de 23 días de edad. En ese estudio, las ratas que se inyectaron con AMPA (2.5 o 5 mg/kg i.p.) mostraron un aumento en los niveles séricos de HC, mientras que el tratamiento con NBQX (1,2,3,4-tetrahidro-6-nitro-2,3-dioxo-benzo quinoxalina-7-sulfonamida; 0.25 o 0.50 mg/kg i.p.), un antagonista de estos receptores, los disminuyó.82 Sin embargo, cultivos de células hipofisarias de ratas que se incubaron en presencia de AMPA no mostraron cambios en la secreción de PRL, HC ni gonadotropina.82 Considerando la información previa, es poco probable la acción directa de los receptores AMPA en la glándula pituitaria, ya que no se observaron respuestas significativas in vitro. Sin embargo, se puede sugerir un sitio primario de acción hipotalámico (o supra-hipotalámico) para los efectos reportados de AMPA.87 Considerando los hallazgos previos es posible que los mecanismos para la acción estimuladora de los receptores KA también pudieran implicar efectos hipotalámicos o a nivel hipofisario, como se ha descrito para los receptores NMDA.84
La evidencia previa indica que AMPA y NMDA son secretagogos de la HC.82,84,85,88 Sin embargo, experimentos realizados en cultivos de células hipofisarias mostraron que AMPA y NMDA no afectan la secreción de HC ni de la gonadotropina,82,84,85,87 lo que indica que el efecto liberador de la HC debido a la activación de los receptores AMPA, NMDA y KA se promueve en un sitio primario de acción hipotalámico o supra-hipotalámico.84,87 Debe destacarse que existen limitados estudios referentes a este tema, pues como podrá notarse, la mayoría de los experimentos aquí citados datan de la década de los años 90´s. Lo anterior implica seguir investigando sobre los mecanismos que regulan la liberación de la HC para entender mejor sus efectos. Adicionalmente, mucho menos se conoce sobre el control de la producción y la liberación de la HC por neuronas en otras regiones cerebrales, tales como el hipocampo.
7. La hormona del crecimiento modula a los receptores a glutamato
Tanto la HC como el sistema glutamatérgico participan en procesos de plasticidad cerebral. Por lo tanto, no es de extrañar que la HC y el sistema glutamatérgico, principalmente a través de los receptores a glutamato, colaboren en procesos de memoria y aprendizaje. La memoria y el aprendizaje se procesan en diversas regiones cerebrales, entre las que destaca el hipocampo. Esta estructura, relacionada con la memoria declarativa y el aprendizaje, posee neuronas glutamatérgicas que incluyen a las células piramidales de las regiones CA1, CA2 y CA3 (cuerno de Amón) y a las neuronas granulares del giro dentado (GD).89 Se sabe que los receptores NMDA y AMPA son necesarios para la plasticidad sináptica y la formación de memoria.89,90 Por otro lado, el hipocampo posee RHC,11,12,16,17 por lo que la función del hipocampo se ve influenciada por la presencia o deficiencia de HC. Lo anterior sugiere que la HC podría modular la transmisión glutamatérgica en el hipocampo6,91-92 y promover la consolidación de la memoria.93
La deficiencia de la HC se asociada con un retraso en el crecimiento, pero también con alteraciones cognitivas,6 que a menudo se solventan después de la administración exógena de HC.89,94 Resulta interesante el hallazgo de Ramis y colaboradores, quienes reportaron que la HC mejoró el aprendizaje a través de los receptores AMPA y NMDA. En ese estudio, el tratamiento agudo con HC (1 mg/kg, i.p., durante 1 h) mejoró el aprendizaje espacial de ratas jóvenes y maduras, así como de ratones adultos en el laberinto radial (una reducción del 46, 38 y 32 % en el tiempo de prueba y del 61, 48, 34% en el número de errores, respectivamente).95 La memoria de trabajo es la capacidad de mantener activa la información y utilizarla para realizar operaciones cognitivas complejas, como el aprendizaje y el razonamiento.96 En el mismo estudio por Ramis y colaboradores95 se observó que los roedores tratados con HC y sometidos al modelo de reconocimiento de objeto nuevo, mejoraron su memoria de trabajo, pues aumentó el tiempo dedicado a explorar el nuevo objeto con respecto al objeto familiar. Estos efectos se bloquearon con el antagonista de los receptores NMDA, el MK801 (0.025 mg/kg i.p., aplicado 10 min antes de la administración de HC). Un efecto similar se observó cuando se administró el DNDQX (6,7-dinitroquinoxalina-2,3-diona) un antagonista competitivo de los receptores AMPA y KA (1mg/kg i.p. de DNDQ, inyectado 10 minutos antes de la administración de HC). Adicionalmente, estos autores identificaron que la administración de 20 mg/kg i.p. de SL 327 (un inhibidor selectivo para MEK 1/2, cinasas que forma parte de la vía de señalización de la HC) inyectado 30 min antes de la administración de la HC, evitó la mejora en la memoria producido por la HC en la prueba de laberinto radial y la de reconocimiento de objetos nuevos.95 Lo anterior sugiere que la administración aguda de HC mejora la memoria de trabajo y espacial a través de los receptores glutamatérgicos NMDA y AMPA vía la señalización de MEK / ERK95, lo que promovería una transmisión sináptica excitatoria más eficaz en el hipocampo. En concordancia con estos hallazgos, Mahmoud y colaboradores reportaron que la HC mejoró la transmisión sináptica excitatoria mediada por los receptores NMDA y AMPA en el área CA1 del hipocampo de la rata. Este efecto fue gradual, pues requirió 60-70 min para alcanzar el valor máximo, lo que sugiere un posible sitio de acción postsináptico.97 En ese mismo estudio, se observó que la HC provocó un aumento de los potenciales postsinápticos excitatorios (EPSP, por sus siglas en inglés para Excitatory Postsynaptic Potential) y requirió la activación de JAK2, de PI3K (siglas en inglés de phosphoinositide 3-kinase), de la proteína cinasa activada por mitógeno (MAP / MEK) y la síntesis de nuevas proteínas.97 Estas cinasas son de relevancia, pues están implicadas en las cascada de señalización mediado por las HC al activar a su receptor.16,49,50 Resulta importante destacar que la HC mejoró los potenciales postsinápticos excitatorios mediados por los receptores AMPA y NMDA en el hipocampo, sin alterar la transmisión sináptica inhibitoria mediada por el receptor GABAA.98
Los estudios farmacológicos demostraron que los receptores ionotrópicos glutamatérgicos participan en la acción de la HC en los proceso de memoria. Sin embargo, el mecanismo preciso por el cual la HC los recluta no es del todo entendido. La HC podría actuar directa o indirectamente (es decir a través de IGF-1) en los receptores NMDA a través de la activación de JAK2, PI3K, Akt, MAPK y MEK,97,99,100 moléculas que están involucradas en la vía de señalización de JAK-STAT, activada por la HC.16,49,50 La proporción de las subunidades que conforman a los receptores NMDA y AMPA puede alterarse por modificaciones postraduccionales como la fosforilación.98 La fosforilación puede cambiar las propiedades de las subunidades del receptor, y estos cambios pueden contribuir a la mejora de LTP. Por ejemplo, se sabe que la proteína cinasa C (PKC) y la calmodulina cinasa II Ca2 (CaMKII) fosforilan las subunidades NR1, NR2B y NR2A del receptor NMDA y GluR1 del receptor AMPA.101-103 Además, la activación de los receptores AMPA, NMDA y KA también aumentan la fosforilación de MAPK/ERK en el hipocampo,104 que podría generar un cruce de información con la señalización mediada por la HC.
Otro aspecto interesante de la influencia de la HC sobre el receptor NMDA es la alteración que produce en el patrón de expresión de sus subunidades en el hipocampo de la rata. En un estudio realizado por Le Grevés y colaboradores, ratas macho adultas longevas (57-67 semanas de edad) y adultas jóvenes (11 semanas de vida) que recibieron un tratamiento con HC (1 mg / kg s.c., por 10 días) mostraron un aumento en la expresión hipocampal de ARNm de las subunidades NR2A y NR2B, respectivamente; adicionalmente las ratas adultas jóvenes presentaron un aumento en la expresión del ARNm del RHC. Las subunidades NR2A y NR2B se encuentran en terminales presinápticas del axón que forman sinapsis axoespinosas en el área CA1 del hipocampo.105 Previamente se ha reportado que la regulación de NR2B y NR2A está involucrada en funciones cognitivas.106 El aumento de la subunidad NR2B inducido por HC es coherente con el efecto de mejora de la memoria y transmisión sináptica por parte de la HC a través de los receptores NMDA.95,105 Además, también se sabe que la sobreexpresión de la subunidad NR2B en el prosencéfalo y el hipocampo de ratones transgénicos provocó una mejor activación del receptor NMDA, lo que coincide con una mejora en el aprendizaje y la memoria en esos ratones.107,108 Finalmente, el aumento de la transcripción del gen para RHC visto en las ratas adultas jóvenes refleja la capacidad de la hormona de llegar al cerebro y estimular las células del hipocampo, estructura caracterizada por la prevalencia de células glutamatergicas.91
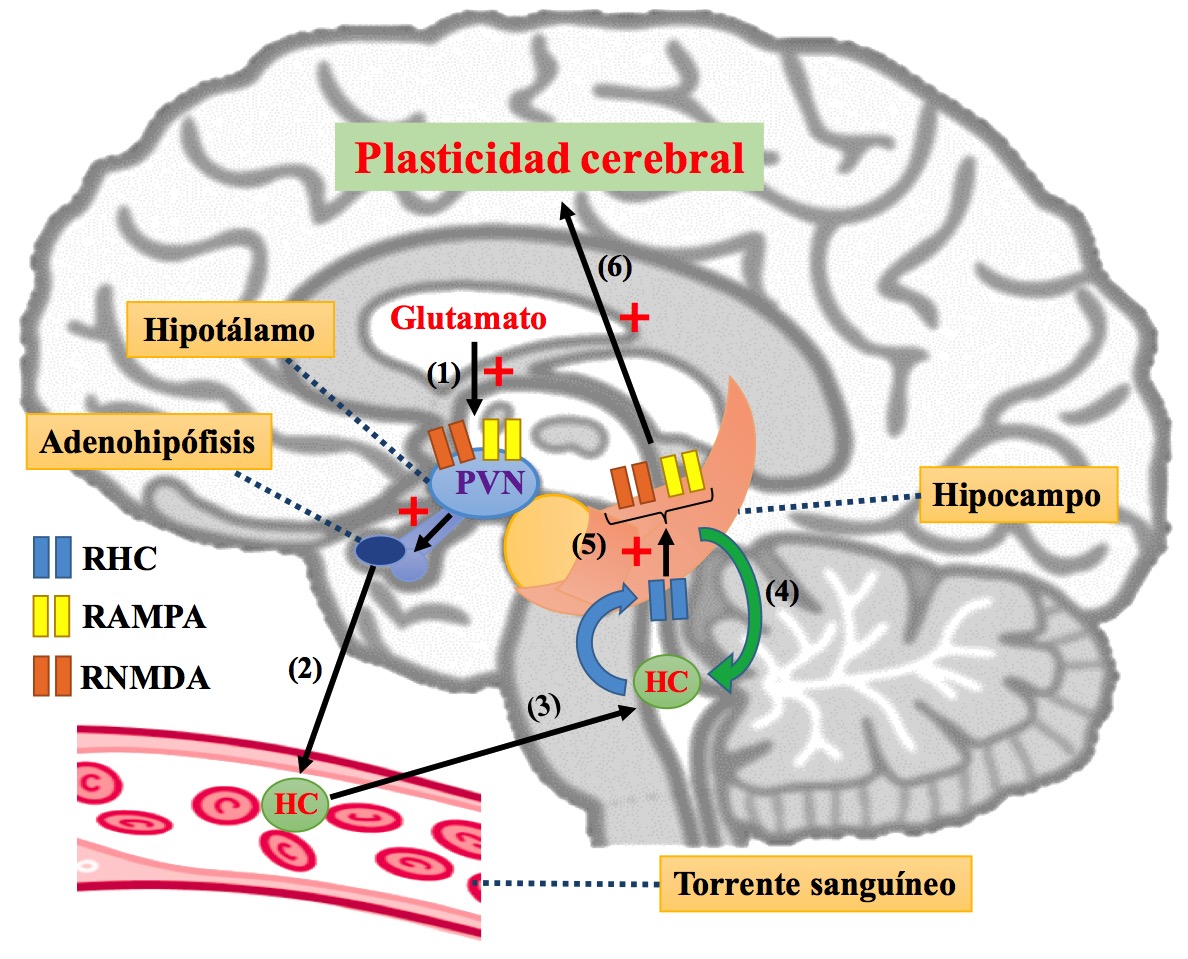
Por último, considerando toda la información descrita anteriormente, y a pesar que la mayoría de los estudios se han realizado en roedores, es posible proponer que la HC y el sistema glutamatérgico trabajen en conjunto para promover cambios plásticos cerebrales a través no solo del control de la producción y liberación de la HC, sino también a través de la modulación de los receptores ionotrópicos glutamatérgicos en estructuras como el hipocampo (Figura 3).
FFigura 3. Diagrama representativo de la relación funcional que puede existir entre la hormona de crcimiento (HC) y el sistema glutamatérgico en el cerebro. El glutamato estimula a sus receptores NMDA (RNMDA) y AMPA (RAMPA) en el nucleó paraventricular (PVN) del hipotálamo (1) y promueve que la adenohipófisis secrete la HC (2); la HC retorna al sisteman nervioso central (3) e interactúa con su receptor (RHC) en estructuras del sistema límbico como el hipocampo, región cerebral que también produce HC de forma local (4); en el hipocampo, la señalización que resulta de la interacción HC-RHC mejora la transmisión sináptica excitatoria mediada por los RNMDA y RAMPA, además de aumentar la expresión de la subunidad NR2B del RNMDA, lo que resulta en una mejora en su actividad (5); los RNMDA y RAMPA participan en procesos de plasticidad cerebral, incluyendo procesos cognitivos (6).
La aportación de esta revisión es resaltar la relevancia de la HC en diferentes procesos de neuroplasticidad, incluyendo procesos cognitivos y de neuroprotección que implican al sistema glutamatérgico, principalmente a sus receptores ionotrópicos. No obstante este conocimiento, aún no se comprenden por completo los mecanismos moleculares y celulares implicados en tales efectos, por lo que resulta indispensable continuar investigando la compleja relación entre ambos sistemas cerebrales para identificar áreas de oportunidad para el uso de la HC como modulador de la plasticidad cerebral.
Al CONACYT por la beca para estudios de posgrado otorgada a IZB con número de registro 309011.
Los autores declaran que no existe ningún conflicto de interés relacionado con el artículo.
1. Fernández JA, Ariznavarreta C, Cachofeiro V, Cardinali DP, Escrich E, Gil-Loyzaga PE, Lahera V, Mora F, Romano M, Tamargo J. Fisiología humana. Arce VM, Devesa J, Tresguerres JAF, Hormona de Crecimiento. Interamericana Editores 2010 72 1185-1200.
2. Nyberg F, Hallberg M. Growth hormone and cognitive function. Nat Rev Endocrinol 2013 9: 357-365.
3. Pankevich DE, Davis M, Altevogt BM. Glutamate-related biomarkers in drug development for disorders of the nervous system. The National Academies Press, Washington. 2011 pp20-30.
4. Shamseer L, Moher D, Clarke M, Ghersi D, Liberati A, Petticrew M, Shekelle P, Stewart L. Preferred reporting items for systematic review and meta-analysis protocols (PRISMA-P). BMJ 2015 2:349.
5. Castro JR, Costoya JA, Gallego R, Prieto A, Arce VM, Señarı́s R. Expression of growth hormone receptor in the human brain. Neurosci Lett 2000 281: 147-150.
6. Nyberg F. Growth hormone in the brain: characteristics of specific brain targets for the hormone and their functional significance. Front neuroendocrine 2000 21: 330-348.
7. Regalado-Santiago C, López-Meraz ML, Juárez-Aguilar E. La Hormona de Crecimiento en el Sistema Nervioso Central. Rev Med UV 2012 201: 30-35.
8. Veldhuis JD, Johnson ML, Faunt LM, Mercado M, Baumann G. Influence of the high-affinity growth hormone (GH)-binding protein on plasma profiles of free and bound GH and on the apparent half-life of GH. Modeling analysis and clinical applications. J Clin Invest 1993 91: 629.
9. Schilbach K, Bidlingmaier M. Growth hormone binding protein: physiological and analytical aspects. Best Pract Res Clin Endocrinol Metab 2015 29: 671-83.
10. Burton KA, Kabigting EB, Clifton DK, Steiner RA. Growth hormone receptor Messenger ribonucleic acid distribution in the adult male rat brain and its colocalization in hypothalamic somatostatin neurons. Endocrinology 1992 131:958–63.
11. Lobie PE, Garcia-Aragon J, Lincoln DT, Barnard R, Wilcox JN, Waters MJ. Localization and ontogeny of growth hormone receptor gene expression in the central nervous system. Brain Res Dev Brain Res 1993 74:225–233.
12. Mustafa A, Adem A, Roos P, Nyberg F. Sex differences in binding of human growth hormone to rat brain. J Neurosci Res 1994 19: 93-99.
13. Harvey S, Hull K. Neural growth hormone. J. Mol. Neurosci 2003 20: 1-13.
14. Harvey S. Extrapituitary growth hormone. Endocrine 2010 38: 335-359.
15. Vijayakumar A, Novosyadlyy R, Wu Y, Yakar S, LeRoith D. Biological effects of growth hormone on carbohydrate and lipid metabolism. Growth Horm IGF Res 2010 20: 1-7.
16. Arce VM, Devesa P, Devesa J. Role of growth hormone (GH) in the treatment on neural diseases: from neuroprotection to neural repair. J Neurosci Res 2013 76: 179-186.
17. 17. Arámburo C, Alba-Betancourt C, Luna M, Harvey S. Expression and function of growth hormone in the nervous system: a brief review. Gen Comp Endocr 2014 203: 35-42.
18. Saavedra Torres JS, Díaz Córdoba WJ, Zúñiga Cerón LF, Navia Amézquita CA, Zamora Bastidas TO. Correlación funcional del sistema límbico con la emoción, el aprendizaje y la memoria. Morfolia 2015 7: 2.
19. Laron Z. Insulin-like growth factor 1 (IGF-1): a growth hormone. Molecular Pathology 2001 54: 311.
20. Brandan N, Llanos I, Miño C, Ragazzoli M, Ruiz D. Hormonas hipotalámicas e hipofisiarias. Universidad Nacional del Noreste. 2007.
21. Brooks AJ, Wooh JW, Tunny KA, Waters MJ. Growth hormone receptor; mechanism of action. Int J Biochem Cell B 2008 40: 1984-1989.
22. Waters MJ, Brooks AJ. JAK2 activation by growth hormone and other cytokines. Biochem J 2015 466: 1–11.
23. Brooks AJ, Dai W, Mara MLO, Abankwa D, Chhabra Y, Pelekanos RA, Waters MJ. Mechanism of Activation of Protein Kinase JAK2 by the Growth Hormone Receptor. Science 2014 344: 703–704.
24. Waters MJ, Hoang HN, Fairlie DP, Pelekanos RA, Brown RJ. New insights into growth hormone action. J Mol Endocrinol 2006 36: 1-7.
25. Ballerini MG, Ropelato MG. (2008). El receptor de la hormona de crecimiento humana (hGH) y la proteína de transporte de alta afinidad de la hGH. RAEM 2008 45: 28-46.
26. Pinzón CE, Serrano ML, Sanabria MC. Papel de la vía fosfatidilinositol 3 kinasa (PI3K/Akt) en humanos. Rev Cienc Salud 2009 7: 47-66.
27. Yu D, Fan C, Zhang W, Wen Z, Hu L, Yang L, Mo X. Neuroprotective effect of nicorandil through inhibition of apoptosis by the PI3K/Akt1 pathway in a mouse model of deep hypothermic low flow. J Neurol Sci 2015 357: 119-125.
28. Herrington J, Smit LS, Schwartz J, Carter-Su C. The role of STAT proteins in growth hormone signaling. Oncogene 2000 19: 2585.
29. Ling L, Zhu T, Lobie PE. (2003). Src-CrkII-C3G-dependent activation of Rap1 switches growth hormone-stimulated p44/42 MAP kinase and JNK/SAPK activities. Journal of Biological Chemistry, 278: 27301-27311.
30. Flores-Morales A, Greenhalgh CJ, Norstedt G, Rico-Bautista E. Negative regulation of growth hormone receptor signaling. J Mol Endocrinol 2006 20: 241-253.
31. Bazán NE. Capítulo 62: Hormona de crecimiento. Encocrinologia. 2005 pp 150-164.
32. Sánchez de Gómez M, De N, Biol S, Del G, Hormona EJE. Significado Biológico Del Eje Hormona De Crecimiento (Gh) / Factor De Crecimiento Similar a La Insulina (Igf). Rev. Acad Colomb Cienc 2006 30: 101–108.
33. Arámburo C, Luna M, Carranza M, Reyes M, Martínez‐Coria H, Scanes CG. Growth hormone size variants: changes in the pituitary during development of the chicken. Proc Soc Exp Biol Med 2000 223: 67.
34. Scheepens A, Sirimanne ES, Breier BH, Clark RG, Gluckman PD, Williams CE. Growth hormone as a neuronal rescue factor during recovery from CNS injury. Neuroscience 2001 104: 677-687.
35. Regalado-Santiago C, López-Meraz ML, Santiago-García J, Fernández–Pomares C, Juárez-Aguilar E. Growth hormone (GH) is a survival rather than a proliferative factor for embryonic striatal neural precursor cells. . Growth Horm IGF Res 2013 23: 179-186.
36. Puderbaugh M, Emmady PD. Neuroplasticity. StatPearls Publishing LLC 2020 pp 329-340
37. Mateos-Aparicio P and Rodríguez-Moreno A. The Impact of Studying Brain Plasticity. Front Cell Neurosci 2019 13: 66.
38. Nieves-Martinez E, Sonntag WE, Wilson A, Donahue A, Molina DP, Brunso-Bechtold J. Early-onset GH deficiency results in spatial memory impairment in mid-life and is prevented by GH supplementation. J Endocrinol 2010 204:31–36.
39. Maureira F, Henríquez F, Carvajal D, Vega J, Acuña C. Efectos del ejercicio físico agudo sobre la memoria visual de corto plazo en estudiantes universitarios. REVISTACAF UCM 2015 16: 31-37.
40. Olivares-Hernández JD, García-García F, Camacho-Abrego I, Flores G, Juárez-Aguilar E. Intracerebroventricular administration of growth hormone induces morphological changes in pyramidal neurons of the hippocampus and prefrontal cortex in adult rats. Synapse 2018 72: 1–8.
41. Gipson CD, Foster Olive M. Structural and functional plasticity of dendritic spines – root or result of behavior?. Genes Brain Behav 2017 16: 101–117.
42. Walser M, Schiöler L, Oscarsson J. Different modes of GH administration influence gene expression in the male rat brain. J Endocrinol 2014 222: 181-190.
43. Vander Weele CM, Saenz C, Yao J, Correia SS, Goosens KA. Restoring hippocampal growth hormone reverses stress-induced deterioration of the hippocampus. Behav Neurosci front 2013 7: 66
44. Jeneson A, Squire LR. Working memory, long-term memory and function of the medial temporal lobe. To learn Mem 2012 19: 15–25.
45. Quiroga RQ. Concept cells: the building blocks of declarative memory functions. Nat Rev Neurosci 2012 13: 587-97.
46. Buzsáki G, Moser EI. Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat Neurosci 2013 16:130–38.
47. Sun LY, Al-Regaiey K, Masternak MM, Wang J, Bartke A. Local expression of GH and IGF-1 in the hippocampus of long-lived mice with GH deficiency. Neurobiol aging 2005 26: 929-937.
48. Donahue CP, Kosik KS, Shors TJ. Growth hormone is produced within the hippocampus where it responds to age, sex, and stress. Proc Natl Acad Sci USA 2006 103: 6031-6036.
49. Ueda Y, Kitamoto A, Willmore LJ, Kojima T. Hippocampal gene expression profiling in a rat model of posttraumatic epilepsy reveals temporal upregulation of lipid metabolism-related genes. Neurochem Res 2013 38:1399-1406.
50. Arellanes-Licea, EC, Ávila-Mendoza J, Ramírez-Martínez EC, Ramos E, Uribe-González N, Arámburo C, Morales T, Luna M. Upregulation of GH, but not IGF1, in the hippocampus of the lactating dam after kainic acid injury. Endocr connect 2018 7: 258–267.
51. Furigo IC, Melo HM, Lyra ESNM, Ramos-Lobo AM, Teixeira PDS, Buonfiglio DC. Brain signaling STAT5 modulates learning and memory formation. Brain struct funct 2018 223: 2229-2236.
52. Rotwein P. Growth Hormone Mapping - Stat5b - IGF-I Transcriptional Circuit. Endocrinol Metab Trends 2012 23: 186-193.
53. Lai TW, Zhang S, Wang YT. Excitotoxicity and stroke: identifying novel targets for neuroprotection. Prog Neurobiol. 2014 115:157-88
54. Olloquequi J, Cornejo-Córdova E, Verdaguer E, Soriano F, Binvignat O, Auladell C, Camins A. Excitotoxicity in the pathogenesis of neurological and psychiatric disorders: Therapeutic implications. J Psychopharmacol 2018 32:265-275.
55. Tehse J, Taghibiglou C. The overlooked aspect of excitotoxicity: Glutamate-independent excitotoxicity in traumatic brain injuries. Eur J Neurosci 2019 49:1157-1170.
56. Ling FA, Hui DZ, Ji SM. Protective effect of recombinant human somatotropin on amyloid beta-peptide induced learning and memory deficits in mice. Growth Horm IGF Res 2007 17: 336–341.
57. Doulah AH, Rohani AH, Khaksari-Haddad M, Motamedi F, Farbood Y, Badavi M, Malek M, Sarkaki A. The effect of peripheral administration of growth hormone on AD-like cognitive deficiency in NBM-lesioned rats. Neurosci Lett 2009 466: 47–51.
58. Shin DH, Lee E, Kim JW, Kwon BS, Jung MK, Jee YH, Chang YP. Protective effect of growth hormone on neuronal apoptosis after hypoxia–ischemia in the neonatal rat brain. Neurosci Lett 2004 354: 64-68.
59. Han TR, Chun MH, Jang DH, Kim KS, Lim KH, Cho HJ. Neuroprotective effects of growth hormone against hypoxic-ischemic brain injury in neonatal rats: 1H magnetic resonance spectroscopic study. J Korean Med Sci 2007 22: 122-126.
60. García-García F, Alberto K, Juárez-Aguilar E, Regalado-Santiago C, Millán-Aldaco D, Blanco-Centurión C, Drucker-Colín R. Growth hormone improves hippocampal adult cell survival and counteracts the inhibitory effect of prolonged sleep deprivation on cell proliferation. Brain Res Bull 2011 84: 252-257.
61. Lanes R. Alteraciones metabólicas inducidas por la deficiencia de la hormona de crecimiento: Beneficios de la terapia sustitutiva con hormona de crecimiento. Rev Venez Endocrinol Metab 2003 1: 2-8.
62. Saatman KE, Contreras PC, Smith DH, Raghupathi R, McDermott KL, Fernández SC, et al. The factor of growth similar to insulin-1 (IGF-1) improves both the neurological motor and the cognitive result after of an experimental brain injury. Exp Neurol 1997 147: 418-427.
63. Dudek FE. Epileptogenesis: a new twist on the balance of excitation and inhibition. Epilepsy currents 2009 9: 174-176.
64. Flores-Soto ME, Chaparro-Huerta V, Escoto-Delgadillo M, Vazquez-Valls E, González-Castañeda RE, Beas-Zarate C. Structure and function of NMDA-type glutamate receptor subunitsStructure and function of NMDA-type glutamate receptor subunits. Neurología 2012 27: 301-310.
65. Gil-Nagel A, García I. Etiopatogenia y fisiopatología de la epilepsia. Medicine 2007 9: 4806-4813.
66. Niswender CM, and Conn PJ. Metabotropic Glutamate Receptors: Physiology, Pharmacology, and Disease. Annu Rev Pharmacol Toxicol 2010 50: 295–322.
67. Meldrum BS. Glutamate as a neurotransmitter in the brain: review of physiology and pathology. J Nutr Sci 2000 130: 1007-1015.
68. Lesage A, Steckler T. Estimulación y bloqueo del receptor metabotrópico de glutamato mGlu1: Oportunidades terapéuticas en enfermedades psiquiátricas. Eur J Pharmacol 2010 639: 1–3: 2–16.
69. Reiner A, Levitz J. Glutamatergic Signaling in the Central Nervous System: Ionotropic and Metabotropic Receptors in Concert. Neuron 2018 27:1080-1098.
70. Bauer D, Robinson M. Glutamatergic neurotransmission En: Primer on the Autonomic Nervous System. 2012 pp 103-107.
71. Niciu MJ, Kelmendi B, and Sanacora G. Overview of Glutamatergic Neurotransmission in the Nervous System. Pharmacol Biochem Behav 2012 4: 656–664.
72. Papadimitriou A, Priftis KN. Regulation of the Hypothalamic-Pituitary-Adrenal Axis. Neuroimmunomodulation 2009 16: 265–271.
73. Pinilla L, Lopez F, Aguilar E. The effect of orchiectomy on rat pituitary responsiveness to GHRH depends on age. Acta Endocrinol 1990 122: 349.
74. Mayo KE, Miller T, DeAlmeida V, Godfrey P, Zheng J, Cunha SR. Regulation of the pituitary somatotrophic cell by GHRH and its receptor. Prog Horm Res 2000 55: 237-66.
75. Shah BP, Vong L, Olson DP, Koda S, Krashes MJ, Ye C, Yang Z, Fuller PM, Elmquist JK, Lowell BB. Glutamatergic neurons that express MC4R in the paraventricular hypothalamus regulate nutrition and are synaptically connected to the parabrachial nucleus. PNAS 2014 111: 13193-13198.
76. Van den Pal’ AN, TrombleyPQ. Glutamate Neurons in Hypothalamus Regulate Excitatory Transmission. J Neurosci Res 1993 13: 2829-2838.
77. Herman JP, Eyigor O, Ziegler DR, Jennes L. Expression of ionotropic glutamate receptor subunit mRNA in rat hypothalamic paraventricular nucleus. J Comp Neurol 2000 422: 352–362.
78. Urbanski HF, y Ojeda SR. Activation of Luteinizing hormone-releasing hormone release advances the onset of female puberty. Neuroendocrinology 1987 46:273-276.
79. Gay VL, Plant TM. N-methyl-D, L-aspartate elicits hypothalamic gonadotropin-releasing hormone release in prepuberal male rhesus monkeys (Macaca mulatto). Endocrinology 1987 120: 2289-2296.
80. NemerolT CB, Bissette G, Greeley GH, Mailman RB, Martin JB, Brazeau P, Kizer JS. Effects of acute administration of monosodium- 6-glutamate (MSG), atropine or haloperidol on anterior pituitary hormone secretion in the rat. Brain Res 1978 156:198-201.
81. Kovacs M, Kineman RD, Schally AV, Flerko B, Frohman LA. Increase in mRNA Concentrations of Pituitary Receptors for Growth Hormone-Releasing Hormone and Growth Hormone Secretagogues After Neonatal Monosodium Glutamate Treatment. J Neuroendocrinol 2000 12: 335–341.
82. González LC, Pinilla L, Tena-Sempere M, Aguilar E. Role of α-amino-3-hydroxy-5-methylisoxazol-4-propionic acid receptors in the control of prolactin, growth hormone and gonadotropin secretion in prepubertal rats. J Endocrinol 1999 162: 417-424.
83. Veneroni O, Cocilovo L, Müller EE, Cocchi D: Delay of puberty and impairment of growth in female rats given a noncompetitive antagonist of NMDA receptors. Life Sci 1990 47:1253– 1260.
84. Acs Z, Lonart G, Makara GB. Role of hypothalamic factors (growth hormone-releasing hormone and gamma-aminobutyric acid) in the regulation of growth hormone secretion in the neonatal and adult rat. Neuroendocrinology 1990 52:156–160.
85. Pinilla L, Tena-Sempere M, Gonzalez D, Aguilar E. Positive role of non-N-methyl-D-aspartate receptors in the control of growth hormone secretion in male rats. J Endocrinol Invest 1996 19:353–358.
86. Cocilovo L, Colonna V, Zoli M, Biagini G, Settembrini BP, Muller EE, Cocci D. Central mechanisms subserving the impaired growth hormone secretion induced by persistent blockade of NMDA receptors in immature male rats. Neuroendocrinology 1992 55:416–421.
87. Shinkai T, Sakurai Y, Ooka H. Age-related changes in the numbers of mammotrophs, somatotrophs and mammosomatotrophs in the anterior pituitary gland of female rats: a flow cytometry study. Mech Ageing Dev 1995 83: 125–131.
88. Ertherat J, Bluet-Pajot MT, Epelbaum J. Neuroendocrine regulation of growth hormone. Eur J Endocrinol 1995 132:12–24.
89. Lynch G. Glutamate-based therapeutic approaches: ampakines. Curr Opin Pharmacol 2006 6:82–88.
90. Cao X, Cui Z, Feng R, Tang YP, Qin Z, Mei B. Maintenance of superior learning and memory function in NR2B transgenic mice during ageing. Eur J Neurosci 2007 25:1815–1822.
91. Le Grevès M, Steensland P, Le Grevès P, Nyberg F. Growth hormone induces an alteration dependent on the age in the expression of the growth hormone receptor of the Hippocampus and N-methyl-aspartate receptor subunit gene transunations in male rats. Proc Natl Acad Sci 2002 99: 7119–7123.
92. Ramsey MM, Weiner JL, Moore TP, Carter CS, Sonntag WE. Growth hormone treatment attenuates age-related changes in hippocampal short-term plasticity and spatial learning. Neuroscience 2004 129:119–127.
93. Staubli U, Rogers G, Lynch G. Facilitation of glutamate receptors enhances memory. Proc Natl Acad Sci USA 1994 91:777–781.
94. Arwert LI, Veltman DJ, Deijen JB, van Dam PS, Drent ML. Effects of growth hormone substitution therapy on cognitive functioning in growth hormone deficient patients: a functional MRI study. Neuroendocrinology 2006 83:12–19.
95. Ramis M, Sarubbo F, Sola J, Aparicio S, Garau C, Miralles A, Esteban S. Cognitive improvement by acute growth hormone is mediated by NMDA and AMPA receptors and MEK pathway. Prog Neuro-Psychoph 2013 45:11–20.
96. Pelegrina S, Lechuga MT, Castellanos MC, Elosúa MR. Memoria de trabajo En: Mente y cerebro: de la Psicología experimental a la Neurociencia cognitiva. España. 2016 pp. 237-262.
97. Mahmoud GS, Grover LM. Growth hormone enhances excitatory synaptic transmission in area CA1 of rat hippocampus. J Neurophysiol 2006 95: 2962–2974.
98. Molina DP, Ariwodola OJ, Linville C, Sonntag WE, Weiner JL, Brunso-Bechtold JK. Growth hormone modulates hippocampal excitatory synaptic transmission and plasticity in old rats. Neurobiol Aging 2012 33:1938–1949.
99. Alba-Betancourt C, Luna-Acosta JL, Ramírez-Martínez CE, Ávila-González D, Granados-Ávalos E, Carranza M, Luna M. Neuro-protective effects of growth hormone (GH) after hypoxia–ischemia injury in embryonic chicken cerebellum. Gen Comp Endocrinol 2013 183: 17-31.
100. Hallberg M, Nyberg F. Growth Hormone Receptors in the Brain and their Potential as Therapeutic Targets in Central Nervous System Disorders. TOEJ 2012 6: 27-33.
101. Cammarota M, Bernabeu R, Levi De Stein M, Izquierdo I, Medina JH. Learning-specific, time-dependent increases in hippocampal Ca2/calmodulin-dependent protein kinase II activity and AMPA GluR1 subunit immunoreactivity. Eur J Neurosci 1998 10: 2669–2676.
102. Liao GY, Wagner DA, Hsu MH, Leonard JP. Evidence for direct protein kinase-C mediated modulation of N-methyl-D-aspartate receptor current. Mol Pharmacol 2001 59: 960–964.
103. Kim HW, Roh DH, Yoon SY, Seo HS, Kwon YB, Han HJ, Kim KW, Beitz AJ, Lee JH. Activation of the spinal sigma-1 receptor enhances NMDA-induced pain via PKC- and PKAdependent phosphorylation of the NR1 subunit in mice. Br J Pharmacol 2008 154: 1125–1134.
104. Wang JQ, Fibuch EE, Mao LM. Regulation of mitogen-activated protein kinases by glutamate receptors. J Neurochem 2007 100: 1–11.
105. Madara JC, Levine ES. Los receptores NMDA presinápticos y postsinápticos median distintos efectos del factor neurotrófico derivado del cerebro sobre la transmisión sináptica. J Neurophysiol 2008 100: 3175-3184.
106. Quinlan EM, Olstein DH, Bear MF. Bidirectional, Experience-Dependent Regulation of N-methyl-D-aspartate Receptor Subunit Composition in the Rat Visual Cortex During Postnatal Development. Proc Natl Acad Sci USA 1999 96:12876-80.
107. Tang YP, Shimizu E, Dube GR, Rampon C, Kerchner GA, Zhuo M, Liu G, Tsien JZ. Genetic Enhancement of Learning and Memory in Mice. Nature 1999 401:63-69.
108. Fontán-Lozano A, Suárez-Pereira I, David González-Forero, Ángel Manuel Carrión. Stream A modulates learning through NMDA receptors containing the NR2B subunit. Plos one 2011 6: 24915.
| Recibido: 05 de agosto, 2020 | Aceptado: 11 de noviembre, 2020 |
Correspondencia en: Dra. María-Leonor López-Meraz. FDirección: Centro de Investigaciones Cerebrales, Universidad Veracruzana. Médicos y Odontólogos s/n, Col. Unidad del Bosque, C.P. 91010, Xalapa, Veracruz, México. Teléfono: +52 (228) 8418900 Ext. 16305, E-mail: leonorlopez@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creamasal@unam.mxtivecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.