Alteraciones en células neuronales y cardiacas en la infección por el virus Zika
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Ocaña Sánchez Marcos Fernando1,2*, Aguilar Guardado Kathia Liliana 1,3, Guzmán Martínez Oscar1,4, Castro Gerónimo Van Dan1,4, Hernández Baltazar Daniel5
1Programa de Doctorado en Ciencias Biomédicas, Centro de Investigaciones Biomédicas, Universidad Veracruzana (UV). Xalapa, Veracruz, México. 2Facultad de Química Farmacéutica Biológica, UV. Xalapa, Veracruz, México. 3Instituto de Salud Pública, UV. Xalapa, Veracruz, México. 4Unidad de Servicio de Apoyo a la Resolución Analítica (SARA), UV. Xalapa, Veracruz, México. 5CONACYT-Instituto de Neuroetología, UV. Xalapa, Veracruz, México.
Resumen/Abstract
Introducción
Conclusiones
Referencias
Correspondencia
La principal complicación de la infección por virus Zika es la microcefalia desarrollada en bebés nacidos de madres infectadas. Desde hace unos años esto ha ido en aumento, por lo que resulta de gran relevancia estudiar los mecanismos moleculares involucrados. En este trabajo se realizó una revisión sistemática de artículos compilados en PUBMED para identificar los avances que se tienen en la actualidad respecto a esta patología, usando palabras clave como Zika virus, células neuronales, células cardiacas, estudios clínicos. Se encontró que las principales células atacadas en el sistema nervioso central son las células progenitoras neurales, la astroglía y la microglía, aunque de igual manera se tienen gran interés en el músculo cardiaco y el paso del virus hacia el sistema circulante, debido al gran tropismo presentado por este virus y su persistencia a lo largo de varios años, lo que complica el manejo correcto de la enfermedad. A pesar de tener un gran avance en el tema, aún falta elucidar totalmente los mecanismos que conllevan al desarrollo de la microcefalia, el impacto que tiene el virus en el tejido cardiaco, así como en otros tejidos, para poder comenzar a desarrollar tratamientos adecuados.
Palabras clave: Virus Zika, microcefalia, cardiomiocitos, progenitores neurales, astrocitos, microglia..
The main complication of Zika virus infection is microcephaly developed in the newborn of infected mothers. For a few years, this has been increasing, which has been of interest to several researchers who are concerned with developing the molecular mechanisms by which this is carried out. In this review, a meta-analysis was carried out in the PUBMED database to identify the advances that are currently being made regarding this pathology, using keywords such as Zika virus, neuronal, cardiac cells, and clinical trials. It was found that the main infected cells in the central nervous system are the neural progenitors, astroglia and microglia, although in the same way there is great interest in the cardiac muscle and the passage of the virus in the circulatory system, due to the great tropism presented by this virus, and its persistence over several years, which complicates the correct management of the disease. We still need to fully elucidate the mechanisms that lead to the development as such of microcephaly, the impact that the virus has on cardiac tissue, as well as on other tissues, in order to begin to develop appropriate treatments.
Keywords: Zika Virus, microcephaly, cardiomyocytes, neural progenitors, astrocytes, microglia..
El virus Zika (VZ) posee un genoma de ARN monocatenario (+) estrechamente relacionado con el virus Spondeweni, ambos pertenecientes al género Flavivirus de la familia Flaviviridae1 que comprende alrededor de 70 virus, transmitidos principalmente por artrópodos, como el virus del dengue, virus del Nilo Occidental, virus de la fiebre amarilla, virus de la encefalitis japonesa y un número creciente de otros virus menos conocidos con potencial patogénico en el humano.2 El virus Zika es un patógeno intracelular obligado el cual se replica en el citoplasma celular, su genoma contempla 10.794 Kb, codificando una poliproteína de 3419 aminoácidos escindida en tres proteínas estructurales (cápside, precursor de membrana y envoltura celular) y siete no estructurales3 (NS1, NS2A, NS2B, NS3, NS4A, NS4B y NS5) las cuales tienen como función participar en la replicación y control de los procesos funcionales en la célula hospedadora en favor del virus Zika.4 Este microorganismo se aisló por primera vez en 1947 en el mono Rhesus y fue descrito en una infección humana en Nigeria en 1954.5 El primer brote de fiebre por este virus fue en el 2007 en la isla de Yap y la primer epidemia conocida fue entre el 2013 y 2014 en la Polinesia Francesa.6-7 En Latinoamérica, el primer lugar donde se conoció reporte del virus fue en Rio de Janeiro, Brasil, en el 2015.8 En la última actualización de la Secretaría de Salud en México (05 de noviembre del 2018) se reportaron 12376 casos (hombres y mujeres) desde su primera aparición en el 2016 hasta el 28 de octubre del 2018, ocupando Veracruz el primer lugar con 2102 casos confirmados a la fecha, el segundo lugar lo tiene Yucatán con 1320 casos y el tercero Nuevo León, con 950 reportes. De todos estos casos, 7076 representan a reportes dados en mujeres embarazadas, ubicando a Veracruz en segundo lugar con 888 pacientes.9
El virus Zika se puede transmitir por diferentes mecanismos: por vector biológico, vía sexual y transmisión madre-hijo (vertical). El principal vector es el mosquito Aedes aegypti, en el cual se ha aislado el virus. En un estudio se alimentó artificialmente a los mosquitos con sangre infectada con el virus y se comprobó que fueron capaces de infectar a monos y ratones; en el mono se demostró que la infección fue exitosa a las 72 horas después de la picadura de los mosquitos.10 Uno de los mecanismo de transmisión, que se ha vuelto un foco de atención, es a través del contacto sexual, considerando al virus Zika como el primer Flavivirus transmitido por esta vía.11-12Otra forma de inherente infección es la transmisión vertical, la cual se presenta de madre a feto, presumiblemente transplacental.13 Resultados de pruebas realizadas en ratones hembra embarazadas inoculadas con el virus Zika sugieren que el virus es capaz de atravesar la barrera fetal placentaria y llegar a células progenitoras neurales corticales en fetos de ratón.14
La infección por virus Zika es una enfermedad parecida al dengue, caracterizada por fiebre, erupción cutánea, malestar general y cefalea, que suele concluir en 7 días, siendo en su mayoría asintomáticos;15 sin embargo, algunos estudios han reportado la infección además con síntomas nuevos, como el síndrome Guillian-Barre,16-17 con parálisis facial subaguda, deformidades congénitas y síndromes neurológicos.18
Una preocupación importante asociada con la infección que provoca este virus, es el aparente aumento de la incidencia de microcefalia en los recién nacidos de madres infectadas con virus Zika durante el embarazo .19 En los últimos años se han realizado numerosos informes que asocian al virus Zika con microcefalia, en 2015 durante el brote en América del sur, América central y Caribe representó gran alerta debido al aumento en la incidencia de recién nacidos con microcefalia.20 En este mismo período se reportó el caso de una mujer que durante el primer trimestre del embarazo fue infectada con virus Zika, apareciendo evidencia de microcefalia con calcificaciones en el cerebro fetal y placenta, a la semana 29, observada mediante una ecografía; en la semana 32 decidieron realizar la interrupción del proceso de gestación. Estudios post-mortem en el feto evidenciaron calcificaciones filamentosas y granulares en la corteza y sustancia blanca subcortical mediante microscopía confocal. Posteriormente, se logró identificar en el tejido cerebral fetal partículas virales en el soma de neuronas por medio de inmunofluorescencia indirecta; confirmando la presencia del virus Zika en tejido cerebral (6.5 x 107 copias de ARN/mg de tejido) mediante RT-PCR.19
En diversos artículos se ha reportado la presencia del virus Zika en diferentes órganos y tejidos (Fig. 1) de varias especies, y en algunos casos se ha logrado identificar el estirpe celular afectado; en el ser humano se ha identificado en placenta (trofoblastos), cerebro (células neurales progenitoras, neuronas maduras), aparato reproductor femenino (fibroblastos), aparato reproductor masculino (células precursoras de espermatozoides), tejido ocular (estirpe celular sin identificar). En la especie Mus musculus (ratón) se ha identificado en placenta (trofoblastos), cerebro (células neurales progenitoras, neuronas maduras), aparato reproductor femenino (células epiteliales), aparato reproductor masculino (células de Sertoli, células de Leydig), tejido ocular (córnea, nervio óptico, retina neurosensorial).21-22 Actualmente se sabe que las células de mayor interés o relevancia clínica ante la infección de virus Zika son las de la placenta y tejido nervioso, debido al aumento de casos de microcefalia en niños nacidos de madres infectadas, dada la capacidad del virus de atravesar la barrera placentaria y hematoencefálica.13 Debido a que el virus Zika se distribuye a los tejidos del cuerpo mediante la circulación periférica, varios investigadores han resaltado la necesidad de estudiar las afectaciones en cerebro y placenta, debido a la posible interacción que el virus pudiera llevar a cabo durante su paso por éste tejido.23 También se ha identificado el virus Zika en fluidos corporales como suero, lágrimas, saliva, semen, moco cervical y orina (Fig. 1), lo que complica el control de la enfermedad por el alto grado de diseminación que esto conlleva.22 Esta revisión pretende enlistar las afecciones del virus Zika en tejido neuronal y cardiaco, así como su correlación en enfermedades comunes.

Figura 1. . Tropismo celular del virus Zika. Incide principalmente en células del ojo, útero, vagina y testículos. Atraviesa fácilmente al tejido encefálico y la placenta. Se encuentra incluso en diferentes fluidos corporales.
2. Métodos
Se realizó una revisión sistemática en la base de datos de PUBMED para buscar estudios relacionados con el virus Zika, su afección en sistema nervioso central, en órganos periféricos, epidemiología y clínica, así como perspectivas del avance de dicha infección. Se revisó información de los últimos 10 años sobre experimentos en ciencia básica y casos clínicos para comprender la naturaleza del virus. Se utilizaron como palabras clave para la búsqueda de información: Zika virus, Zika virus infection, Zika virus and pregnancy, Zika virus nervous system, Zika virus tropism, Zika virus neural progenitor cell, zika virus cardiac muscle.
3. Desarrollo
a. Virus Zika en el sistema nervioso central
Para que el virus Zika sea capaz de causar alteraciones en células neuronales, primero debe pasar desde la circulación sistémica hacia el Sistema Nervioso Central (SNC), proceso donde interviene la barrera hematoencefálica (BHE) (Fig. 2). La BHE, entre otras funciones, limita el paso de microorganismos de la sangre al cerebro, incluidos los virus, gracias a las uniones estrechas que existen entre las células endoteliales que la conforman.24-25 Además de las células endoteliales, son importantes para este propósito los astrocitos y los pericitos, ya que proporcionan soporte e integridad a la BHE.26 La disrupción de la BHE, principalmente por una alteración de la permeabilidad de las células endoteliales, ha sido considerada como una característica propia de las infecciones virales; sin embargo, la infección por el virus Zika no cumple con ésta regla.27
Usando un modelo in vitro de células endoteliales humanas primarias de la microvasculatura cerebral (HBMECs por sus siglas en inglés) y células Vero E6 (células epiteliales de riñón de mono verde africano), se demostró que el virus Zika (cepa PRVABC59), tiene la habilidad de infectar estas células de forma persistente sin disminución de la viabilidad celular, debido a que regula la respuesta antiviral dependiente de interferón (IFN). Esto puede ser explicado por el hecho de que no se observó efecto citopático en HBMECs aún después de 9 días post infección, el cual, sí se presentó en células Vero E6 de 2 a 3 días post infección, sin evidencia de perdida de permeabilidad celular. Estos hallazgos sugieren que las células HBMECs fungen como un reservorio para que el virus Zika se replique de forma persistente, y pueda ser liberado hacia el lumen a través de la región basolateral de la célula por un mecanismo aún desconocido.28 Resultados similares fueron demostrados en modelos in vivo (modelo murino) usando las cepas virales ZIKVMR766 y ZIKVPE24329 y un modelo de células endoteliales cerebrales inducidas a partir de células madre pluripotenciales.30 De forma contrastante, la infección intracerebral de embriones de ratón con virus Zika de la cepa MEX 1-44, mostró un aumento en la densidad y diámetro de los vasos sanguíneos en los cerebros en desarrollo, así como una disrupción de la BHE.31
b. Modificaciones de células progenitoras neuronales
Una de las principales preocupaciones sobre la infección por el virus Zika es su papel como agente causal de microcefalia en niños nacidos de madres infectadas por el virus, además de otras alteraciones neurológicas y de retraso en el crecimiento.32 Las Células Progenitoras Neurales (CPN) son altamente susceptibles a la infección por virus Zika, ya que éste induce una reducción en la proliferación celular, alteraciones ultra estructurales, inducción de autofagia y apoptosis (Fig. 2).33 Estos mecanismos podrían contribuir al desarrollo de microcefalia.34-35 A través de la inoculación de cerebros de ratón de 14.5 días (de desarrollo embrionario) con la cepa viral MEX 1-44, se demostró que la infección viral está relacionada con el desarrollo de microcefalia y retraso en el crecimiento, debido a que en los ratones infectados se identificó disminución significativa en el tamaño de pulmones, riñones, corazón, hígado y cerebro. Adicionalmente, se reportó que la infección de las CPN por el virus causó arresto del ciclo celular y apoptosis.31 Usando un modelo similar, pero con la cepa asiática SZ01 del virus, se obtuvieron resultados equivalentes. Además, se determinó que el virus Zika regula positivamente la expresión de genes relacionados con la respuesta inmunológica, principalmente los relacionados a la respuesta a interferón (OasI2, Usp18, Ifit1, Mx2, Oas1b, Ifit3, ligp1, Ddx60, Ifi44 e Irf7) y la activación de apoptosis, así como algunos genes de respuesta antiviral, como interleucina-1 beta.36 Aún es motivo de investigación, qué factores son los que están relacionados con el hecho de que no todos los niños nacidos de madres infectadas por el virus Zika desarrollan microcefalia. En un modelo in vitro usando células madre neuronales humanas (CMNH) derivadas de 3 cerebros fetales de diferente origen, que fueron infectadas con la cepa de virus Zika Mex1-7 y que presentaron ritmos similares de infección y proliferación celular entre ellas, se observó disminución de la proliferación celular en dos de ellas. También se presentó una regulación positiva en los genes relacionados a la respuesta inflamatoria y una regulación negativa de los genes implicados en el ciclo celular, lo cual explica la disminución de la proliferación celular observada. Estos resultados ponen de manifiesto que existe una relación entre los virus y las células en donde debe tenerse en cuenta la procedencia de la línea celular y la cepa viral cuando se interprete la infectividad del virus Zika.37
c. Alteraciones morfológicas en astrocitos
Los astrocitos modifican las propiedades de la BHE, regulando la entrada en el cerebro de moléculas dependiendo de su tamaño y polaridad, así como de microorganismos, incluidos los virus.38 De igual manera, estas células del tejido cerebral son las primeras en responder ante las infecciones virales, y se ha demostrado que son susceptibles a la infección por los virus Zika de la cepa africana y asiática. La interacción del virus Zika con el receptor AXL en astrocitos activa la respuesta inmune innata (Fig. 2) lo que sugiere una importante contribución con el desarrollo de la patogénesis de la infección39 así como la inducción de una regulación a la baja de los microRNAs en el astrocito, y solo un pequeño subconjunto está regulado a la alza, sobre todo los relacionados con procesos, ciclo de vida y transcripción del virus.40 Algunos estudios han demostrado que el astrocito es la vía de entrada, infección y replicación principal del virus Zika, siendo algo común en los virus de la misma familia, como el dengue.41 El virus Zika también induce la formación de vacuolas de gran tamaño en cultivos de astrocitos primarios humanos, típicas de un proceso de muerte por paraptosis.42
d. Interacción de virus Zika con la microglía.
Diversos estudios han mostrado que el virus Zika puede infectar células madre neuronales en el cerebro en desarrollo, sin embargo, el encéfalo en etapa adulta también se ve afectado durante la infección transitoria.43 Durante la neurogénesis, los nichos neurogénicos están inmersos en el fluido cerebroespinal (CSF por sus siglas en inglés) para facilitar la comunicación celular a través de moléculas de señalización. Estos nichos contienen células progenitoras que se dividen para producir neuronas o glía, dependiendo de señales intrínsecas y ambientales, y se encuentran altamente vascularizados, haciéndolos vulnerables a las infecciones virales.44 En la microglía infectada por virus Zika circulante, se induce una respuesta de tipo pro-inflamatoria similar a la encontrada en tejidos infectados por dicho virus (Fig. 2). Así mismo, se ha demostrado que la interacción con las células madre neuronales (CMN), aumenta el riesgo de propagar más fácilmente el virus.45 Por otra parte, las CMN en el cerebro fetal parecen ser especialmente impactadas por la infección de virus Zika, con una gran susceptibilidad a la infección viral o a la citotoxicidad inducida por el virus.35 Sin embargo, existen pocos estudios enfocados en conocer el mecanismo exacto por el cual el virus Zika infecta a los tejidos neurales.

Figura 2. Alteraciones neurales producidas por el virus Zika. Una vez que atraviesan la barrera hematoencefálica atacan principalmente a las células madre neurales, microglia y astrocitos, repercutiendo principalmente en la neurogénesis y gliogénesis, lo que conlleva posiblemente al desarrollo de la microcefalia.
e. Zika en células del músculo cardiaco
La enfermedad derivada de la infección por el virus Zika se ha considerado la peor epidemia del siglo XXI, con amplia distribución a nivel mundial. Aunque puede tener consecuencias devastadoras como el síndrome de Guillain-Barré y malformaciones congénitas, existe poca información sobre su repercusión cardiaca.46 La Sociedad Internacional y la Federación de Cardiología de la Organización Mundial de la Salud (OMS) definen la miocarditis como una enfermedad del músculo cardiaco, diagnosticada por criterios histológicos, inmunológicos e inmunohistoquímicos,47 siendo las infecciones por virus cardiotrópicos la causa más frecuente de cardiopatías.48 Los estudios de seguimiento han mostrado que las infecciones por Arbovirus que afectan al corazón a menudo dan como resultado un daño cardiaco permanente.49 Los mecanismos propuestos para saber cómo afecta el virus Zika al corazón son diversos. El virus Zika podría atacar por invasión directa en el tejido cardiaco, esto sería posible debido a que el virus es tan pequeño (40 nm) que puede invadir el corazón (Fig. 3).50 Las investigaciones han demostrado que infecciones con virus de tipo Arbovirus (Dengue y Chikungunya) tienen implicaciones cardiacas agudas, y se ha sugerido que el virus Zika pueda generar daños directos al miocardio mediante lisis celular23 o bien, por un proceso inmunopatológico51 por daño indirecto al músculo cardiaco y la respuesta autoinmune de los cardiomiocitos (Fig. 3).46 Se han tipificado diversas complicaciones cardiacas debido a la infección, como arritmias con fibrilación, taquicardia atrial y arritmias ventriculares, así como fallo cardiaco, efusión pericárdica de moderada a severa y pericarditis52 Los niveles séricos de quimiocinas, citocinas y factor de crecimiento han sido evaluados mostrando un incremento de quimiocinas (CXCL8, CCL11, CCL2 y CXCL10), citocinas pro-inflamatorias (IL-1β, IL-6, TNF-α, IFN-γ e IL-17), citocinas regulatorias (IL-1Ra, IL-4 e IL-9) y factores de crecimiento (FGF-básico, PDGF, G-CSF and GM-CSF) en pacientes con fibrilación atrial con virus Zika53 así como niveles incrementados de enzimas cardiacas, lo cual podría indicar la presencia del virus.54 Existe también el primer reporte acerca del síndrome congénito de virus Zika y la concomitancia con la Enfermedad Cardiaca Congénita Crítica por infección viral en el primer trimestre de embarazo, presentando el síndrome de hipoplasia cardiaca.55 Un gran número de virus han sido detectados en tejido cardiaco, pero la interpretación de su papel en la miocarditis es controvertida. La infección previa por dengue y las comorbilidades aumentan la infección por virus Zika y pueden aumentar el riesgo de desarrollar miocarditis, sin embargo, son necesarios estudios más profundos para definir la incidencia de las cardiopatías en la infección por Zika46 y elucidar los mecanismos por los cuales se llevan a cabo los procesos protectores antivirales inmunitarios, pues existen pocos estudios en el campo de la cardiología en asociación con el virus Zika.
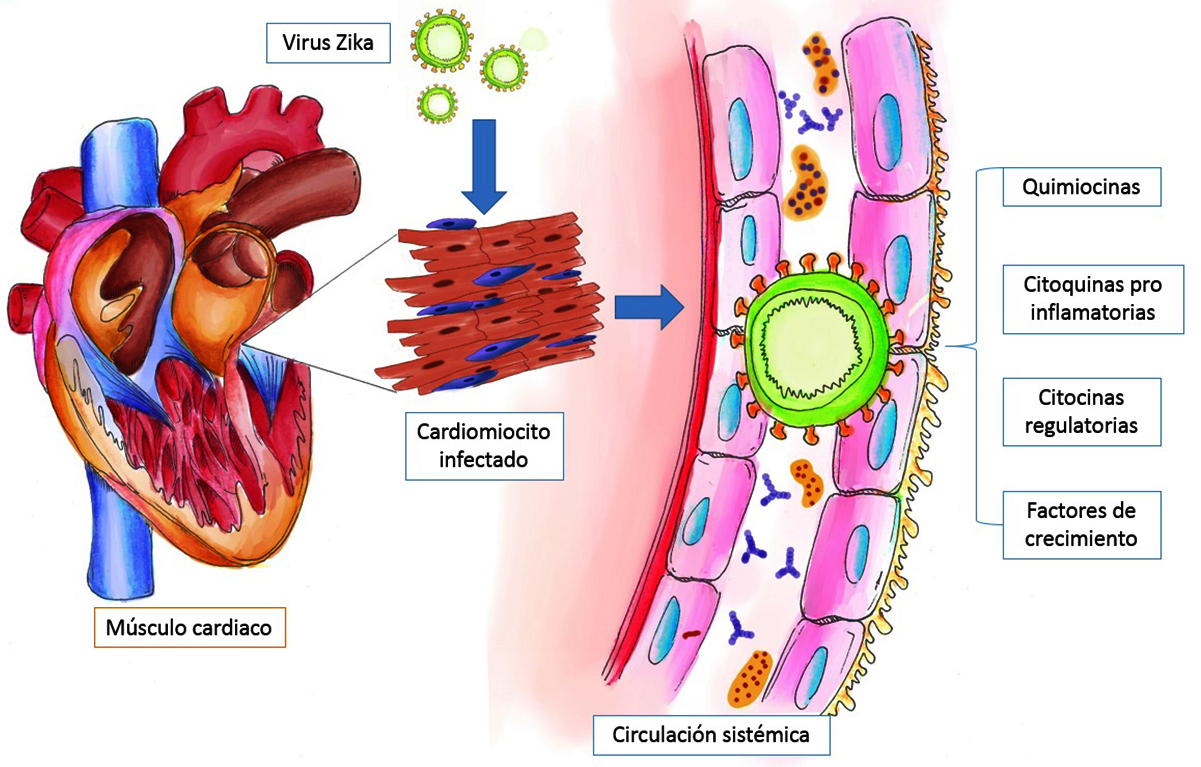
Figura 3. Proceso inmunopatológico por infección con virus Zika en el tejido cardiaco. Se observa daño indirecto al músculo cardiaco con elevación sérica de quimiocinas, citosinas regulatorias y pro-inflamatorias, así como de factores de crecimiento..
El virus Zika es un flavovirus de gran relevancia clínica. En Veracruz, la incidencia de cuadros clínicos derivados de la infección por virus Zika es alta, siendo principalmente afectadas las mujeres, teniendo un comportamiento similar a muchos otros estudios donde se demuestra este dato, aunque no se conoce aún el mecanismo o la razón por la cual ocurre esto; sin embargo, la infección por el virus zika se ha convertido en un problema de salud pública debido al impacto que tiene en las mujeres embarazadas, dónde se produce daño en el feto, como la microcefalia. Una de las principales problemáticas es la representada por los pacientes asintomáticos, ya que en numerosos estudios se ha identificado la persistencia del virus en años posteriores a la primera infección. Este virus se puede transmitir por vía sexual, así como por vía parental y atraviesa fácilmente la placenta y la BHE; y puede permanecer en fluidos como semen, orina y saliva principalmente. Este agente infeccioso puede afectar a diversas células (tejido nervioso, blando, cardiaco, etc), por lo que comúnmente se refiere su alto tropismo a ciertos órganos del cuerpo, sin aclararse aún los mecanismos bioquímicos y celulares asociados. El tejido más estudiado, en cuanto a la patología del virus, es el nervioso con manifestaciones clínicas como la microcefalia y síndrome Guillain-Barré. Las principales células nerviosas relacionadas con este virus son la microglía, la astroglía y las CPN, siendo estas últimas a quien más se le da importancia debido a su relación con el desarrollo de la microcefalia. En cuanto a la microglía, esta se ve activada y afectada por el virus Zika, lo que produce una respuesta pro-inflamatoria, desencadenando todo el proceso inmune-patológico de la infección, incluso propagándose al músculo cardiaco. La relación del virus con todas estas células y sus alteraciones, son la clave para determinar los mecanismos moleculares que conllevan a desarrollar la microcefalia en neonatos de madres infectadas, y así poder combatir una enfermedad que cada vez va en aumento. Sin embargo, aún falta mucho por conocer, acerca de toda la cascada inmunológica que soporta el desarrollo de este proceso infeccioso.
Los autores agradecen al Centro de Investigaciones Biomédicas, por permitirles formar parte del programa de Doctorado en Ciencias Biomédicas, donde desarrollaron esta revisión. Agradecimientos especiales a CONACyT por las becas de posgrado otorgadas para MFO-S (#635389), KLA-G (#931594), OG-M (#931623) y VDC-G (#927607).
Los autores declaran no tener conflictos de intereses.
Esta investigación no recibió ninguna subvención específica de las agencias de financiamiento en el sector público, comercial o sin fines de lucro.
1. Maharajan MK, Ranjan A, Chu JF, Foo WL, Chai ZX, Lau EY, Ye HM, Theam XJ, Lok YL. Zika Virus Infection: Current Concerns and Perspectives. Clin Rev Allergy Immunol. 2016;51(3):383-94.
2. Sager G, Gabaglio S, Sztul E, Belov GA. Role of Host Cell Secretory Machinery in Zika Virus Life Cycle. Viruses. 2018;10(10)
3. Sakkas H, Economou V, Papadopoulou C. Zika virus infection: Past and present of another emerging vector-borne disease. J Vector Borne Dis. 2016;53(4):305-11.
4. Abbink P, Stephenson KE, Barouch DH. Zika virus vaccines. Nat Rev Microbiol. 2018;16(10):594-600.
5. Musso D, Gubler DJ. Zika Virus. Clin Microbiol Rev. 2016;29(3):487-524.
6. Dupont-Rouzeyrol M, O'Connor O, Calvez E, Daurès M, John M, Grangeon J, Gourinat AC. Co-infection with Zika and dengue viruses in 2 patients, New Caledonia, 2014. Emerg Infect Dis. 2015;21(2):381-2.
7. Waggoner JJ, Rouphael N, Xu Y, Natrajan M, Lai L, Patel SM, Levit RD, Edupuganti S, Mulligan MJ. Pericarditis Associated With Acute Zika Virus Infection in a Returning Traveler. Open Forum Infect Dis. 2017;4(2):ofx103.
8. Brasil P, Calvet GA, Siqueira AM, Wakimoto M, de Sequeira PC, Nobre A, Quintana Mde S, Mendonça MC, Lupi O, de Souza RV, Romero C, Zogbi H, Bressan Cda S, Alves SS, Lourenço-de-Oliveira R, Nogueira RM, Carvalho MS, de Filippis AM, Jaenisch T. Zika Virus Outbreak in Rio de Janeiro, Brazil: Clinical Characterization, Epidemiological and Virological Aspects. PLoS Negl Trop Dis. 2016;10(4):e0004636.
9. Salud Sd. “Casos Confirmados de Enfermedad por Virus del Zika”, Semana Epidemiológica 44 del 2018. In: salud Sdpypdl, editor. https://www.gob.mx/salud/2018.
10. Song BH, Yun SI, Woolley M, Lee YM. Zika virus: History, epidemiology, transmission, and clinical presentation. J Neuroimmunol. 2017;308:50-64.
11. Calvet GA, Kara EO, Giozza SP, Botto-Menezes CHA, Gaillard P, de Oliveira Franca RF, de Lacerda MVG, da Costa Castilho M, Brasil P, de Sequeira PC, de Mello MB, Bermudez XPD, Modjarrad K, Meurant R, Landoulsi S, Benzaken AS, de Filippis AMB, Broutet NJN; ZIKABRA Study Team. Study on the persistence of Zika virus (ZIKV) in body fluids of patients with ZIKV infection in Brazil. BMC Infect Dis. 2018;18(1):49.
12. Turmel JM, Abgueguen P, Hubert B, Vandamme YM, Maquart M, Le Guillou-Guillemette H, Leparc-Goffart I. Late sexual transmission of Zika virus related to persistence in the semen. Lancet. 2016;387(10037):2501.
13. Mysorekar IU, Diamond MS. Modeling Zika Virus Infection in Pregnancy. N Engl J Med. 2016;375(5):481-4.
14. 14. Wu KY, Zuo GL, Li XF, Ye Q, Deng YQ, Huang XY, Cao WC, Qin CF, Luo ZG. Vertical transmission of Zika virus targeting the radial glial cells affects cortex development of offspring mice. Cell Res. 2016;26(6):645-54.
15. Hastings A, Fikrig E. Zika Virus and Sexual Transmission: A New Route of Transmission for Mosquito-borne Flaviviruses. Yale J Biol Med 2017;90(2):325-30.
16. Parra B, Lizarazo J, Jimenez-Arango JA, Zea-Vera AF, Gonzalez-Manrique G, Vargas J, Angarita JA, Zuñiga G, Lopez-Gonzalez R, Beltran CL, Rizcala KH, Morales MT, Pacheco O, Ospina ML, Kumar A, Cornblath DR, Muñoz LS, Osorio L, Barreras P, Pardo CA. Guillain-Barre Syndrome Associated with Zika Virus Infection in Colombia. N Engl J Med. 2016;375(16):1513-23.
17. Nascimento OJM, da Silva IRF. Guillain-Barre syndrome and Zika virus outbreaks. Curr Opin Neurol. 2017;30(5):500-7.
18. Goodfellow FT, Willard KA, Wu X, Scoville S, Stice SL, Brindley MA. Strain-Dependent Consequences of Zika Virus Infection and Differential Impact on Neural Development. Viruses. 2018;10(10)..
19. Mlakar J, Korva M, Tul N, Popovic M, Poljsak-Prijatelj M, Mraz J, Kolenc M, Resman Rus K, Vesnaver Vipotnik T, Fabjan Vodušek V, Vizjak A, Pižem J, Petrovec M, Avšič Županc T. Zika Virus Associated with Microcephaly. N Engl J Med. 2016;374(10):951-8.
20. Panchaud A, Stojanov M, Ammerdorffer A, Vouga M, Baud D. Emerging Role of Zika Virus in Adverse Fetal and Neonatal Outcomes. Clin Microbiol Rev. 2016;29(3):659-94.
21. Bradley M, Nagamine C. Animal Models of Zika Virus. Comp Med. 2017;67(3):242-52.
22. Miner JJ, Diamond MS. Zika Virus Pathogenesis and Tissue Tropism. Cell Host Microbe. 2017;21(2):134-42.
23. Minhas AM, Nayab A, Iyer S, Narmeen M, Fatima K, Khan MS, Constantin J. Association of Zika Virus with Myocarditis, Heart Failure, and Arrhythmias: A Literature Review. Cureus. 2017;9(6):e1399.
24. Bergelson JM. Intercellular junctional proteins as receptors and barriers to virus infection and spread. Cell Host Microbe. 2009;5(6):517-21.
25. Goasdoue K, Miller SM, Colditz PB, Bjorkman ST. Review: The blood-brain barrier; protecting the developing fetal brain. Placenta. 2017;54:111-6.
26. Ballabh P, Braun A, Nedergaard M. The blood-brain barrier: an overview: structure, regulation, and clinical implications. Neurobiol Dis. 2004;16(1):1-13.
27. Daniels BP, Klein RS. Viral sensing at the blood-brain barrier: new roles for innate immunity at the CNS vasculature. Clin Pharmacol Ther. 2015;97(4):372-9
28. Mladinich M, Schwedes J, Mackow E. Zika Virus Persistently Infects and Is Basolaterally Released from Primary Human Brain Microvascular Endothelial Cells. MBio. 2017;8(4):e00952-17.
29. Papa MP, Meuren LM, Coelho SVA, Lucas CGO, Mustafa YM, Lemos Matassoli F, Silveira PP, Frost PS, Pezzuto P, Ribeiro MR, Tanuri A, Nogueira ML, Campanati L, Bozza MT, Paula Neto HA, Pimentel-Coelho PM, Figueiredo CP, de Aguiar RS, de Arruda LB. Zika Virus Infects, Activates, and Crosses Brain Microvascular Endothelial Cells, without Barrier Disruption. Front Microbiol. 2017;8:2557.
30. Alimonti JB, Ribecco-Lutkiewicz M, Sodja C, Jezierski A, Stanimirovic DB, Liu Q, Haqqani AS, Conlan W, Bani-Yaghoub M. Zika virus crosses an in vitro human blood brain barrier model. Fluids Barriers CNS. 2018;15(1):15.
31. Shao Q, Herrlinger S, Yang SL, Lai F, Moore JM, Brindley MA, Chen JF. Zika virus infection disrupts neurovascular development and results in postnatal microcephaly with brain damage. Development. 2016;143(22):4127-36.
32. Marrs C, Olson G, Saade G, Hankins G, Wen T, Patel J, Weaver S. Zika Virus and Pregnancy: A Review of the Literature and Clinical Considerations. Am J Perinatol. 2016;33(7):625-39.
33. Souza BS, Sampaio GL, Pereira CS, Campos GS, Sardi SI, Freitas LA, Figueira CP, Paredes BD, Nonaka CK, Azevedo CM, Rocha VP, Bandeira AC, Mendez-Otero R, Dos Santos RR, Soares MB. Zika virus infection induces mitosis abnormalities and apoptotic cell death of human neural progenitor cells. Sci Rep. 2016;6:39775.
34. Dang J, Tiwari SK, Lichinchi G, Qin Y, Patil VS, Eroshkin AM, Rana TM. Zika Virus Depletes Neural Progenitors in Human Cerebral Organoids through Activation of the Innate Immune Receptor TLR3. Cell stem cell. 2016;19(2):258-65.
35. Tang H, Hammack C, Ogden SC, Wen Z, Qian X, Li Y, Yao B, Shin J, Zhang F, Lee EM, Christian KM, Didier RA, Jin P, Song H, Ming GL. Zika Virus Infects Human Cortical Neural Progenitors and Attenuates Their Growth. Cell stem cell. 2016;18(5):587-90.
36. Li H, Saucedo-Cuevas L, Regla-Nava J, Cha iG, Sheets N, Tang W, Terskikh AV, Shresta S, Gleeson JG. Zika Virus Infects Neural Progenitors in the Adult Mouse Brain and Alters Proliferation. Cell Stem Cell. 2016;19(5):593-8.
37. McGrath EL, Rossi SL, Gao J, Widen SG, Grant AC, Dunn TJ, Azar SR, Roundy CM, Xiong Y, Prusak DJ, Loucas BD, Wood TG, Yu Y, Fernández-Salas I, Weaver SC, Vasilakis N, Wu P. Differential Responses of Human Fetal Brain Neural Stem Cells to Zika Virus Infection. Stem cell reports. 2017;8(3):715-27.
38. Sofroniew MV, Vinters HV. Astrocytes: biology and pathology. Acta Neuropathol. 2010;119(1):7-35.
39. Hamel R, Ferraris P, Wichit S, Diop F, Talignani L, Pompon J, Garcia D, Liégeois F, Sall AA, Yssel H, Missé D. African and Asian Zika virus strains differentially induce early antiviral responses in primary human astrocytes. Infect Genet Evol. 2017;49:134.
40. Kozak RA, Majer A, Biondi MJ, Medina SJ, Goneau LW, Sajesh BV, Slota JA, Zubach V, Severini A, Safronetz D, Hiebert SL, Beniac DR, Booth TF, Booth SA, Kobinger GP. MicroRNA and mRNA Dysregulation in Astrocytes Infected with Zika Virus. Viruses. 2017;9(10).
41. Zorec R, Zupanc TA, Verkhratsky A. Astrogliopathology in the infectious insults of the brain. Neurosci Lett. 2018;689:56-62.
42. Monel B, Compton AA, Bruel T, Amraoui S, Burlaud-Gaillard J, Roy N, Guivel-Benhassine F, Porrot F, Génin P, Meertens L, Sinigaglia L, Jouvenet N, Weil R, Casartelli N, Demangel C, Simon-Lorière E9, Moris A, Roingeard P, Amara A, Schwartz O. Zika virus induces massive cytoplasmic vacuolization and paraptosis-like death in infected cells. EMBO J. 2017;36(12):1653-68.
43. 43. Li C, Xu D, Ye Q, Hong S, Jiang Y, Liu X, Zhang N, Shi L, Qin CF, Xu Z. Zika Virus Disrupts Neural Progenitor Development and Leads to Microcephaly in Mice. Cell stem cell. 2016;19(5):672.
44. Stolp HB, Molnar Z. Neurogenic niches in the brain: help and hindrance of the barrier systems. Front Neurosci. 2015;9:20.
45. Mesci P, Macia A, LaRock CN, Tejwani L, Fernandes IR, Suarez NA, de A Zanotto PM, Beltrão-Braga PCB, Nizet V, Muotri AR. Modeling neuro-immune interactions during Zika virus infection. Hum Mol Genet. 2018;27(1):41-52.
46. Carta González KA, Mendoza I, Morr I, Mendoza I, Misticchio F, Meza Y, Finizola V, Chazzin G, Marques J. Myocarditis, Heart Failure and Arrhythmias in Patients with Zika. J Am Coll Cardiol. 2017;69(11):906.
47. Mahrholdt H, Wagner A, Deluigi CC, Kispert E, Hager S, Meinhardt G, Vogelsberg H, Fritz P, Dippon J, Bock CT, Klingel K, Kandolf R, Sechtem U. Presentation, patterns of myocardial damage, and clinical course of viral myocarditis. Circulation. 2006;114(15):1581-90.
48. Caforio ALP, Malipiero G, Marcolongo R, Iliceto S. Myocarditis: A Clinical Overview. Curr Cardiol Rep. 2017;19(7):63.
49. García Hernández R, Espinosa Rivera F, L. RS. Dengue fever myocarditis. Rev Cubana Med. 2013;52(2):135 - 8.
50. Joob B, Wiwanitkit V. Cardiac problem because of Zika virus infection: a possibility. Anatol J Cardiol. 2016;16(6):455-6.
51. Wiwanitkit S. Carditis in Zika Virus Infection. J Cardiovasc Med Cardiol. 2017:012.
52. Zhao L, Fu Z. Roles of Host Immunity in Viral Myocarditis and Dilated Cardiomyopathy. J Immunol Res. 2018;2018:5301548.
53. Abdalla LF, Santos JHA, Barreto RTJ, Souza EME, D'Assuncao FF, Borges MA, Nascimento VA, da Silva GAV, de Souza VC, Ramasawmy R, Campi-Azevedo AC, Coelho-Dos-Reis JG, Antonelli LRDV, Teixeira-Carvalho A, Martins-Filho OA, Naveca FG. Atrial fibrillation in a patient with Zika virus infection. Virol J. 2018;15(1):23.
54. Petersen E, Wilson ME, Touch S, McCloskey B, Mwaba P, Bates M, Dar O, Mattes F, Kidd M, Ippolito G, Azhar EI, Zumla A. Rapid Spread of Zika Virus in The Americas--Implications for Public Health Preparedness for Mass Gatherings at the 2016 Brazil Olympic Games. Int J Infect Dis. 2016;44:11-5.
55. Angelidou A, Michael Z, Hotz A, Friedman K, Emani S, LaRovere K, Christou H. Is There More to Zika? Complex Cardiac Disease in a Case of Congenital Zika Syndrome. Neonatology. 2018;113(2):177-82.
| Recibido: 21 de noviembre de 2018 | Aceptado: 13 de marzo de 2019 |
Marcos F. Ocaña Sánchez. Circuito Gonzálo Aguirre Beltran S/N, Zona Universitaria, Xalapa, Veracruz. CP 91000. Tel. 01 228 842 1759 Ext: 11647. Correo electrónico: maocana@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
