Incremento de receptores endocanabinoides cerebelares tras estimulación musical de ratas con autismo inducido postnatalmente
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Monje-Reyna, Daniela1*; García-Hernández Luis Isauro2; Carillo-Castilla, Porfirio3; Coria-Ávila, Genaro Alfonso2; Toledo-Cardenas, María Rebeca2; Hernández-Aguilar, María Elena2; Manzo-Denes, Jorge22
1Doctorado en Investigaciones Cerebrales; 2Centro de Investigaciones Cerebrales; 3Instituto de Neuroetología; Universidad Veracruzana, Xalapa, Ver.
Resumen/Abstract
Introducción
Material y métodos
Resultados
Discusión
Agradecimientos
Referencias
Correspondencia
El trastorno del espectro autista (TEA) comprende un complejo de alteraciones neurales del desarrollo, manifestadas de manera heterogénea pero destacando características constantes de anormalidades neuroanatómicas y funcionales en la estructura cerebelar. En este contexto se cuenta con amplia evidencia de que el sistema endocanabinoide desempeña un importante papel para la regulación de la neurotransmisión y transducción de señales tanto excitatorias como inhibitorias en el cerebelo, las cuales se encuentran afectadas en el TEA. En humanos con autismo, las intervenciones terapéuticas con estimulación musical han dado resultados exitosos para reestablecer diferentes conductas propias del trastorno; sin embargo, el estudio a nivel neural, específicamente en el cerebelo aún es limitado. Este trabajo implementó la estimulación musical en un modelo animal de autismo inducido después del nacimiento; se expuso a ratas Wistar con autismo inducido a música clásica para piano del compositor W.A. Mozart desde el día p1 al p30 y se evaluó la densidad de los receptores a canabinoides tipo 1 (CB1) en la corteza del flóculo cerebelar. Los análisis inmunohistoquímicos en la corteza cerebelosa revelaron que sujetos de ambos sexos que recibieron estimulación musical, presentaron mayor densidad en los receptores CB1. En las ratas macho se encontró una mayor densidad para las capas molecular y granular, mientras que en las hembras sólo se detectaron en la capa granular. Concluimos que la música tuvo un impacto en el sistema de señalización celular regulado por canabinoides en la corteza del flóculo cerebelar de ratas con autismo inducido, en donde se mostró un aumento en la densidad de receptores CB1.
Palabras clave: Autismo, Conducta, Estimulación musical, Valproato, Receptores CB1.
The autistic spectrum disorder (ASD) comprises a complex of neural alterations of development that are expressed in a heterogeneous manner, highlighting constant features of neuroanatomic and functional abnormalities in the cerebellar structure. In this context, there is wide evidence that the endocannabinoid system plays an important role in the regulation of neurotransmission and transduction of both excitatory and inhibitory signals in the cerebellum, which are affected in ASD. In humans with autism, therapeutic interventions with musical stimulation have given successful results to reestablish different behaviors characteristic of the disorder; however, at the neural level and specifically in the cerebellum studies are still limited. In this work, musical stimulation was implemented in an animal model of induced autism after birth. Wistar rats with induced autism were exposed to classical piano music by composer W.A. Mozart from day p1 to p30 and the density of cannabinoid receptors 1 (CB1) in the cortex of the cerebellar flocculus was evaluated. Immunohistochemical analyzes in the cerebellar cortex revealed that subjects of both sexes who received musical stimulation presented higher density in CB1 receptors. In male rats a higher density was found for the molecular and granular layers, whereas in females they were only detected in the granular layer. We concluded that music had an impact at the cellular signaling regulated by cannabinoids in rats with induced autism on the flocculus cerebellar cortex, where there were an increase on CB1 receptors.
Keywords: Autism, Behavior, Music Stimulation, Valproate, CB1 Receptors..
Los Trastornos del Espectro Autista (TEA) inician en la infancia temprana y permanecen a lo largo de la vida. Se presentan en distintos grados de severidad, por ello el término “espectro”, ya que involucra a una gama de diferentes síntomas y deficiencias, lo que implica una gran heterogeneidad de manifestaciones conductuales. Su diagnóstico clínico se basa en la evaluación de la conducta y su etiología responde a factores genéticos o epigenéticos. No obstante, existen tres deficiencias centrales que son: interacción social disminuida, déficits de comunicación y conductas o intereses repetitivos.1-5
Entre la gama de alteraciones neurales en el autismo, las vías sensoriales se ven fuertemente impactadas; dentro de ellas la hipersensibilidad de la vía auditiva es la reportada con más frecuencia en la mayoría de los casos.5-7 Los mecanismos propuestos sobre los déficits auditivos que presentan las personas con TEA van desde daño estructural o funcional en estructuras periféricas (oído medio o interno) y vías neurales (nervio auditivo), hasta estructuras centrales (como tallo cerebral y áreas corticales);7 en ellas se han descrito alteraciones de procesamiento auditivo atípico como hiper o hipo reactividad hacia las señales auditivas. Sin embargo, se desconocen todas las rutas neurales específicas para estas alteraciones.
En el estudio del TEA se reportan diferentes anormalidades neuroanatómicas que han conducido a una mayor comprensión sobre los factores genéticos y celulares implicados. Entre las áreas reportadas, tanto en datos clínicos humanos como en modelos animales de TEA, la patogénesis en el cerebelo aparece implicada de manera constante, mostrando que defectos en el cerebelo, lesiones y manipulaciones genéticas o farmacológicas, promueven el fenotipo autista.8,9 Aunado a ello, las características centrales de los trastornos autistas son funciones en las que la intervención del cerebelo ha sido bien descrita.8,10,11
Integrando las alteraciones auditivas en los TEA y la importancia de la estructura cerebelar como una estructura primordial para comprender dichos trastornos, se dispone de evidencia sobre la organización del área auditiva en el cerebelo con estudios realizados en gatos desde 1944, donde se observó que esta estructura recibía información auditiva, táctil y visual.12 Posteriormente, diversos autores que hicieron trabajos en animales, describen que el área auditiva cerebelar se localiza en los lóbulos IX y X, y para la mayoría se localiza en los lóbulos VI, VII y estructura del flóculo.12
La estructura flocular (flóculo y paraflóculo) es un compartimento que forma parte del cerebelo y que ejerce funciones sobre el aprendizaje y el control motor.12,13 Recibe señales de diferentes áreas del cerebro involucradas en dinámicas de movimiento ocular y de la corteza auditiva recibe información través de las fibras musgosas;12,13 donde al igual que en el resto de la corteza cerebelar, las señales convergen en las células de Purkinje. También se sabe que recibe información a través de las fibras trepadoras que se originan en la oliva inferior.13 Respecto a su participación en señales auditivas, hay trabajos que evidencian que la estimulación eléctrica de la corteza auditiva es capaz de evocar respuestas en el lóbulo paraflocular, demostrando así que el paraflóculo es un importante blanco integrador para la información de la corteza auditiva.14
Para el estudio de los trastornos del espectro autista actualmente existe una variedad de modelos animales que permiten examinar alteraciones genéticas, cerebrales y de conducta que asemejan el fenotipo autista, incluyendo los síntomas centrales de los TEA en humanos.1-4,15 Uno de ellos, es el uso del valproato administrado postnatalmente en roedores, el cual emula el efecto de este teratógeno durante el tercer trimestre de embarazo y meses posteriores, alterando de manera particular los patrones de desarrollo cerebral y poniendo de manifiesto conductas propias del espectro autista.4,16 La administración postnatal de valproato impacta un periodo sensible del desarrollo cerebelar, durante el cual su organización y proliferación neuronal se encuentran ya completas, pero la diferenciación, mielinización, sinaptogénesis y génesis de la glía aún continúan.16 Como teratógeno, afecta la estructura neuronal, la correcta arborización y la poda dendrítica, impidiendo así una sinaptogénesis y función neuronal apropiada, que se reflejan en la alteración de funciones motoras y sensoriales.1-4,16 En este escenario los roedores expuestos al valproato, presentan respuestas atípicas a la estimulación sensorial, las cuales abarcan desde la hipo, a la hiper sensibilidad, y se ha encontrado que para ambos sexos la disfunción de conductas motoras y sensitivas está presente en más del 70% de los individuos, aunado a conductas ansiosas e interacción social disminuida.4,16 Dentro de las alteraciones morfológicas en el cerebelo observadas con este modelo, se encuentran la reducción de los hemisferios cerebelares, disminución del número de células de Purkinje, desarrollo anormal en las capas de la corteza cerebelar (procesos de migración y sinaptogénesis) y el aumento de muerte celular.16
Dentro de la gama de afectaciones en los TEA, también se reportan alteraciones en diversos sistemas de neurotransmisión, dentro de ellos: el sistema endocanabinoide, que desempeña un papel central en una amplia variedad de procesos fisiológicos y conductuales,17-19 y que para el fenotipo autista se ha relacionado con el control de respuestas emocionales, sensibilidad hacia el contexto e interacción social.19,20 El sistema endocanabinoide comprende dos receptores principales acoplados a proteínas G que son CB1 y CB2, de los cuales el receptor CB1 se encuentra principalmente en el sistema nervioso central (SNC) y el CB2 en sistema inmune. En el cerebelo los receptores CB1 se encuentran localizados en las terminales presinápticas tanto de neuronas glutamatérgicas como GABAérgicas lo que les permite suprimir tanto la neurotransmisión excitatoria como inhibitoria.19,21,22 Ambos mecanismos tienen en común que la despolarización pre-sináptica induce un aumento de calcio en la neurona postsináptica y activa la síntesis de endocanabinoides que son liberados desde la neurona despolarizada de Purkinje.21-23
En relación al autismo, son pocos los estudios que exploran el sistema endocanabinoide en un modelo animal. Un antecedente directo de esta exploración que utilizó valproato prenatalmente en ratas juveniles (PN 33-40) encontró disminuida la expresión de mRNA para la enzima diacilglicerol (DAGL), quien sintetiza uno de los principales ligandos (2-araquidonilglicerol) para los receptores canabinoides. Esto condujo a los autores a concluir que existe una afectación en la homeostasis del sistema endocanabinoide en el autismo.19
Cambiando el enfoque, ahora hacia las alternativas de intervención terapéutica en humanos, éstas se dirigen a atender el restablecimiento de habilidades comunicativas, sociales y conductuales. Entre éstas, se encuentra la estimulación musical, la cual cuenta con un amplio rango de técnicas sistematizadas y definidas que proveen un marco aplicable para el trabajo terapéutico en esta población.24,25 Las investigaciones en humanos muestran la preferencia de los sujetos con TEA por estímulos musicales en comparación con estímulos verbales,26 concluyendo que probablemente la estructura regular de la música puede proveer una especie de andamiaje para la organización de entradas de información sensorial, y que la habilidad para detectar pequeños cambios tonales permanece conservada lo que se relaciona con la memoria tonal, el procesamiento métrico y armónico, así como con el procesamiento de fonemas nativos.27 Además, se ha observado el favorecimiento del desarrollo de conducta social, de cooperación y de contacto visual.27
Las investigaciones en animales muestran que la exposición a algunas composiciones de Mozart (sonata para dos pianos K.448) tiene efectos óptimos en la conducta.28,29 Dentro de los hallazgos reportados, animales con la estimulación de esta obra eran más rápidos y cometían menos errores en las pruebas realizadas en un laberinto múltiple en T, en comparación a los animales controles.28 En otro estudio, después de producir una lesión para afectar la memoria, y utilizando otras sonatas de Mozart (K.280 F, K.282 E, K.283 G), se observó un efecto neuroprotector a largo plazo contra déficits de memoria espacial, lo que sugiere que la música estimula el procesamiento de la información espacial así como mecanismos de excitación emocional.29
Con los antecedentes expuestos y a pesar de la serie de investigaciones que a la fecha se han desarrollado en relación con la música y los trastornos del espectro autista, se carece aún de algún estudio que analice el impacto de la estimulación musical sobre los receptores endocanabinoides CB1 en ratas con autismo inducido. Por ello este trabajo se convierte en un antecedente de gran valor para complementar la comprensión entre el sistema endocanabioide y los trastornos del espectro autista en un área del cerebelo no estudiada en este escenario.
2.1. Sujetos experimentales
Se utilizaron ratas de la cepa Wistar, de la colonia del Centro de Investigaciones Cerebrales de la Universidad Veracruzana, mantenidas en un ciclo invertido de luz-oscuridad de 12:12 hrs, puestas en cruza durante 12 días. Posteriormente se alojaron individualmente en cajas de acrílico transparente con comida y agua ad libitum. Después del nacimiento, las crías permanecieron junto con su madre, hasta que alcanzaron la edad postnatal de 21 días, fecha en la que se realizó el destete. Los protocolos experimentales se realizaron bajo los estándares de la Norma Oficial Mexicana (NOM-062-ZOO-1999) y las Políticas para el Uso de Animales en la Investigación en Neurociencias de la Society for Neuroscience.
La población total de ratas usada fue de 48 animales, divididos en cuatro grupos para cada sexo. Cada grupo se conformó por 6 animales. El grupo Control Sin Música (CSM) se formó con ratas de 30 días de edad que no recibieron estimulación musical. El grupo Control con Música (CCM) con ratas de 30 días de edad que recibieron estimulación musical. El de Valpróico Sin Música (VSM) con ratas de 30 días de edad, tratadas postnatalmente con valproato que no recibieron estimulación musical. Y el Valpróico con Música (VCM) con ratas de 30 días de edad tratadas postnatalmente con valproato y que recibieron estimulación musical.
2.2. Administración de valproato
Todos los grupos recibieron una única inyección al día P10. Al grupo VSM y VCM se administró una dosis de 400 mg/kg de sal de valproato de sodio (Sigma-Aldrich, 1069-66-5), disuelta en solución salina 0.9%, 0.1M, pH=7.4, en volumen de 1 ml, por inyección subcutánea (aguja calibre 27Gx 13mm). Esta dosis ya ha sido referenciada como modelo de autismo ocasionando disfunciones de comportamiento social, acompañado de características de ansiedad.30 Para el grupo CSM y CCM se aplicó una inyección de solución salina estéril de 0.1ml de manera subcutánea con aguja del mismo calibre.
2.3. Estimulación Musical
Se inició la estimulación musical desde el día P1 al P30. Los animales fueron estimulados una hora diaria de manera grupal en su caja de acrílico en el 2º tercio de su ciclo de actividad. No fueron aislados de su madre para recibir dicha estimulación en primeros 21 días. Las obras musicales utilizadas fueron: sonatas para piano, K.280 F, K.282 E, K.283 G y sonata para dos pianos K.448 1er Mov. de W. A. Mozart. La música fue emitida a una intensidad de 70 dB con las sonatas reproducidas de forma aleatoria mediante una bocina externa operada por bluetooth.
2.4. Anestesia y extracción de tejido
Finalizada la fase de estimulación, se le administró al sujeto una sobredosis de anestesia con pentobarbital sódico (Cheminova de México S.A de C.V) por vía intraperitoneal en una dosis de 120mg/kg, se esperó hasta que se encontrara inconsciente, verificando que no mostrara reflejos de punción y podal. Encontrándose en este estado se procedió a la perfusión con solución salina al 0.9% y posteriormente con paraformaldehído al 4% para la fijación del tejido. Terminada la perfusión se decapitó al animal y se extrajo el cerebelo transfiriéndolo a una solución de paraformaldehído al 4% por 72 horas a una temperatura de 4°C y luego a una solución de sacarosa al 30% durante 72 horas a una temperatura de 4°C. Terminado el tiempo de inmersión en la solución de sacarosa se procedió a realizar los cortes del flóculo cerebelar (entiéndase, del complejo flocular: flóculo y paraflóculo) de manera sagital a 40 micras en un criostato Leica CM 1850 a una temperatura de -24°C. Ver figura 1.
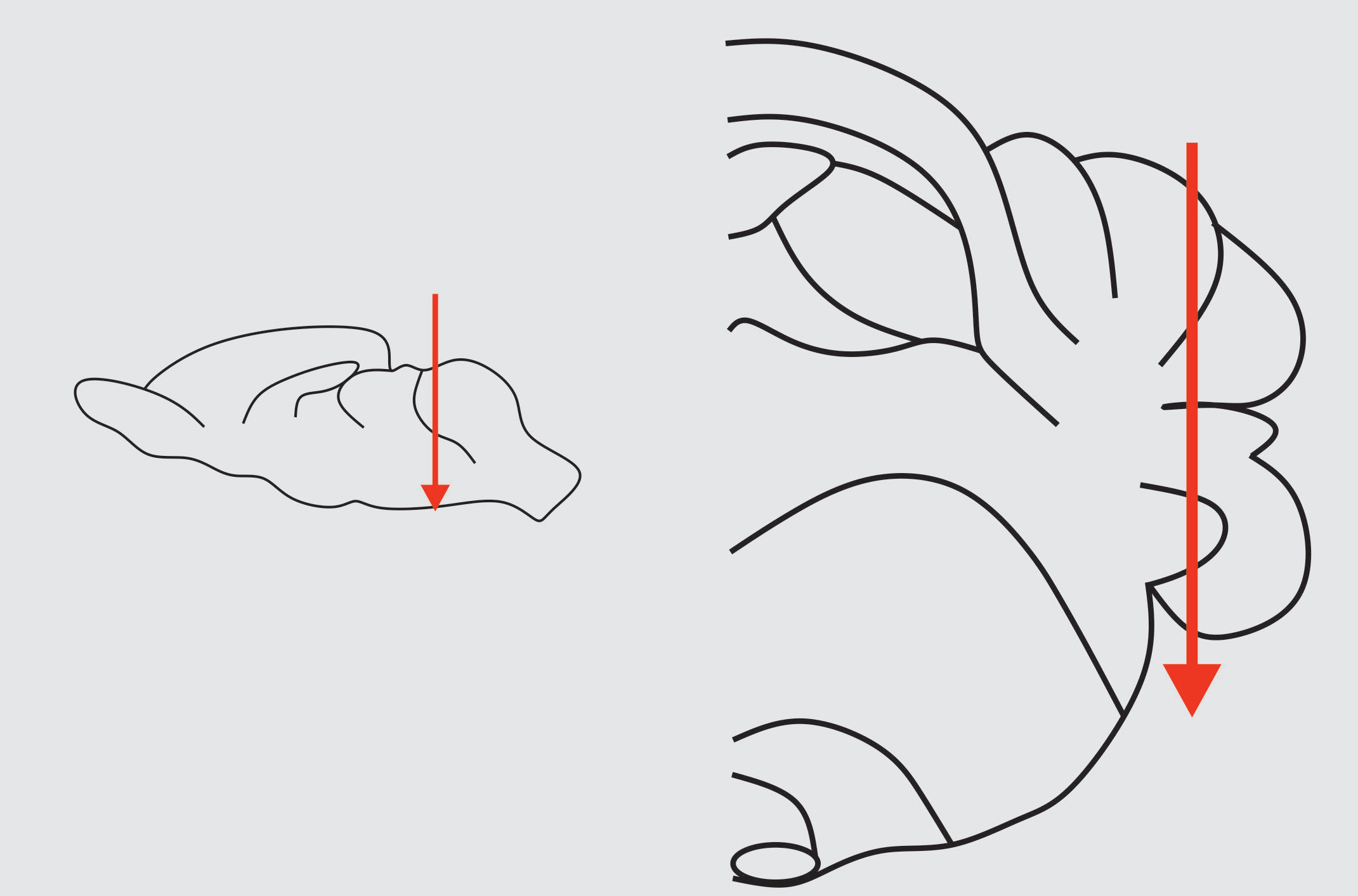
Figura 1. La imagen muestra el flóculo cerebelar de una rata. La flecha indica el área donde se realizaron los cortes de manera sagital.
2.5. Inmunohistoquímica peroxidativa
Mediante esta técnica se detectaron los receptores CB1 presentes en las terminales axónicas de las neuronas, lo cuales se muestran como partes obscurecidas en el tejido.
Para cada animal se tomaron 10 cortes y fueron almacenados en una solución crioprotectora, se lavaron entre 6 y 8 veces durante 5 minutos por lavado, en una solución de buffer fosfato salino (PBS) 0.1 molar, y durante 10 minutos en una solución de buffer fostato y Triton al 0.1% (PB-T). Posterior a ello se procedió a eliminar la peroxidasa endógena en una solución de 10 mililitros de PBS más 180 µl de peróxido de hidrógeno al 30%, durante 10 minutos en agitación constante a temperatura ambiente. Al terminar se hicieron 4 lavados por 5 minutos cada uno, en una solución de PB-T 0.1%. Se hizo un prebloqueo en 30 µl de suero de burro por cada 1000 µl necesarios, en una solución de PBT al 0.3% durante 30 minutos. Finalizado el tiempo, se añadió el anticuerpo primario hecho en cabra CB1 (N15): SC-10068 (Santacruz Biotecnology, Inc.), a una dilución de 1:200, dejándolo incubar durante 48 horas. Finalizado el tiempo de incubación se hicieron 5 lavados de 5 minutos cada uno, en una solución de PB-T 0.1%. Terminados los lavados se procedió a la incubación del anticuerpo secundario, hecho en burro contra cabra IgG-B: sc-2042 (Santacruz Biotecnology, Inc.), a una dilución de 1:400 en una solución de PBT al 0.3% durante 2 horas en agitación constante a temperatura ambiente. Terminado el tiempo de incubación se hicieron 4 lavados durante 5 minutos cada uno, en una solución de PB-T 0.1%. Al terminar estos lavados se aplicó el complejo abidina-biotina, Vectastain ABC Kit (Vector Laboratories) en una solución de PB 0.1 molar en una dilución 1:250, y se dejó incubar durante 90 minutos. El complejo abidina-biotina se preparó 30 minutos antes de su utilización. Concluida la incubación se hicieron 3 lavados de 5 minutos cada uno en una solución de PB-T 0.1% y un lavado de 10 minutos en una solución de PBS 0.1 molar. Para el revelado se agregaron 3 gotas de diaminobenzidina, 2 gotas de niquel y 2 gotas de H2O2 en 10 mililitros de PBS 0.1 molar. Finalizado el revelado se montaron los cortes en portaobjetos gelatinizados dejándolos secar a temperatura ambiente por 2 días, tras los cuales se realizaron baños de 1 minuto en etanol a diferentes concentraciones, empezando por uno al 70%, seguido de otro al 90% y la último al 100%. Se dejaron secar por 30 minutos, se aplicó Permount (Fisher Scientific) y para concluir se puso el cubreobjetos.
Se utilizó un control de reactivo primario, empleando el procedimiento anteriormente descrito exceptuando la agregación del anticuerpo primario CB1 (N15): SC-10068 (Santacruz Biotecnology, Inc.).
2.6. Procesamiento y manejo de datos
Todas las imágenes digitales se obtuvieron utilizando un microscopio Leica DME, con el objetivo de 10X. Capturadas las imágenes se transformaron a escala de grises en un formato de 8 bits (8 bits por pixel), en donde se consideró que regiones más obscuras representan mayor densidad de receptores; la densidad se refiere al número de colores diferentes que puede contener cada uno de los puntos o pixeles en los 8 bits. Para medir la densidad de los receptores a CB1 se utilizó el programa Image-J versión 1.4.3.67. La densidad se evaluó para cada una de las capas que conforman la corteza del flóculo (molecular, Purkinje y granular) seleccionando un área de 100 x 55µm en cada capa.
Para el análisis de estadístico de datos y gráficas, se utilizó el programa Prism 7.0 (Graph Pad). La normalidad fue evaluada utilizando el test de Shapiro-Wilk. Se utilizó la prueba Kruskal-Wallis (KW) para evaluar la diferencia en las medianas de las poblaciones y como prueba post hoc el test de Dunn. El nivel de significación fue en α≤ .05.
En las hembras los resultados muestran que el grupo valpróico con estimulación musical (VCM) mostró mayor densidad de receptores CB1 en la capa granular, comparado con el grupo valpróico sin estimulación musical (VSM), ver figura 2. En los machos los resultados muestran mayor densidad para el grupo VCM comparado con el grupo VSM en la capa molecular. En este sexo, entre los grupos CSM (control sin estimulación musical) y VCM de las tres capas cerebelares, el grupo VCM mostró mayor densidad. Ver figura 3.
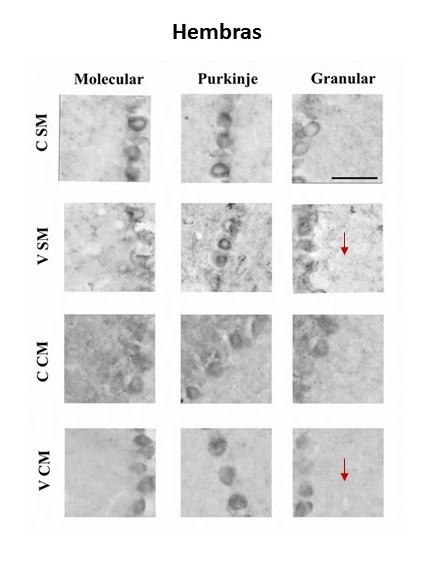
Figura 2. La imagen muestra los receptores CB1 en las tres capas de la corteza del flóculo cerebelar de los grupos de ratas hembra: CSM= control sin música; VSM= Valproico sin música; CCM= control con música; VCM= valproico sin música. La intensidad del color se asocia a una mayor densidad de receptores. La flecha indica la capa y el grupo entre los que se encontraron diferencias significativas. Con asterisco se indican las diferencias significativas p< 0.05. La barra de calibración representa 50µm.
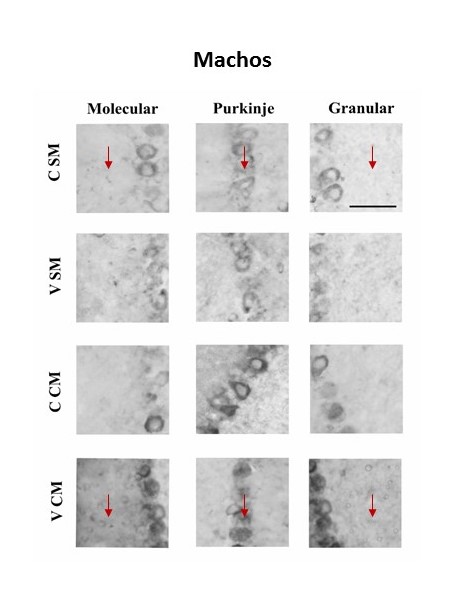
Figura 3. La imagen muestra los receptores CB1 en las tres capas de la corteza del flóculo cerebelar de los grupos de ratas macho: CSM= control sin música; VSM= Valproico sin música; CCM= control con música; VCM= valproico sin música. La intensidad del color se asocia a una mayor densidad de receptores. La flecha indica la capa y el grupo entre los que se encontraron diferencias significativas. Con asterisco se indican las diferencias significativas p<0.05. La barra de calibración representa 50µm.
3.1. Capa Molecular
3.1.1. Hembras
No se observaron diferencias significativas entre ninguno de los grupos. Ver figura 4.
3.1.2. Machos
Entre los grupos control (C) y valpróico (V) sin estimulación musical no se obtuvieron diferencias significativas. Mismo caso entre los grupos C y V con estimulación musical (CM). Entre los grupos valpróicos sin estimulación musical (SM) y con estimulación musical (CM) se registró una diferencia significativa, KW= 10.38, (4); p˂0.0478 mostrando mayor densidad de receptores a canabinoides en el grupo VCM. Para los grupos controles SM y CM no se observaron diferencias. Entre los grupos CSM y VCM se registró una diferencia significativa indicando mayor densidad de receptores para el grupo VCM, KW= 10.38, (4); p˂0.0330. Ver figura 5.
3.2. Capa de Purkinje
3.2.1. Hembras
No se observaron diferencias significativas entre ninguno de los grupos. Ver figura 4.
3.2.2. Machos
No se registraron diferencias significativas entre los grupos control (C) y valpróico (V) sin estimulación musical (SM), C y V con estimulación musical (CM), grupos valpróicos SM y CM, ni entre los grupos controles SM y CM. Entre los grupos CSM y VCM se registró una diferencia significativa indicando mayor densidad de receptores para el grupo VCM, KW= 10.13, (4); p˂0.0478. Ver figura 5.
3.3. Capa Granular
3.3.1. Hembras
No se registraron diferencias significativas entre los grupos C y V, sin estimulación musical (SM) ni entre los grupos C y V con estimulación musical (CM). Entre los grupos valpróicos SM y CM se registró una diferencia significativa indicando mayor densidad de receptores para el grupo VCM, KW= 9.54, (4); p˂0.0291 No hubo diferencias entre los grupos controles. Ver figura 4.
3.3.2. Machos
No se registraron diferencias significativas entre los grupos C y V sin estimulación musical (SM), C y V con estimulación musical (CM), grupos valpróicos SM y CM, ni entre los grupos controles SM y CM. Entre los grupos CSM y VCM se registró una diferencia significativa indicando mayor densidad de receptores para el grupo VCM, KW= 11.2, (4); p˂0.0115. Ver figura 5.
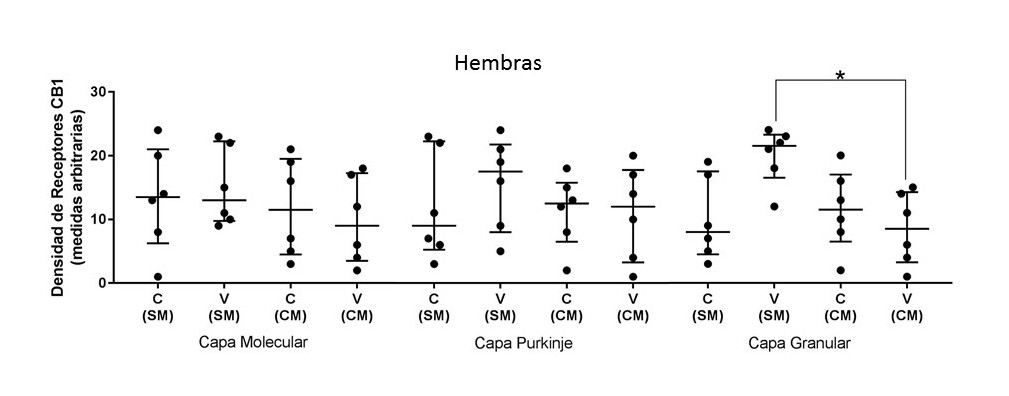
Figura 4. Las gráficas muestran la densidad de receptores CB1 en las tres capas de la corteza cerebelar para en el grupo de hembras: CSM= control sin música; CCM= control con música; VSM= Valproico sin música; VCM= valproico con música. Se muestra la mediana +/- el rango el intercuartil. El eje de las ordenadas muestra una escala de medidas arbitrarias sobre la densidad a receptores a CB1, donde valores cercanos a 0 representa el negro absoluto y 30 blanco absoluto. Se considera mayor densidad de receptores con los valores aproximados al color negro. Con asterisco se indican las diferencias significativas p< 0.05.
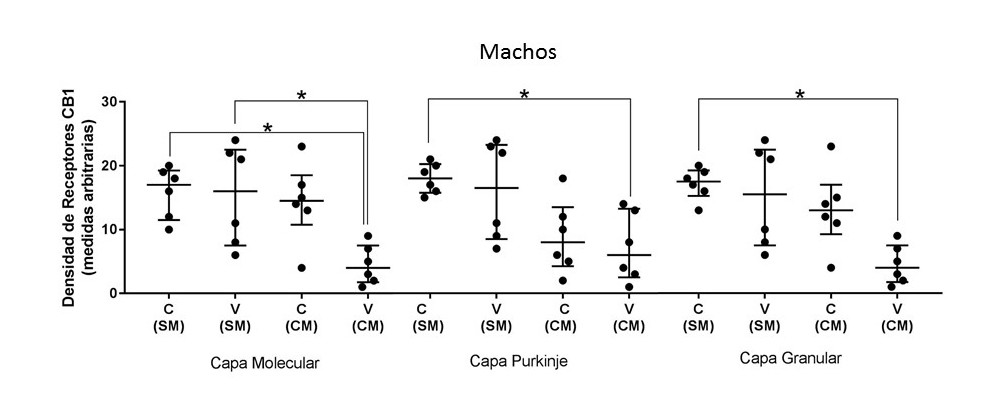
Figura 5. Las gráficas muestran la densidad de receptores CB1 en las tres capas de la corteza cerebelar para en el grupo de machos: CSM= control sin música; CCM= control con música; VSM= Valproico sin música; VCM= valproico con música. Se muestra la mediana +/- el rango el intercuartil. El eje de las ordenadas muestra una escala de medidas arbitrarias sobre la densidad a receptores a CB1, donde valores cercanos a 0 representa el negro absoluto y 30 blanco absoluto. Se considera mayor densidad de receptores con los valores aproximados al color negro. Con asterisco se indican las diferencias significativas p< 0.05.
El presente estudio fue diseñado para evaluar el efecto de la estimulación musical sobre los receptores canabinoides CB1, y tras los análisis inmunohistoquímicos realizados en la corteza del flóculo cerebelar se reveló que, para ambos sexos, los animales que recibieron la dosis de valproato, presentaron una mayor densidad de receptores a canabinoides (CB1) cuando recibieron estimulación musical. En el caso de las hembras se observó mayor densidad en la capa granular y, en los machos mayor densidad para las capas molecular y granular. Aunado a esto, el hecho de que no se hayan encontrado diferencias entre los grupos controles, concuerda con los antecedentes sobre la alteración en las vías sensoriales que padecen los individuos con TEA, ya que sólo en el grupo valpróico se registraron las diferencias significativas. Una posible explicación es que la música, haya funcionado como un patrón de actividad neural que, tras la exposición repetitiva a este estímulo después de 30 días, haya inducido a una mayor activación de receptores CB1 (evidenciado en el análisis densitométrico); pues se conoce que ciertos patrones de actividad neural generan depresión sináptica de corto plazo dependiente de canabinoides, los cuales involucran la activación de receptores,31 así mismo, que ciertos patrones de actividad neural involucran periodos breves de activación sináptica repetitiva.31,32 Por otra parte para entender el incremento en la densidad de receptores CB1 con la estimulación musical, en las capas molecular y granular, se debe considerar que el sistema canabinoide puede actuar como neuromodulador en diferentes sistemas, por su interacción con otros receptores, neurotransmisores o vías de señalización,31 y este fenómeno se ha descrito tanto en sinapsis excitatorias glutamatérgicas, como inhibitorias GABAérgicas. En las sinapsis excitatorias se ha reportado como homosináptica, es decir por actividad de las neuronas presináptica y postsináptica, y en sinapsis GABAérgicas como heterosinápticas, es decir en las sinapsis que están inactivas, y el debilitamiento de la sinapsis ocurre por otras neuronas que están modulando la sinapsis y no por la actividad de las neuronas presináptica y postsináptica.33 Así, la música con una función de estimulaciones aferentes pudo haber promovido la plasticidad dependiente de canabinoides de corto plazo (eSTD), conduciendo a la activación de distintas sinapsis en cerebelo.32,33 Como se mostró en los resultados, las diferencias aparecen tanto en la capa molecular, donde se produce neurotransmisión inhibitoria, como en la capa granular, donde se produce neurotransmisión excitatoria. La capa de Purkinje no presenta receptores para CB1.33 ya que los receptores no están presentes en los cuerpos neuronales sino en las terminales axónicas,33 no obstante la diferencia que se observa en el grupo de machos se considera que es el marcaje de los receptores alrededor de los cuerpos neuronales. Es importante tener en cuenta que la técnica utilizada en este trabajo, no concreta sobre la funcionalidad de receptores (activos /inactivos), solo nos permite detectarlos.
Los hallazgos encontrados en otras investigaciones donde se expuso roedores a música nos dan base para explicar la mayor densidad de receptores CB1 que encontramos en este trabajo; éstos, reportan que la música modula el desarrollo cerebral y neuroplasticidad por un incremento de los niveles de receptor NMDA en la corteza auditiva, así como de receptores AMPA y GluR2 en corteza auditiva y giro cingulado.34 Por otros trabajos, se conoce que en las sinapsis glutamatérgicas la activación de los receptores NMDA y mGluRs son mecanismos dependientes de canabinoides;31 y que la biosíntesis de los endocanabinoides es contingente con la ocupación de los receptores NMDA;33,35,36 Los trabajos mencionados prueban que la música incrementa los niveles de receptores ionotrópicos y metabotrópicos de glutamato (AMPA, NMDA y mGluRs), y esto nos proporciona elementos para explicar que, es posible que en la capa granular del cerebelo donde se ubican células de neurotransmisión glutamatérgica, la música, haya estimulado receptores de este tipo, los cuales favorecieron la mayor densidad de receptores CB1, encontrados en ambos sexos. Aunado a esto, las células glutamatérgicas de la capa granular, dentro de sus mecanismos de señalización requieren de las proteínas G, y la intervención de las enzimas fosfolipasa C (PLC) y diacilglicerol lipasa (DAG) y tanto las proteínas G, como la PLC y DAG participan en la formación de canabinoides y han sido bien descritas como enzimas precursoras para sintetizar de canabinoides.37
Por otra parte, trabajos tanto en animales como en humanos,38-41 muestran que en los TEA su manifestación y severidad es dependiente del sexo,42 manifestándose con menor deterioro y mejor respuesta a intervenciones terapéuticas, en individuos del sexo femenino.42,43 Así mismo, se considera que se requieren de más factores de riesgo tanto ambientales como genéticos para desarrollar autismo en niñas.42,43 A la fecha, no se ha determinado el mecanismo de riesgo o protección que difiere en ambos sexos, sin embargo varios estudios sugieren que hormonas como la testosterona, puede modular la variación del efecto genético en la presentación del fenotipo autista e incluso, se debate a estas fechas si el sexo femenino presenta un fenotipo autista diferente al masculino.42,43 Hasta el momento la evidencia en animales y humanos, muestra que cuando los circuitos neurales se ven alterados, la diferencia de sexo incide en la habilidad para la recuperación de los mecanismos afectados,40,42,43 con lo cual nuestro trabajo concuerda y evidencia las diferencias mencionadas, ya que la corteza cerebelar de ambos sexos respondió a la estimulación musical, aunque no de manera similar.
Tras la discusión anterior, proponemos un posible mecanismo para explicar el incremento en la densidad de receptores CB1 en el grupo autista que recibió estimulación musical: la exposición repetitiva a la estimulación musical ocasionó una activación sináptica prolongada que estimuló un aumento sostenido en la producción y activación de receptores glutamérgicos en la capa granular de la corteza cerebelosa, lo que a su vez estimuló la síntesis prolongada de canabinoides; la acción prolongada de los receptores CB1 pudo ocasionar la inhibición de la liberación de neurotransmisores en la capa molecular de la corteza cerebelosa, ocasionando el incremento observado.
El sistema endocanabinoide desempeña un papel central en una amplia variedad de procesos fisiológicos y conductuales en condiciones normales, y en relación a los TEA sus alteraciones intervienen en el control de respuestas emocionales y sensibilidad hacia el contexto e interacción social,44,45 por lo cual, considerando futuros trabajos se considera convenientes realizar una evaluación de tareas conductuales para entender la implicación de los receptores CB1. Así mismo, para profundizar sobre las diferencias entre sexos convendría realizar una evaluación densitométrica en un momento anterior del desarrollo, como PN10 que es donde se han encontrado niveles pico de para la síntesis de hormonas esteroideas en ambos sexos.38
Concluimos que la música tuvo un impacto en el sistema de señalización celular regulado por canabinoides en la corteza del flóculo cerebelar de ratas con autismo inducido, en donde se mostró un aumento en la densidad de receptores CB1.
Beca Conacyt No. 308916 (DMR), Cuerpos Académicos de Neurociencias (UV-CA-28) y Neuroquímica (UV-CA-304).
Los autores declaran que no tienen conflictos de intereses.
1. Arndt TL, Stodgell CJ, Rodier PM. The teratology of autism. Review. Int J Dev Neurosci. 2005; 23(2-3):189-99.
2. Schneider T, Przewłocki R. Behavioral alterations in rats prenatally exposed to valproic acid: animal model of autism. Neuropsychopharmacol. 2005; 30(1):80-9.
3. Chomiak T, Karnik V, Block E, Hu B. Altering the trajectory of early postnatal cortical development can lead to structural and behavioural features of autism. BMC Neurosci. 2010; 11:102.
4. Reynolds S, Millette A, Devine DP. Sensory and motor characterization in the postnatal valproate rat model of autism. Dev Neurosci. 2012; 34(2-3):258-67.
5. Donovan AP, Basson MA. The neuroanatomy of autism - a developmental perspective. J Anat. 2017; 230(1):4-15.
6. Gomes E, Pedroso FS, Wagner MB. Auditory hypersensitivity in the autistic spectrum disorder. Pro Fono. 2008; 20(4):279-84. Review.
7. Porges SW, Bazhenova OV, Bal E, Carlson N, Sorokin Y, Heilman KJ, Cook EH, Lewis GF. Reducing auditory hypersensitivities in autistic spectrum disorder: preliminary findings evaluating the listening project protocol. Front Pediatr. 2014; 2:80.
8. Stoodley CJ, Schmahmann JD. Functional topography in the human cerebellum: a meta-analysis of neuroimaging studies. Neuroimage. 2009; 44(2):489-501.
9. Badura A, Verpeut JL, Metzger JW, Pereira TD, Pisano TJ, Deverett B,Bakshinskaya DE, Wang SS. Normal cognitive and social development require posterior cerebellar activity. eLife. 2018; 7 e36401.
10. Buckner RL. The cerebellum and cognitive function: 25 years of insight from anatomy and neuroimaging. Neuron. 2013; 80(3):807-15.
11. Bruchhage MMK, Bucci MP, Becker EBE. Cerebellar involvement in autism and ADHD. Handb Clin Neurol. 2018; 155:61-72.
12. Sens PM, de Almeida CI. Participation of the cerebellum in auditory processing. Braz J. Otorhinolaryngol. 2007; 73(2):266-70. Review.
13. Winkelman B, Frens M. Motor coding in floccular climbing fibers. JNeurophysiol. 2006; 95(4):2342-51.
14. Azizi SA, Burne RA, Woodward DJ. The auditory corticopontocerebellar projection in the rat: inputs to the paraflocculus and midvermis. An anatomical and physiological study. Exp Brain Res. 1985; 59(1):36-49.
15. Varghese M, Keshav N, Jacot-Descombes S, Warda T, Wicinski B, Dickstein DL,Harony-Nicolas H, De Rubeis S, Drapeau E, Buxbaum JD, Hof PR. Autism spectrum disorder: neuropathology and animal models. Acta Neuropathol. 2017; 134(4):537-566.
16. Ergaz Z, Weinstein-Fudim L, Ornoy A. Genetic and non-genetic animal models for autism spectrum disorders (ASD). Reprod Toxicol. 2016; 64:116-40.
17. Trezza V, Vanderschuren LJ. Bidirectional cannabinoid modulation of social behavior in adolescent rats. Psychopharmacology (Berl). 2008; 197(2):217-27.
18. Viveros MP, Marco EM, López-Gallardo M, Garcia-Segura LM, Wagner EJ. Framework for sex differences in adolescent neurobiology: a focus on cannabinoids. Neurosci Biobehav Rev. 2011; 35(8):1740-51.
19. Kerr DM, Downey L, Conboy M, Finn DP, Roche M. Alterations in the endocannabinoid system in the rat valproic acid model of autism. Behav Brain Res.2013; 249:124-32.
20. Chakrabarti B, Persico A, Battista N, Maccarrone M. Endocannabinoid Signaling in Autism. Neurotherapeutics. 2015; 12(4):837-47.
21. Safo PK, Cravatt BF, Regehr WG. Retrograde endocannabinoid signaling in the cerebellar cortex. Cerebellum. 2006; 5(2):134-45. Review.
22. Yoshida T, Hashimoto K, Zimmer A, Maejima T, Araishi K, Kano M. The Cannabinoid CB1 Receptor Mediates Retrograde Signals for Depolarization-Induced Suppression of Inhibition in Cerebellar Purkinje Cells. The Journal of Neuroscience. 2002; 1:22(5):690–1697.
23. Hashimotodani Y, Ohno-shosaku T, Kano M. Endocannabinoids and Synaptic Function in the CNS. The Neuroscientist. 2007; 13 (2):127-137.
24. Simpson K, Keen D. Music interventions for children with autism: narrative review of the literature. J Autism Dev Disord. 2011; 41(11):1507-14.
25. Wigram T, Gold C. Music therapy in the assessment and treatment of autistic spectrum disorder: clinical application and research evidence. Child Care Health Dev. 2006; 32(5):535-42. Review.
26. DePape AM R; Hall GBC; Tillmann B; Trainor LJ. Auditory Processing in High-Functioning Adolescents with Autism Spectrum Disorder. PLoS ONE. 2012; 7(9) e44084.
27. Wan CY, Schlaug G. Neural pathways for language in autism: The potential for music-based treatments. Future Neurology. 2010; 5:797–805.
28. Rausher FH; Robinson D; y Jens JJ. Improved maze learning through early music exposure in rats. Neurological Research. 1998; 20(5):427-432.
29. Amagdei A, Balteş FR, Avram J, Miu AC. Perinatal exposure to music protects spatial memory against callosal lesions. Int J Dev Neurosci. 2010; 28(1):105-9.
30. Oguchi-Katayama A, Monma A, Sekino Y, Moriguchi T, Sato K. Comparative gene expression analysis of the amygdala in autistic rat models produced by pre- and post-natal exposures to valproic acid. J Toxicol Sci. 2013; 38(3):391-402.
31. Zarrans J.J Neurofarmacología contemporánea. Elsevier. España. 2011.
32. Maejima T, Oka S, Hashimotodani Y, Ohno-Shosaku T, Aiba A, Wu D, Waku K, Sugiura T, Kano M. Synaptically driven endocannabinoid release requires Ca2+- assisted metabotropic glutamate receptor subtype 1 to phospholipase Cbeta4 signaling cascade in the cerebellum. J Neurosci. 2005; 25(29):6826–35.
33. Südhof TC, Starke K. Pharmacology of Neurotransmitter Release. Handbook of Experimental Pharmacology 184. Springer-Verlag Berlin Heidelberg. 2008.
34. Sheikhi S, Saboory E. Neuroplasticity Changes of Rat Brain by Musical Stimuli during Fetal Period. Cell J. 2015; 16(4):448-55.
35. Mackie K, Stella N. Cannabinoid receptors and endocannabinoids: evidence for new players. AAPS J. 2006; 8(2):298-306.
36. Sudarov A. Defining the role of cerebellar Purkinje cells in autism spectrum disorders. Cerebellum. 2013; 12(6):950-5.
37. Jung KM, Mangieri R, Stapleton C, Kim J, Fegley D, Wallace M, Mackie K, Piomelli D. Stimulation of endocannabinoid formation in brain slice cultures through activation of group I metabotropic glutamate receptors. Mol Pharmacol. 2005; 68(5):1196–1202.
38. Dean SL, McCarthy MM. Steroids, sex and the cerebellar cortex: implications for human disease. Cerebellum. 2008; 7(1):38-47.
39. Crespo CN, García LI, Coria Genaro A, Carrillo P, Hernández ME, Manzo J. Mejora de las habilidades motoras y cognitivas de niños con autismo después de un periodo prolongado de juego con deportes virtuales. Revista eNeurobiología 2016. 7(15).
40. Goddard L, Dritschel B, Howlin P. A preliminary study of gender differences in autobiographical memory in children with an autism spectrum disorder. J Autism Dev Disord. 2014; 44(9):2087-95.
41. Petacchi A, Laird AR, Fox PT, Bower JM. Cerebellum and auditory function: an ALE meta-analysis of functional neuroimaging studies. Hum Brain Mapp. 2005; 25(1):118-28.
42. Halladay AK, Bishop S, Constantino JN, Daniels AM, Koenig K, Palmer K, Messinger D, Pelphrey K, Sanders SJ, Singer AT, Taylor JL, Szatmari P. Sex and gender differences in autism spectrum disorder: summarizing evidence gaps and identifying emerging areas of priority. Mol Autism. 2015; 13; 6:36.
43. Werling DM. The role of sex-differential biology in risk for autism spectrum disorder. Biol Sex Differ. 2016; 16; 7:58.
44. Viveros MP, Marco EM, López-Gallardo M, Garcia-Segura LM, Wagner EJ. Framework for sex differences in adolescent neurobiology: a focus on cannabinoids. Neurosci Biobehav Rev. 2011; 35(8):1740-51.
45. Kerr DM, Downey L, Conboy M, Finn DP, Roche M. Alterations in the endocannabinoid system in the rat valproic acid model of autism. Behav Brain Res.2013; 15; 249:124-32.
| Recibido: 13 de diciembre de 2018 | Aceptado: 25 de febrero de 2019 |
Dra. Daniela Monje Reyna. Centro de Investigaciones Cerebrales, Universidad Veracruzana. Médicos y odontólogos s/n, Unidad del Bosque, 91010 Xalapa Enríquez, Veracruz, México. Teléfono: (228) 841-8900 Ext. 16309. Correo electrónico: danielamonje@yahoo.com
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
