Un segundo espectro del autismo: de la conducta a la neurona
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Manzo-Denes Jorge
Centro en Investigaciones Cerebrales. Universidad Veracruzana, Xalapa, Veracruz, México.
Resumen/Abstract
Introducción
Conclusiones
Referencias
Correspondencia
El trastorno del espectro autista es una alteración del desarrollo neural que se refleja en modificaciones significativas de la conducta infantil. En la versión más reciente del Manual Diagnóstico y Estadístico de Trastornos Mentales, se describe al autismo como un conjunto de modificaciones de la conducta que incluyen decremento en la interacción social, decremento en las habilidades de comunicación verbal o respuestas inapropiadas durante la conversación, manifestaciones de conductas repetitivas o estereotipadas, carencia de empatía para entablar relaciones afectivas y obsesiones inapropiadas sobre objetos específicos. Todo esto acompañado de una habilidad cognitiva que va desde altos niveles de inteligencia hasta alteraciones intelectuales severas. Por ello, ahora se reconoce al autismo como un abanico de conductas agrupadas bajo el concepto de Trastorno del Espectro Autista. Sin embargo, hay otros espectros, como aquel que está directamente relacionado con las bases neurales. En esta revisión se describen las diferentes metodologías para diagnosticar conductualmente al autismo, las comorbilidades que se presentan, las regiones del sistema nervioso central afectadas, y el papel que juegan las neuronas espejo y la glía; con ello se percibe que la etiología del autismo puede presentarse en alguna de estas regiones. A pesar de que los temas no son exhaustivos, tienen el propósito de proponer que el Trastorno del Espectro Autista, que se basa en la conducta, tiene un segundo espectro: aquel que va de la conducta a la neurona
Palabras clave: Formaldehído, Neurotoxicidad, Memoria.
The autism spectrum disorder is an alteration of the neural development manifested in significant modifications of the toddler behavior. In the most recent version of the Diagnostic and Statistical Manual of Mental Disorders, it is described that autism is a group of behavioral alterations which include decreased social interaction, decreased abilities for verbal communication or inappropriate responses during a conversation, repetitive or stereotyped behaviors, lack of empathy to establish affective relationships, and unappropriated obsessions for specific objects. All of this along with a cognitive ability ranging from higher levels of intelligence to severe intellectual disabilities. Therefore, autism is now recognized as a wide complex of behaviors grouped under the concept of Autism Spectrum Disorder. Notwithstanding, there is another spectrum, the one that is closely related with the neural basis. The present review deals with the different methodologies for the behavioral diagnosis of autism, the existing comorbidities, the affected regions at the central nervous system, and the role of mirror neurons and glia; data indicate that the etiology of autism could be in any of these regions. Although descriptions are not exhaustive, they had the aim to propose that the Autism Spectrum Disorder, based on behavioral information, has a second spectrum: those that goes from behavior to the neuron.
Keywords: Autism, Neurodevelopment, Comorbidity, ASD.
El trastorno del espectro autista es una alteración del desarrollo neural que se refleja en modificaciones significativas de la conducta infantil. A la fecha, la detección del autismo aún carece de pruebas de laboratorio precisas para su confirmación, por lo que el diagnóstico concluyente se obtiene después de la observación apropiada de cambios conductuales. Si bien el estudio observacional de la conducta es una actividad ampliamente utilizada en animales desde el siglo pasado,1,2 el análisis de la conducta en niños con autismo entró apenas en los años recientes a una fase de consolidación. Esa es una de las razones por las que se explica el aparente crecimiento exponencial que se observa actualmente del trastorno, que en las estadísticas del Centro para el Control y Prevención de Enfermedades de los Estados Unidos se ha llegado a determinar la proporción de 1:68; esto es, un niño autista por cada 68 niños con desarrollo típico.
En la versión más reciente del Manual Diagnóstico y Estadístico de Trastornos Mentales (DSM-V), publicado por la Asociación Psiquiátrica Americana,3 se describe al autismo como un trastorno con amplio espectro de manifestaciones conductuales que incluyen decremento en la interacción social, decremento en las habilidades de comunicación verbal o respuestas inapropiadas durante la conversación, manifestaciones de conductas repetitivas o estereotipadas, carencia de empatía para entablar relaciones afectivas y obsesiones inapropiadas sobre objetos específicos. Todo esto acompañado de un complejo cognitivo que va desde altos niveles de inteligencia hasta severas alteraciones intelectuales. Por ello, ahora se reconoce al autismo como un abanico de manifestaciones agrupadas bajo el concepto de Trastorno del Espectro Autista o TEA. Sin embargo, hay un segundo espectro, aquel que subyace a las conductas autistas y que está directamente relacionado con sus bases neurales, lo que constituye la parte medular compilada en esta revisión. Los motores de búsqueda utilizados para la bibliografía fueron Scopus, PubMed y Google Scholar, utilizando la palabra “autism” o “autistic” junto con el tema en particular de cada sección.
2. Breve Historia
Las alteraciones específicas de las conductas autistas las reconoció por primera vez el psiquiatra suizo Paul Eugene Bleuer en 1912, después de haber descrito el término esquizofrenia y trabajado con algunos pacientes en los que observó las conductas de aislamiento social y las integró bajo el término de autismo.4 Sin embargo, fue hasta 1943, en la descripción detallada realizada por Leo Kanner,5 que se identificó por primera vez al autismo como un trastorno particular del desarrollo diferente de la esquizofrenia. Kanner hizo un análisis detallado de 11 niños, donde describe el aislamiento extremo, la conducta obsesiva, los movimientos estereotípicos y la ecolalia, describiendo relaciones sólo con objetos que no interfieren con la soledad del niño, acompañada de conductas ansiosas y tensas en presencia de otras personas con las que evitan contactos afectivos directos. El estudio de Kanner se convierte entonces en el trabajo crucial que reconoce al autismo como un trastorno específico del desarrollo. Un año después Hans Asperger utiliza también el termino autismo para describir una alteración conductual del desarrollo similar al autismo de Kanner, pero con un funcionamiento cognitivo alto.6 Aunque el trabajo de Asperger fue reconocido más tarde como un síndrome particular, a partir del trabajo detallado de Lorna Wing6 la Asociación Psiquiátrica Americana decidió eliminar el término “Síndrome de Asperger” para incluirlo como parte del TEA, lo que sigue generando amplias discusiones.7
Pasaron 31 años de Bleuer a Kanner y, a partir del trabajo de este último, el interés científico sobre el autismo empezó a tener un crecimiento exponencial que se disparó alrededor del año 2000, y que se puede observar en el número de publicaciones que aparecen con la búsqueda de la palabra “autism” en el sitio PubMed (Fig. 1). Con este breve análisis, es claro que la concienciación ha tenido un crecimiento significativo en el tiempo, lo que ayuda a explicar el gran número de casos que se percibe actualmente en todo el mundo. En adición al crecimiento científico, se observa a la par el crecimiento del interés social sobre el autismo, considerando la gran cantidad de grupos y sociedades, fundadas primordialmente por padres de algunos de estos niños, que buscan encontrar alternativas e impulsar la investigación para ayudar a mejorar la calidad de vida de todos ellos y encontrar nuevos acercamientos terapéuticos. Actualmente, también el avance tecnológico ha permitido la creación de aplicaciones virtuales específicas para niños con TEA, lo que parece tener éxito en la mejora para la manifestación de diferentes conductas, tal como se ha mostrado con el uso de juegos virtuales.8
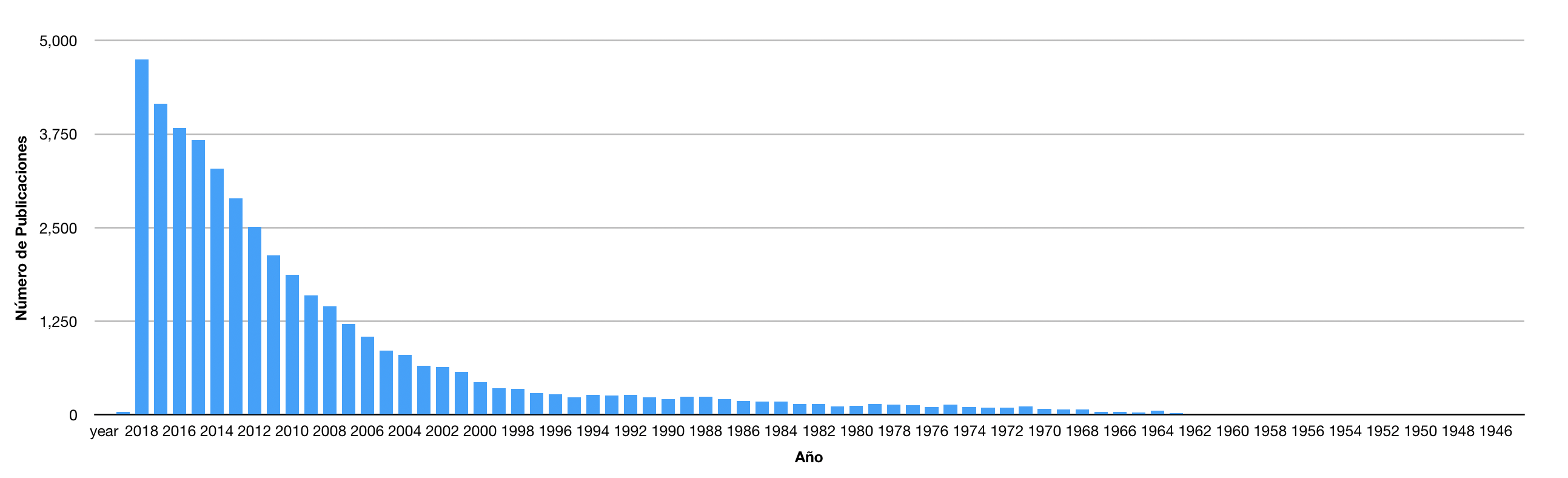
Figura 1. Número de publicaciones sobre autismo a lo largo de los años. Después de la publicación de Kanner en 1943, los trabajos sobre autismo fueron muy bajos, de una a dos publicaciones de 1946 a 1964. Posteriormente el interés sobre el autismo fue incrementando, y se observa que a partir del año 2000 se tiene un crecimiento exponencial del número de publicaciones formales sobre este trastorno. Para 2018 las publicaciones se acercan a las cinco mil, esperando que esto siga creciendo significativamente considerando la relevancia que el autismo está tomando a nivel mundial. Datos obtenidos del sitio PubMed utilizando como búsqueda la palabra “autism”.
3. Diagnóstico
Actualmente se conocen diferentes causas que subyacen la etiología del autismo. Desde alteraciones genéticas hasta insultos ambientales con teratógenos. A pesar de ello y de las diferentes técnicas que existen para determinar un gran número de patologías, aún se carece de una prueba de laboratorio fehaciente que permita identificar el autismo. Esto obliga a que el diagnóstico aún se base exclusivamente en observaciones conductuales. Así, existen a la fecha diferentes instrumentos para el diagnóstico, con el propósito de responder la pregunta ¿este niño/niña manifiesta conductas autistas? La breve respuesta de sí o no es de conclusión complicada, por lo que es indispensable el uso de dos o más instrumentos para evitar un diagnóstico equivocado; el espectro autista es muy amplio y hace que los niños afectados sean distintos entre ellos, por lo que el diagnóstico es un proceso que requiere de mucha precisión. Para ello, además de los instrumentos que se tienen ahora, es indispensable que el personal encargado tenga suficientes conocimientos sobre la metodología para el estudio de la conducta,9 sumada a una visión etológica del TEA.10 A continuación se enlistan algunas de las técnicas de diagnóstico utilizadas.
Lista de Constatación de Autismo en Bebés (CHAT). En general, se sabe que el autismo se detecta cuando el niño tiene una edad entre dos y tres años, pero aún más tarde en un gran número de casos, a pesar de que su etiología puede ser prenatal. A esto se le suma el hecho de que otras alteraciones del desarrollo como el déficit de atención e hiperactividad, alteraciones específicas del lenguaje y otros síndromes de fenotipos conductuales, frecuentemente dificultan y confunden el diagnóstico en sus primeras etapas del desarrollo.11 En consecuencia una de las preocupaciones actuales es diseñar estrategias que permitan un diagnóstico temprano y certero. Para ello, el grupo de Simon Baron-Cohen desarrolló en un principio la Lista de Constatación de Autismo en Bebés (Checklist for Autism in Toddlers o CHAT) con el propósito de identificar a niños en riesgo a la edad de 18 meses.12,13 La metodología utilizada por el CHAT está enfocada en dos atributos del bebé, la atención mutua y el juego imaginativo. La primera se refiere a la capacidad del niño de tener interacciones con otra persona con la mano, la cabeza y los ojos; mientras la segunda se refiere a la habilidad simbólica del niño para otorgarle atributos imaginarios a diferentes objetos, como convertir en avión la cuchara con la que come. Con ello, la lista tiene el propósito de predecir a los niños en riesgo de autismo dependiendo de esas habilidades. Consiste en dos secciones, la Sección A que son 9 preguntas a los padres, y la Sección B que son 5 observaciones conductuales del niño. Posteriormente la lista fue modificada y conocida como M-CHAT,14 y en la actualidad ha tenido una segunda revisión para conocerse como M-CHAT-R, que es de libre acceso en línea y se puede utilizar del sitio de internet de la organización Autism Speaks.
Síntomas de Autismo en Bebés (SAB). Otro acercamiento para el diagnóstico temprano es el conocido como Síntomas de Autismo en Bebés (SAB), que analiza aspectos de socialización, comunicación, juego, percepción y cronobiología.15 Asimismo, se ha propuesto otra lista que analiza la visión y la audición de bebés para predecir el riesgo de autismo, en conjunto con habilidades motoras, sociales y de lenguaje.16
Guía de Observación para el Diagnóstico del Autismo (ADOS). Otro procedimiento de amplio uso para niños de mayor edad es el conocido como Guía de Observación para el Diagnóstico del Autismo (Autism Diagnostic Observation Schedule; ADOS), que es una escala observacional que ayuda a valorar la interacción social, la comunicación y la conducta de juego.17
Entrevista para el Diagnóstico del Autismo (ADI). La guía ADOS se acompaña generalmente de la Entrevista para el Diagnóstico del Autismo (Autism Diagnostic Interview o ADI), que es un instrumento de preguntas para padres y cuidadores de niños aún no diagnosticados.18 Al igual que el CHAT, el ADOS y el ADI han sido objeto de revisiones y actualizaciones a fin de hacerlos cada vez más precisos.
Entrevista Diagnóstica para los Trastornos Sociales y de Comunicación (DISCO). Por otro lado, aunque no es parte de un instrumento de diagnóstico, también existe la Entrevista Diagnóstica para los Trastornos Sociales y de Comunicación (Diagnosis Interview for Social and Communication Disorders o DISCO), que es una guía para valorar las necesidades individuales de cada niño ya diagnosticado y para ubicarlo apropiadamente en el nivel del espectro en el que se encuentra, además de que integra el historial del niño para ayudar a determinar el momento en que se detectaron los primeros síntomas.19
Discusión de los Diagnósticos. En resumen, a pesar de que existen muchas más técnicas que las mencionadas aquí,20,21 cualquiera que sea el procedimiento para el diagnóstico del autismo éste se realiza bajo dos esquemas fundamentales, el análisis observacional de la conducta de los niños, y la entrevista con los familiares y cuidadores. Considerando los límites de estos instrumentos y la falta de técnicas de laboratorio, la habilidad y entrenamiento del personal que diagnostica es fundamental, ya que requieren de una práctica intensiva para el uso confiable de los procesos de registro. Pero más aún, se requiere continuar con la actualización de los instrumentos y con la generación de algunos nuevos. Todo ello en tanto no se descubra algún biomarcador22 que nos permita identificar el autismo en estudios de laboratorio.
4. Comorbilidad
En general se consideran las conductas autistas como aquellas relacionadas con la falta de integración social, alteraciones en el lenguaje y conductas repetitivas. Sin embargo, las técnicas de diagnóstico descritas anteriormente, aunadas a diagnósticos realizados específicamente para el análisis de otras patologías que acompañan a las conductas autistas, permiten identificar una diversidad significativa de alteraciones que pueden presentarse de manera simultánea a las tres principales manifestaciones del autismo (Fig. 2).
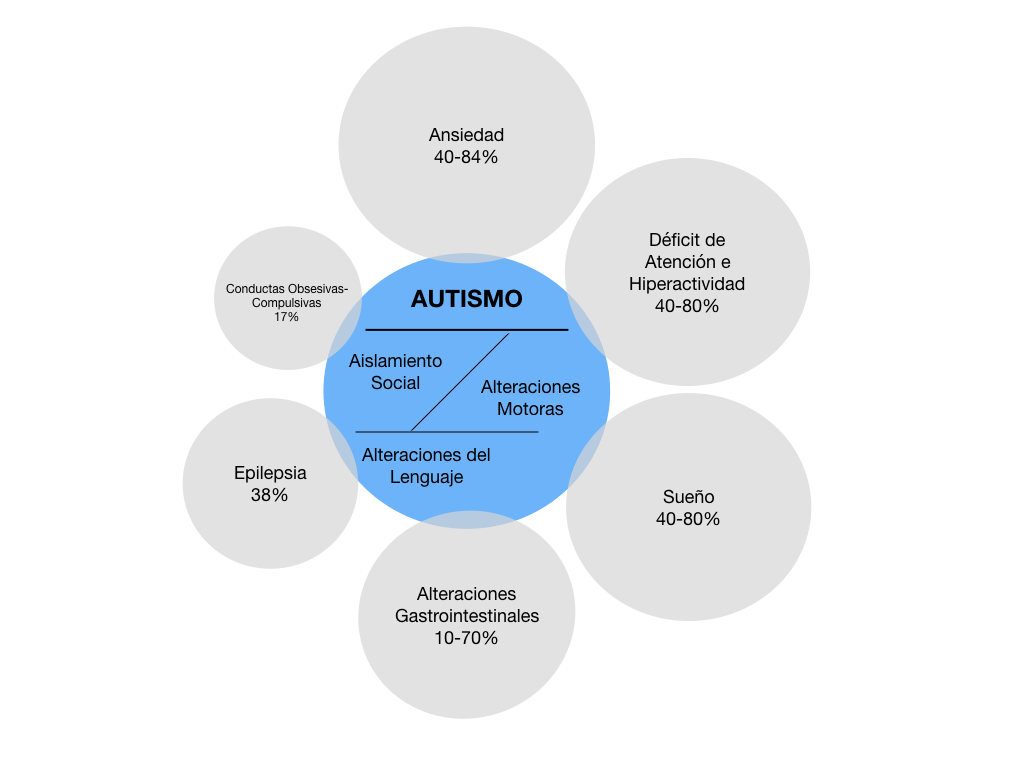
Figura 2. Comorbilidad en el autismo. En adición a las tres manifestaciones conductuales con las que se reconoce el autismo (círculo azul), el trastorno es acompañado por otras alteraciones neurales que se observan en mayor o menor proporción (círculos grises). La ansiedad y el déficit de atención e hiperactividad son los de mayor proporción de comorbilidad, mientras que las conductas obsesivas-compulsivas son las de menor proporción de comorbilidad.
Ansiedad. El miedo y las fobias constantes son una comorbilidad que prevalece de manera global en el 40 a 84% de los casos. En general, la ansiedad en niños con autismo se subdivide en fobias específicas, ansiedad generalizada, ansiedad social y ansiedad por separación.23 Las fobias específicas se refieren a aquellas desencadenadas por una acción particular; por ejemplo, se ha observado que los niños con autismo pueden expresar más temor a una visita médica que a realizar una actividad que los pueda dañar.24 La ansiedad generalizada es aquella que se manifiesta como un estado de preocupación constante, y se presenta principalmente en jóvenes y adultos con autismo.25 La ansiedad social es el miedo de estar en un grupo de personas, acompañado de conductas que impulsan a permanecer aislado. Sin embargo, es una respuesta conductual que necesita ser valorada cuidadosamente, dado que la ansiedad social se presenta también en ausencia de autismo.26 La ansiedad por separación es aquella que se presenta cuando el niño es separado de su madre o persona que le provee de cuidados especiales, con quien ha establecido vínculos afectivos.27
Trastorno de Déficit de Atención e Hiperactividad. El DSM-V3 define que esta situación se clasifica en niños cuando muestran las conductas por más de seis meses. En el déficit de atención el niño no pone atención a las actividades realizadas, llevando a errores en su ejecución; tiene dificultad para mantener una atención constante y no pone atención cuando se le habla directamente; no sigue instrucciones y no termina un trabajo ya iniciado; tiene dificultad en organizar tareas o actividades y no interviene en actividades que demandan un esfuerzo mental; pierde cosas constantemente, se le olvidan las actividades del día y se distrae fácilmente con estímulos externos. La hiperactividad se marca por un impulso exagerado a agitarse, golpear con las manos o pies o retorcerse en una silla; se levanta del asiento cuando no debe y corre o trepa lugares en situaciones inapropiadas; no se está quieto durante el juego y parece siempre querer estar en movimiento; habla excesivamente y responde antes de que se le termine de hacer una pregunta; tiene dificultad para esperar su turno y frecuentemente interrumpe o invade el espacio de otros. Este trastorno se presenta en el 40-80% de niños con autismo, por lo que es de una alta prevalencia. Estas conductas son comunes en el autismo, aunque las conductas autistas no son comunes en niños que solamente tienen este trastorno, por lo que se sugiere cuidado para no colocar erróneamente en esta categoría a un niño con autismo.28
Sueño. Una de las características que sobresale en el desarrollo de niños con autismo es la alteración del proceso fisiológico del sueño, con una prevalencia que va del 40 al 80%.29 Entre los retos que los niños enfrentan son la resistencia para ir a dormir y dificultad para conciliar el sueño, despertar con frecuencia, insomnio, parasomnia, alteraciones de la respiración cuando duermen, dificultad para despertarse en las mañanas y sueño durante el día, entre otras manifestaciones, y hasta el 80% de los niños con autismo sufren diariamente una o más de estas alteraciones.30 El registro de polisomnografía ha mostrado que la fase de sueño MOR se encuentra alterada en su latencia y frecuencia, acompañada de un mayor número de contracciones musculares y una menor atonía muscular.30,31 Las alteraciones del sueño son de diverso origen, aunque la melatonina parece jugar un papel central en el autismo, por lo que su administración exógena produce mejoras en el sueño de estos niños.32,33 Sin embargo, existen numerosos fármacos utilizados para el tratamiento de las alteraciones del sueño en niños con autismo, entre los que se encuentran la clonidina, benzodiacepinas e hidrato de cloral.34
Alteraciones Gastrointestinales. La alimentación es vital, por lo que el aparato digestivo es una de las estructuras más complejas que tenemos en nuestro cuerpo. Las alteraciones comunes en la fisiología digestiva han sido abordadas incesantemente por la ciencia biomédica, para lo que existen un gran número de medicamentos. Sin embargo, las alteraciones gastrointestinales en los niños con autismo, que tienen una prevalencia del 9 al 70%,35 tienen al mismo tiempo impactos severos en su calidad de vida. El impacto emerge de cambios significativos en el microbioma intestinal, que se empieza a considerar como un órgano más,36 compuesto por un complejo de bacterias, hongos, protozoarios y virus que viven en el aparato digestivo de todos los mamíferos37 y que en el humano pueden llegar a pesar 1-2 Kg.36 La modificación en las poblaciones de estos microorganismos intestinales, conocida como disbiosis, produce cambios en el comportamiento parecidos a las conductas autistas, lo que ha sido corroborado en modelos animales.35 A la fecha se sabe que estos cambios de conducta se deben al eje intestino-cerebro, que es una vía de comunicación directa y bidireccional entre el intestino y el cerebro. La mucosa del tracto gastrointestinal contiene a los millones de neuronas que constituyen el sistema nervioso entérico, considerado un segundo cerebro por su complejidad, y que tiene conexión directa con el cerebro para regular las funciones gastrointestinales.37 Cambios en el funcionamiento del sistema nervioso entérico llevan a producir lo que se conoce como intestino permeable, que produce la filtración de productos tóxicos al torrente sanguíneo, modificando el funcionamiento del cerebro lo que se considera una causa que dispara conductas autistas.38 Considerando estas alteraciones, se han iniciado una serie de acercamientos que incluyen tratamientos con antibióticos, modificaciones en la dieta, manejo de enzimas digestivas, entre otras intervenciones, que por el momento han dado efectos benéficos a corto plazo ya que detener el tratamiento hace que el sistema regrese a su estado anterior.>39 Todo ello hace del microbioma un área de nuevas oportunidades para investigaciones sobre el autismo.
Epilepsia. De acuerdo con diversos de estudios, la epilepsia es la alteración que ahora se presenta con más frecuencia en personas con autismo. La prevalencia registrada de epilepsia en niños en general es del 2-3%, pero en niños con autismo es hasta del 38%, lo que implica una alta correlación que sugiere la confluencia en una misma base neural.40,41 Con el propósito de analizar a fondo esta comorbilidad, Turk y colaboradores42 realizaron un análisis de perfiles en dos grupos de niños, con autismo sin epilepsia y con autismo y epilepsia. La proporción de comorbilidad encontrada fue similar en niñas y niños, pero encontraron que ésta se asociaba a una edad mayor de diagnóstico y a una conducta muy reducida de atracción por objetos. Los niños con ambas manifestaciones mostraron una mayor alteración en habilidades motoras, de la vida diaria, en enfrentar retos en espacios públicos y en el contacto visual. En otro estudio similar, se reportó que el grupo de niños con la comorbilidad presenta una alta hiperactividad y, en algunos casos, irritabilidad, además de que mostraban bajo funcionamiento cognitivo.43 Estos estudios indican que la presencia de epilepsia en niños con autismo modifica considerablemente las manifestaciones conductuales, lo que los convierte en un grupo particular de personas dentro del espectro autista, que se sugiere tienen alteraciones neurales muy particulares durante su desarrollo.
Conductas obsesivas-compulsivas. La ejecución del trastorno obsesivo-compulsivo (TOC) se ha clasificado dentro del rango de la ansiedad, aunque algunos autores la identifican ahora como un proceso separado. Se caracteriza por los movimientos corporales repetidos de los niños con autismo y se presenta en el 17% de los casos.44 La obsesión se identifica como el impulso o los pensamientos para ejecutar conductas repetidas, mientras que la compulsión es el acto de realizar dicha actividad repetida. En el autismo estas conductas son las que llevan al ritualismo de hacer siempre lo mismo y de la misma forma.45 Dentro del TOC se ha registrado en algunos casos la tricotilomanía, que es la acción de arrancarse el vello en distintas partes del cuerpo o el pelo de la cabeza como estrategia para reducir la ansiedad, pero que su estudio es aún escaso.46,47
5. Neurobiología
El autismo es un trastorno del desarrollo neural, por lo que una gran cantidad de estudios se centra en analizar la estructura y función de diversas partes del sistema nervioso central. A partir de estos estudios se han identificado múltiples regiones y núcleos que están comprometidos y forman la base neural del autismo.
Circunferencia de la Cabeza y Volumen Cerebral. En diferentes poblaciones se ha mostrado que la circunferencia de la cabeza en niños con autismo presenta macrocefalia entre el 14 y el 34% de los casos, con una proporción similar entre niñas y niños.48 Sin embargo, en niños de ambos sexos que presentan alguna comorbilidad severa, también se detecta microcefalia pero con proporciones aún desconocidas.48 La circunferencia de la cabeza tiende a ser normal en el momento del nacimiento, aunque va cambiando su tamaño en el primer año de vida,49 y los estudios con imágenes de resonancia magnética en niños de dos años muestran que el tamaño de la cabeza refleja el crecimiento de las sustancias gris y blanca del cerebro, en todos los lóbulos cerebrales con excepción del lóbulo occipital.50
A la fecha se tienen estudios que indican que el cerebro autista tiene un crecimiento acelerado en su volumen a partir del primer año de edad, que es seguido en etapas más tardías por una desaceleración que comparativamente hace que el cerebro se vea con un volumen típico hasta la adolescencia,51 y se estima que la desaceleración inicia a partir de los 12 años.52,53 Este proceso de crecimiento acelerado y desaceleración del volumen cerebral en el autismo es una pista significativa sobre los procesos que se están llevando a cabo en este trastorno. A lo largo de la edad, el lóbulo frontal del cerebro es la estructura que presenta el mayor cambio en su volumen tanto en la sustancia gris como blanca.54
Plegamiento de la Corteza Cerebral. Un proceso crucial en el desarrollo cerebral es el plegamiento de la corteza, que genera un patrón específico de surcos y circunvoluciones (Fig. 3). Hay un amplio conocimiento de que la corteza cerebral y su plegamiento son la base para las funciones cognitivas más elaboradas que poseemos y su modificación puede llevar a alteraciones intelectuales severas,55 por lo que la organización de la corteza en el autismo es un tema de análisis constante. A partir de diferentes resultados, se ha determinado que los lóbulos frontal y temporal son los que presentan mayores alteraciones en el plegamiento, lo que pudiera explicar el retraso en los procesos de maduración que permiten la memoria de trabajo, el procesamiento de las emociones, el lenguaje y el ajuste visual.56 Asimismo, el estudio de gemelos monocigóticos también ha mostrado cambios significativos en el plegamiento de la corteza parietal, que es la zona donde se han encontrado el mayor número de neuronas espejo.57,58
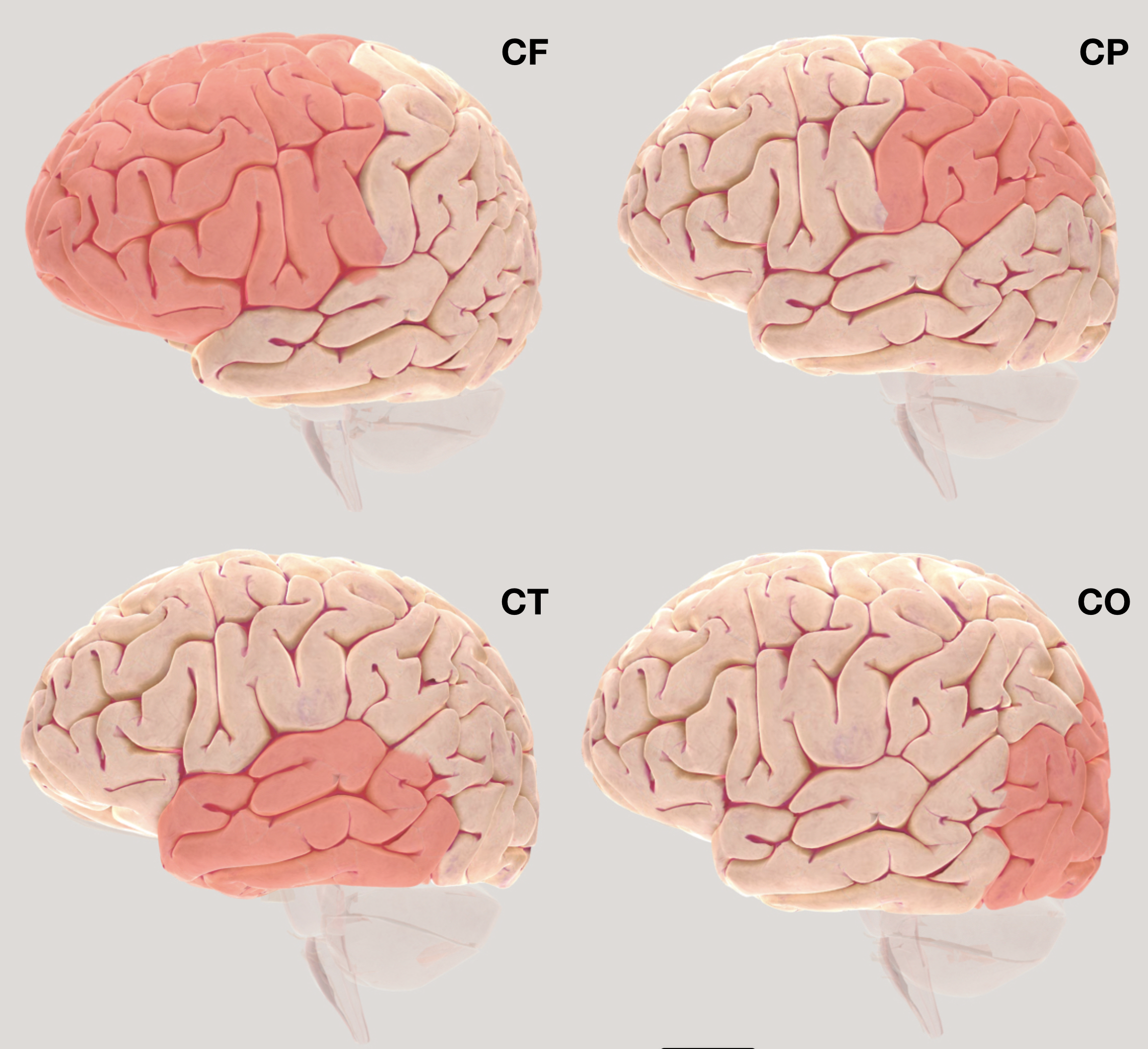
Figura 3. Mapeo de la corteza cerebral. Corteza frontal (CF), Corteza parietal (CP), Corteza temporal (CT) y Corteza occipital (CP). Todas estas regiones presentan alteraciones particulares en el autismo. Imágenes obtenidas del 3D Brain - ã Society for Neuroscience (2017).
Corteza frontal. En un estudio de morfometría de superficie cortical en el cerebro de niños con autismo, se mostró que el plegamiento de la corteza frontal no es el apropiado en sujetos dentro de un amplio rango del espectro, por lo que las alteraciones morfológicas de esta región parecen ser una constante.59 Dado que esta región del cerebro está relacionada con la atención, las interacciones sociales y las emociones, la modificación de su estructura subyace a las alteraciones de este tipo de conductas que son propias del autismo. Sin embargo, no sólo es la organización gruesa del plegamiento la que se encuentra alterada, se ha observado también a nivel de axones que existe un decremento de aquellos que son gruesos y destinados a extenderse por largas distancias, incluyendo un adelgazamiento de la vaina de mielina, lo que indica un decremento en la comunicación entre esta área y el resto del cerebro autista, que puede explicar el aislamiento social y las conductas repetidas.60 Y dentro de la corteza frontal, la región orbitofrontal, relacionada con procesos sociales, cognitivos y afectivos, es un área alterada que se propone incluso como un marcador para identificar el riesgo de desarrollar autismo.61
Corteza temporal. Las alteraciones de la corteza temporal en el autismo se han observado en diferentes situaciones. Un estudio de caso reportó a un joven con desarrollo típico que presentó un tumor temporal que le modificó diferentes aspectos de su conducta, entre los que se encontraron cambios en la interacción social, contactos afectivos y lenguaje; manifestaciones similares a las que se observan en sujetos con autismo. Estos cambios de conducta desaparecieron significativamente después de la remoción del tumor, indicando el papel de esta corteza en el control neural de las conductas.62 Otro estudio realizado en niños con autismo en edades de 1 a 4 años estuvo enfocado a la percepción del lenguaje. Al momento de ir a la cama, a los niños se les leyó un texto al mismo tiempo que se les realizaba una resonancia magnética. Los resultados mostraron que la corteza temporal del hemisferio izquierdo de los niños con autismo tuvo una actividad reducida en comparación con los controles, y que esta falta de respuesta se acentuaba con la edad, lo que puede explicar la falta de comprensión del lenguaje.63 Con esta y otra información relacionada, se ha concluido que una situación remarcada en el autismo es la reducción en la actividad de la corteza temporal izquierda, acompañada de una actividad incrementada de la corteza temporal derecha. Esto ha llevado a plantear la hipótesis de que el uso de la estimulación transcraneal con corriente directa para invertir la actividad temporal izquierda y derecha, podría ser una terapia adecuada para la mejora conductual.64
Corteza parietal. Esta región cortical participa en diversas funciones, pero particularmente en el autismo se observa alterada durante estímulos visuales. Las modificaciones se detectan desde la organización del grosor cortical dado que esta región muestra un adelgazamiento significativo, que se observa también en la corteza temporal, en niños y jóvenes con autismo.65 En adición al grosor, la extensión de la fisura de Silvio también es mayor en el cerebro de niños con autismo.66 Funcionalmente se ha observado que la visualización de situaciones sociales incómodas en jóvenes con autismo produce una actividad baja en la zona de confluencia de las cortezas parietal y temporal, lo que pudiera ser la base de sus dificultades de socialización. 67 También se sabe que la comunicación occipitoparietal alterada evita la localización visual de objetos, así como la ubicación espacial y el control visual de los movimientos.68 Esto ayuda a explicar que las alteraciones en esta corteza provocan el bajo interés de niños autistas en involucrarse en deportes virtuales con objetivos en movimiento.8 En observaciones donde niños con autismo tienen la tarea de detectar la ubicación de objetos, se registra una activación incrementada de la corteza parietal inferior, fundamentalmente en la zona del giro angular, que tiene un papel en la atención y en la reorientación o cambio de atención.69
Corteza occipital. Esta región corresponde a la corteza visual primaria, corteza estriada o área 17 de Brodmann, cuya función principal es el procesamiento de la información visual.70 La visión se divide en dos niveles de percepción, la particular y la global. La particular se refiere a la detección de un objeto en la escena, identificar por ejemplo un vaso en una mesa preparada con utensilios para que varias personas se sienten a comer. La global se refiere a identificar toda la escena, en este ejemplo es percibir toda la mesa puesta. Los niños con autismo muestran una habilidad adecuada para la percepción local, pero muestran una reducción en la percepción global.71 Estas alteraciones parecen estar basada en las modificaciones de los complejos circuitos neurales en las que se organiza esta corteza, que parecen llevar a cambios en los potenciales corticales evocados por estímulos visuales y somatosensoriales.72,73 Estas modificaciones ayudan también a explicar la poca disposición de niños con autismo a participar en juegos virtuales con objetivos en movimiento,8 probablemente por la dificultad para seguir visualmente un objeto desplazándose en una escena global.
Ganglios Basales. Este complejo de diferentes núcleos neuronales en lo profundo del cerebro tiene una ubicación anatómica que lo hace relevante para el control de funciones que van desde el movimiento hasta la cognición (Fig. 4). Se sabe que estos ganglios tienen interconexión recíproca con diferentes áreas de la corteza cerebral y con el cerebelo, lo que genera circuitos cuya alteración lleva a diferentes trastornos de la conducta en las que se cuenta el autismo.74 Para las interconexiones se organiza en núcleos de entrada, núcleos de salida y núcleos intrínsecos.75 Los de entrada son los núcleos caudado, putamen y accumbens que reciben información de la corteza cerebral y el tálamo, y que en conjunto se conocen como el núcleo estriado; los de salida son el globo pálido interno y la sustancia nigra reticulada, que envían información al tálamo; y los intrínsecos que son el globo pálido externo y la sustancia nigra compacta, que median la información de entrada y salida. Las conductas repetitivas y los déficits en la interacción social en el autismo tienen como base la alteración funcional del núcleo estriado.76 El núcleo caudado presenta un volumen incrementado en niños con autismo de 2 a 5 años, con un crecimiento que parece ser sostenido con la edad.77,78 El putamen también se ha observado incrementado en adultos con autismo en edades de 18 a 46 años.79 Y aunque aún falta este tipo de información para el núcleo accumbens, éste no se activa adecuadamente en respuesta a estímulos agradables en jóvenes con autismo de 13 a 23 años.80 El globo pálido presenta una curvatura exagerada,81 y aunque para la sustancia nigra no se tienen datos precisos, se sabe que durante el desarrollo expresa altos niveles del gen Auts2, que está asociado al autismo y al retraso mental.82 En resumen, la alteración de cualquiera de los núcleos que conforman a los ganglios basales parece contribuir de manera significativa a la manifestación del autismo.
Amígdala. El complejo amigdalino se muestra aumentado de tamaño en sujetos con autismo (Fig. 4), lo que es asociado con conductas de ansiedad y alteraciones en el lenguaje.83 En un estudio reciente se observó que varias estructuras cerebrales, que incluyen a la amígdala, presentan alteraciones morfológicas y celulares tanto en cerebros humanos autistas analizados después de la muerte, como en modelos animales.84 Estas alteraciones pueden llevar a las conductas agresivas de sujetos en el espectro, así como alteraciones en el procesamiento de las expresiones faciales; asimismo, las conductas parecidas al autismo, adquiridas por lesión de la amígdala en humanos, ha sugerido que esta estructura es central en el disparo de este trastorno.85 Algunos autores han propuesto a la amígdala como un actor principal, junto con la corteza orbitofrontal y el giro temporal superior, para crear una red neuronal que constituye la base del “cerebro social”. Esto ha llevado a proponer la “Teoría de detección relevante de la amígdala”, considerando su papel en detectar información destacada del medio, que pueda ser amenazante o peligrosa, y responder en consecuencia, por lo que la alteración de su funcionamiento pudiera explicar la dificultad para procesar información relevante en la persona con autismo.85
El núcleo cuya función central es el procesamiento de la memoria, también se encuentra alterado en sujetos con autismo (Fig. 4). Hay autores que indican que el hipocampo puede ser una estructura relevante en estudios de resonancia como biomarcador para el diagnóstico, considerando las modificaciones estructurales que presenta.86 Asimismo, presenta una reducida conectividad con las cortezas frontal y parietal, lo que dificulta las tareas de memoria.87 La alteración de la conectividad frontal también se observa en modelos animales de autismo, donde se detecta una neuroinflamación acompañada de alteraciones de la glía y modificaciones en la transmisión sináptica.88 Dentro del complejo de la glía, los astrocitos del hipocampo parecen ser los más afectados en el modelo de rata autista, con la consecuente alteración de las sinapsis glutamatérgicas.89 La alteración de los receptores glutamatérgicos en ratones knockout, también indica que cambios en esta sola neurotransmisión subyacen a las modificaciones conductuales relacionadas con el autismo.90
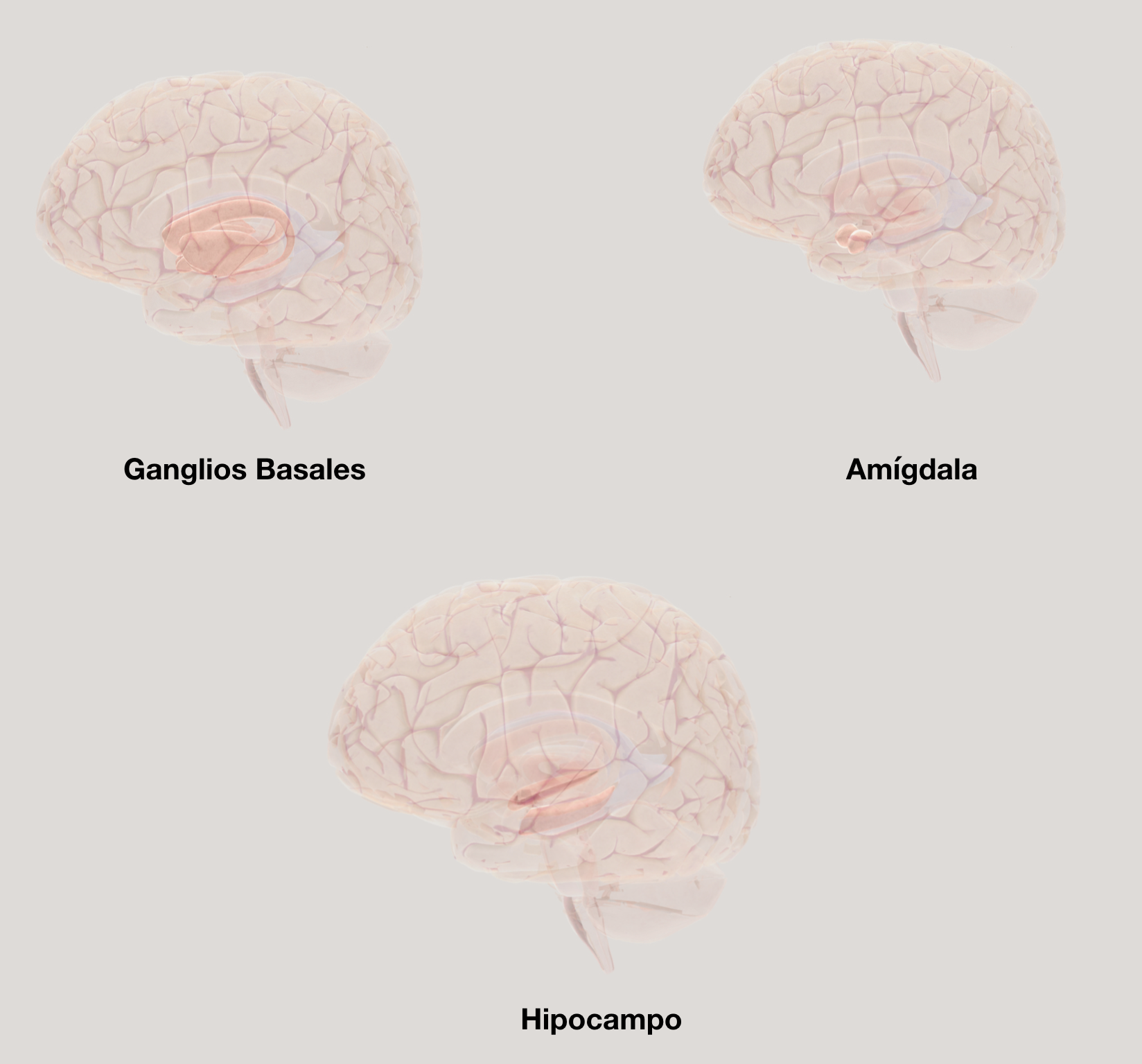
Figura 4. Núcleos cerebrales alterados en el autismo. Las imágenes muestran la ubicación y tamaño relativo de los ganglios basales, amígdala e hipocampo. Imágenes obtenidas del 3D Brain - ã Society for Neuroscience (2017).
Tálamo. Este núcleo es una estructura central entre los grupos neuronales sub-corticales con un papel primordial dentro de los circuitos que modulan las conductas emocionales, el lenguaje y la cognición (Fig. 5). A pesar de su gran tamaño no presenta cambios en sujetos con autismo, aunque la forma de la superficie presenta modificaciones que se acentúan con la edad.91 Sin embargo, los cambios de tamaño del volumen cerebral afectan de manera importante el funcionamiento del tálamo,91 dado que alteran considerablemente la conectividad tálamo-cortical que se observa reducida hacia todos los lóbulos, con excepción de la corteza temporal donde se observa una conectividad aumentada.92 Asimismo, la neuroquímica del núcleo presenta reducciones significativas en su sistema serotonérgico,93 en receptores nicotínicos 94 y en los índices metabólicos de glucosa.95
Hipotálamo. Este centro de integración neuroendocrina también sufre alteraciones en el autismo (Fig. 5). Aunque los estudios en esta estructura son limitados, se ha observado que la densidad de la sustancia gris hipotalámica se encuentra reducida en personas con autismo.96,97 También se ha observado una respuesta aumentada en el eje hipotálamo-pituitaria-adrenal ante estímulos estresantes, que producen muy altos niveles de cortisol sistémico de permanencia prolongada.98 Asimismo, el control de los niveles de oxitocina se encuentra alterado, lo que indica modificaciones funcionales en los núcleos paraventricular y supraóptico.99 En modelos animales de autismo, se ha observado que la administración exógena de oxitocina mejora las conductas sociales, lo que muestra experimentalmente el papel de esta hormona en el desarrollo de conductas autistas.100 Más aún, el sistema dopaminérgico hipotalámico tiene una actividad reducida en un modelo de rata autista,101 que permite explicar las modificaciones en la concentración de prolactina sistémica de niños primordialmente medicados.102,103
El cerebelo es una estructura que muestra una alteración significativa en las personas con autismo (Fig. 5).104 Es uno de los sitios más comunes en el sistema nervioso central que presenta anormalidades, como la hipoplasia en su región posterior y una reducción en el número de neuronas de Purkinje.105,106 Estas anormalidades parecen ser la base de algunos déficits motores, cognitivos y sociales en las personas con autismo, ya que son acompañadas de alteraciones en la conectividad del cerebelo con el circuito tálamo-cortical.106 También el cerebelo es una estructura que presenta alteraciones en la respuesta inmune, como una de las manifestaciones sobresalientes en el autismo.107 A nivel molecular en el cerebelo autista se ha visto que la enzima glutamato descarboxilasa,108 que promueve la formación del neurotransmisor GABA, así como los receptores a andrógenos en la corteza del cerebelo,109 presentan reducciones significativas. Por ello, uno de los hechos más relevantes en la neurobiología del autismo es que el cerebelo es una estructura cuya alteración es visible en la gran mayoría de sujetos en el espectro.
Tallo Cerebral. Una de las principales funciones que se ha visto alterada en esta región es el procesamiento de estímulos auditivos (Fig. 5), lo que se observa desde bebés en edades de 1.5 a 3.5 años,110 y que en modelos animales se ha mostrado que es por una reducción en el tamaño del complejo olivar superior.111 Asimismo, otros estudios han mostrado que existen alteraciones en el núcleo del tracto solitario y en el locus cerúleo.112,113 A pesar de ser una zona para el control de funciones relevantes donde se incluye la respiración, los estudios de esta región en el autismo son aún limitados.
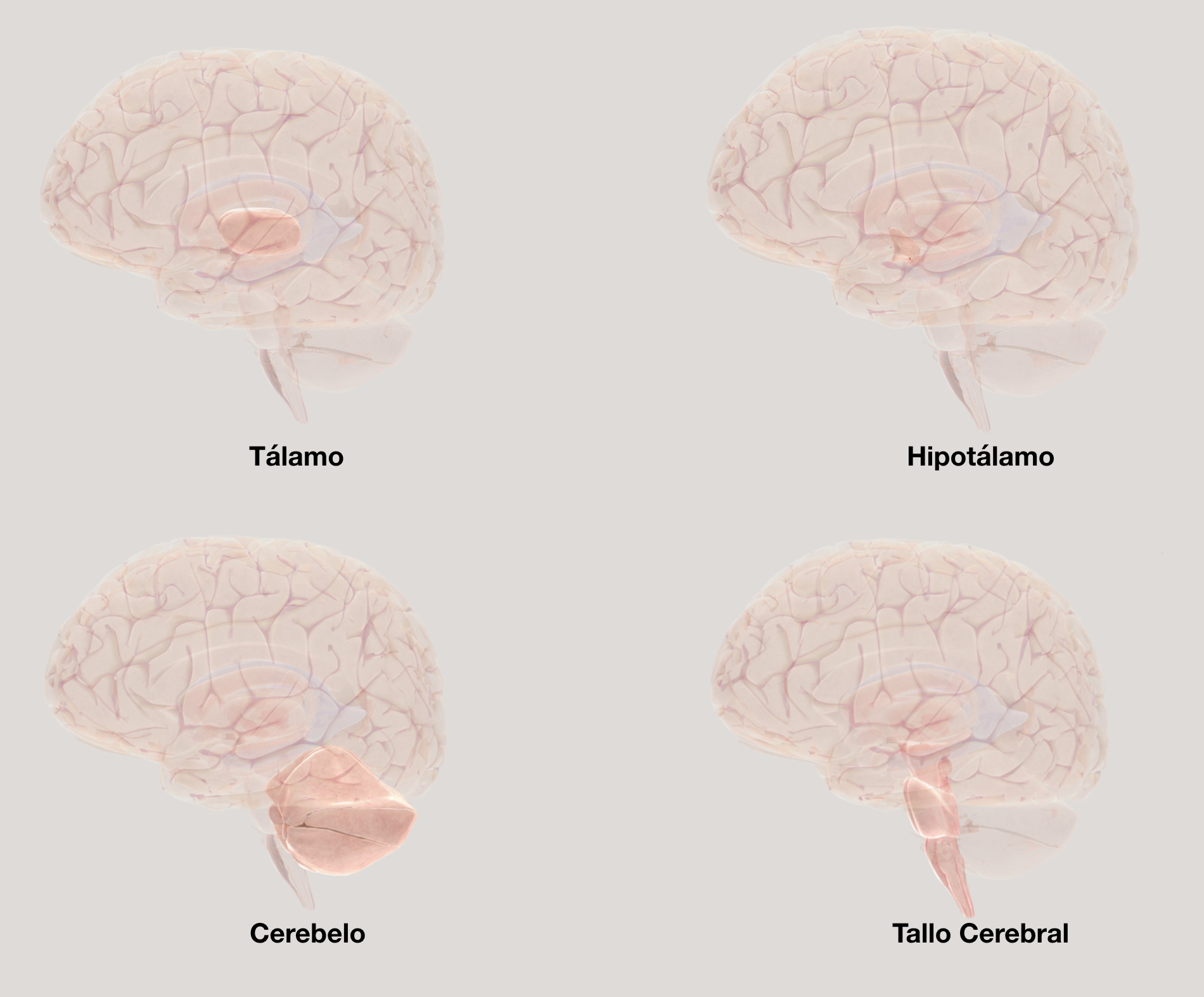
Figura 5. Núcleos y regiones alterados en el autismo. Las imágenes muestran la ubicación y tamaño relativo del tálamo e hipotálamo. También se muestran las dos extensas regiones que son el cerebelo y el tallo cerebral. Imágenes obtenidas del 3D Brain - ã Society for Neuroscience (2017).
Neuronas espejo. En todas las regiones cerebrales anteriormente descritas, las alteraciones histológicas y neuroquímicas se reflejan a nivel neuronal y de la glía. Sin embargo, existe un tipo particular de neurona que requiere de un análisis puntual, que son las conocidas como neuronas espejo. Estas fueron descubiertas a mediados de los 90’s en el área F5 de la corteza premotora de macacos,114 aunque ahora se han detectado en numerosas áreas del sistema nervioso central, que incluyen a todos los lóbulos, al cerebelo, al tálamo y al hipocampo, entre otros.115 Constituyen un grupo particular de neuronas que se activan cuando el sujeto realiza una acción en particular o cuando observa que la acción la ejecuta otro individuo, lo que ahora se sabe ocurre también en humanos.114,115 Estas acciones constituyen la base para la imitación de conducta, y la imitación, a su vez, es una característica indispensable para el desarrollo conductual y que se encuentra alterada en niños con autismo.116,117 Aunque existen ya una gran cantidad de estudios sobre las neuronas espejo, el conocimiento sobre ellas aún es limitado. No obstante, se ha llegado a la conclusión de que son fundamentales para la socialización y el control de emociones. Por ello, la investigación sobre como estimular acciones de imitación son fundamentales para la mejora de la integración social.118 Algo que se ha mostrado con el uso de deportes virtuales.8
Glía. Las células de soporte neuronal dentro del sistema nervioso central son fundamentales para llevar a cabo diferentes funciones. En el autismo, se han observado cambios en las células de la glía que impactan el funcionamiento de algunos grupos de neuronas y, como consecuencia, disparan conductas autistas. En el cerebelo hay un tipo especial de astrocitos conocidos como glía de Bergmann que se encuentra en la capa de Purkinje, con el propósito de modular con sus proyecciones membranales las sinapsis glutamatérgicas que ocurren en la capa molecular.119 Considerando que varias personas con autismo muestran niveles elevados de glutamato sistémico, correlacionado con un aumento de glutamato cerebelar, además de que responden positivamente a antagonistas glutamatérgicos, se propone que la principal alteración del cerebelo autista puede estar disparado en un inicio por alteraciones en la glía de Bergmann.120 Asimismo, se ha observado un incremento en la glía de la corteza olfatoria de personas con o sin comorbilidad de epilepsia,121 aumento en la densidad de la microglía en las cortezas visual, prefrontal y frontoinsular, y en la amígdala, en donde se observa también una reducción de oligodendrocitos.122 La alta densidad de microglía, que además carecen de funcionamiento apropiado, parece ser la base de la falla en la poda neural que caracteriza al cerebro autista.123
Las breves descripciones de cada tema en esta revisión tuvieron el objetivo de poner sobre la mesa las diferentes variables que se deben considerar cuando hablamos de autismo. Sin embargo, no es una lista exhaustiva ya que es necesario tomar en cuenta otras, como la genética, el sistema inmune, las hormonas y el microbioma. Asimismo, considerando que una de las principales manifestaciones del autismo es el aislamiento social, es importante entender todo lo relacionado con las bases neurales que nos ha llevado a organizarnos como sociedad; aquí el reto es mayor, porque obliga a que futuros estudios se centren también en investigar al cerebro social, aquel que permite la integración de los individuos en una sociedad funcional, sea permanente o cambiante para la persona. Sin embargo, entender al autismo aún está en sus inicios, considerando el breve tiempo que la ciencia se ha ocupado de su estudio. Esta revisión destaca la importancia de identificar el espectro ya establecido de conductas en el autismo y su neurobiología, pero también propone que el análisis detallado nos lleva a otros espectros, uno de ellos es el descrito aquí, que va de la conducta a la neurona. Pero existen otros, como el espectro de la edad, esto es, la neurobiología comparativa entre el autismo en la infancia, en la adolescencia y en la adultez, de lo que aún se conoce muy poco.
El autor declara no tener conflictos de interés.
Cuerpo Académico de Neurociencias (UV-CA-28). Doctorado en Investigaciones Cerebrales.
1. Lorenz K. King Solomon’s ring: new light on animal ways. Routledge, London. 2002.
2. Tinbergen N. The study of instinct. Oxford University Press, Oxford. 1951.
3. American Psychiatric Association. Diagnostic and statistical manual of mental disorders (DSM-5®). Am Psych Assoc, Arlington. 2013.
4. Verhoeff B. Autism in flux: a history of the concept from Leo Kanner to DSM-5. Hist Psychiatry 2013 24: 442–458.
5. Kanner L. Autistic disturbances of affective contact. Nerv Child 1943 2: 217–250.
6. Wing L. Asperger’s syndrome: a clinical account. Psychol Med 1981 11: 115–129.
7. Barahona-Corrêa JB, Filipe CN. A concise history of Asperger syndrome: the short reign of a troublesome diagnosis. Front Psychol 2016 6: 2024.
8. Crespo CN, Garcia LI, Coria GA, Carrillo P, Hernandez ME, Manzo J. Mejora de las habilidades motoras y cognitivas de niños con autismo después de un periodo prolongado de juego con deportes virtuales. eNeurobiol 2016 7: 070716.
9. Altmann J. Observational study of behavior: sampling methods. Behaviour 1974 49: 227–266.
10. Pegoraro LFL, Setz EZF, Dalgalarrondo P. Ethological approach to autism spectrum disorders. Evol Psychol 2014 12: 223–244.
11. Coleman M, Gillberg C. The autisms. Oxford University Press, Oxford. 2012.
12. Baron-Cohen S, Wheelwright S, Cox A, Baird G, Charman T, Swettenham J, Drew A, Doehring P. Early identification of autism by the CHecklist for Autism in Toddlers (CHAT). J Roy Soc Med 2000 93: 521–525.
13. Baron-Cohen S, Allen J, Gillberg C. Can autism be detected at 18 months? The needle, the haystack, and the CHAT. Br J Psychiatry 1992 161: 839–843.
14. Robins DL, Fein D, Barton ML, Green JA. The modified checklist for autism in toddlers: an initial study investigating the early detection of autism and pervasive developmental disorders. J Autism Dev Disord 2001 31: 131–144.
15. Dahlgren SO, Gillberg C. Symptoms in the first two years of life. A preliminary population study of infantile autism. Eur Arch Psychiatry Neurol Sci 1989 238: 169–174.
16. Johnson MH, Siddons F, Frith U, Morton J. Can autism be predicted on the basis of infant screening tests? Dev Med Child Neurol 1992 34: 316–320.
17. Lord C, Rutter M, Goode S, Heemsbergen J, Jordan H, Mawhood L, Schopler E. Austism diagnostic observation schedule: a standardized observation of communicative and social behavior. J Autism Dev Disord 1989 19: 185–212.
18. Le Couteur A, Rutter M, Lord C, Rios P, Robertson S, Holdgrafer M, McLennan J. Autism diagnostic interview: a standardized investigator-based instrument. J Autism Dev Disord 1989 19: 363–387.
19. Wing L, Leekam SR, Libby SJ, Gould J, Larcombe M. The diagnostic interview for social and communication disorders: background, inter‐rater reliability and clinical use. J Child Psychol Psychiatry 2002 43: 307–325.
20. Gotham K, Bishop L, Lord C. Diagnosis of autism spectrum disorders. En: Amaral DG, Dawson G, Geschwind D, Autism spectrum disorders. Oxford University Press, New York 2011 30–43.
21. Rutter M, Bailey A, Lord C. Social communication questionnaire. Western Psychological Services 2003.
22. Ruggeri B, Sarkans U, Schumann G, Persico AM. Biomarkers in autism spectrum disorder: the old and the new. Psychopharmacology (Berl) 2013 231: 1201–1216.
23. Sukhodolsky DG, Bloch MH, Panza KE, Reichow B. Cognitive-behavioral therapy for anxiety in children with high-functioning autism: a meta-analysis. Pediatrics 2013 132: e1341-e1350.
24. Evans DW, Canavera K, Kleinpeter. FL, Maccubbin E, Taga K. The fears, phobias and anxieties of children with autism spectrum disorders and Down syndrome: comparisons with developmentally and chronologically age matched children. Child Psychiatry Hum Dev 2005 36: 3–26.
25. Rumsey J, Rapoport J, Sceery W. Autistic children as adults: psychiatric, social, and behavioral outcomes. J Am Acad Child Psychiatry 1985 24: 465–473.
26. Tyson KE, Cruess DG. Differentiating high-functioning autism and social phobia. J Autism Dev Disord 2012 42: 1477–1490.
27. Sigman M, Ungerer JA. Attachment behaviors in autistic children. J Autism Dev Disord 1984 14: 231–244.
28. Mayes SD, Calhoun SL, Mayes RD, Molitoris S. Autism and ADHD: overlapping and discriminating symptoms. Res Autism Spectr Disord 2012 6: 277–285.
29. Cortesi F, Giannotti F, Ivanenko A, Johnson K. Sleep in children with autistic spectrum disorder. Sleep Med 2010 11: 659–664.
30. Devnani PA, Hegde AU. Autism and sleep disorders. J Pediatr Neurosci 2015 10: 304–307.
31. Buckley AW, Rodriguez AJ, Jennison K, Buckley J, Thurm A, Sato S, Swedo S. Rapid eye movement sleep percentage in children with autism compared with children with developmental delay and typical development. Arch Pediatr Adolesc Med 2010 164: 1032–1037.
32. Rossignol DA, Frye RE. Melatonin in autism spectrum disorders. Curr Clin Pharmacol 2014 9: 326–334.
33. Malow B, Adkins KW, McGrew SG, Wang L, Goldman SE, Fawkes D, Burnette C. Melatonin for sleep in children with autism: a controlled trial examining dose, tolerability, and outcomes. J Autism Dev Disord 2012 42: 1729–1737.
34. Porter AE, Glaze DG. Sleep problems. En: Amaral DG, Dawson G, Geschwind D, Autism spectrum disorders. Oxford University Press, New York 2011 431–444.
35. Rosenfeld CS. Microbiome disturbances and autism spectrum disorders. Drug Metab Dispos 2015 43: 1557–1571.
36. Baquero F, Nombela C. The microbiome as a human organ. Clin Microbiol Infect 2012 18: 2–4.
37. Barko PC, McMichael MA, Swanson KS, Williams DA. The gastrointestinal microbiome: a review. J Vet Intern Med 2018 32: 9–25.
38. Li Q, Han Y, Dy ABC, Hagerman RJ. The gut microbiota and autism spectrum disorders. Front Cell Neurosci 2017 11: 120.
39. Buie T. Potential etiologic factors of microbiome disruption in autism. Clin Ther 2015 37: 976–983.
40. Tuchman R, Rapin I. Epilepsy in autism. Lancet Neurol 2002 1: 352–358.
41. Canitano R. Epilepsy in autism spectrum disorders. Eur Child Adolesc Psychiatry 2007 16: 61–66.
42. Turk J, Bax M, Williams C, Amin P, Eriksson M, Gillberg C. Autism spectrum disorder in children with and without epilepsy: impact on social functioning and communication. Acta Paediatr 2009 98: 675–681.
43. Viscidi EW, Johnson AL, Spence SJ, Buka SL, Morrow EM, Triche EW. The association between epilepsy and autism symptoms and maladaptive behaviors in children with autism spectrum disorder. Autism 2014 18: 996–1006.
44. Meier SM, Petersen L, Schendel DE, Mattheisen M, Mortensen PB, Mors O. Obsessive-compulsive disorder and autism spectrum disorders: longitudinal and offspring risk. PLoS One 2015 10: e0141703.
45. Taylor BP, Hollander E. Comorbid obsessive-compulsive disorders. En: Amaral DG, Dawson G, Geschwind D, Autism spectrum disorders. Oxford University Press, New York 2011 270–284.
46. Ghaziuddin M, Tsai LY, Ghaziuddin N. Brief report: haloperidol treatment of trichotillomania in a boy with autism and mental retardation. J. Autism Dev Disord 1991 21: 365–371.
47. Hamdan-Allen G. Brief report: Trichotillomania in an autistic male. J. Autism Dev Disord 1991 21: 79–82.
48. Fombonne E, Rogé B, Claverie J, Courty S, Frémolle J. Microcephaly and macrocephaly in autism. J Autism Dev Disord 1999 29: 113–119.
49. Chawarska K, Campbell D, Chen L, Shic F, Klin A, Chang J. Early generalized overgrowth in boys with autism. Arch Gen Psychiatry 2011 68: 1021–1031.
50. Hazlett HC, Poe M, Gerig G, Smith RG, Provenzale J, Ross A, Gilmore J, Piven J. Magnetic resonance imaging and head circumference study of brain size in autism: birth through age 2 years. Arch Gen Psychiatry 2005 62: 1366–1376.
51. Amaral DG, Schumann CM, Nordahl CW. Neuroanatomy of autism. Trends Neurosci 2008 31: 137–145.
52. Sparks BF, Friedman SD, Shaw DW, Aylward EH, Echelard D, Artru AA, Maravilla KR, Giedd JN, Munson J, Dawson G, Dager SR. Brain structural abnormalities in young children with autism spectrum disorder. Neurology 2002 59: 184–192.
53. Aylward EH, Minshew NJ, Field K, Sparks BF, Singh N. Effects of age on brain volume and head circumference in autism. Neurology 2002 59: 175–183.
54. Carper RA, Moses P, Tigue ZD, Courchesne E. Cerebral lobes in autism: early hyperplasia and abnormal age effects. Neuroimage 2002 16: 1038–1051.
55. Fernández V, Llinares‐Benadero C, Borrell V. Cerebral cortex expansion and folding: what have we learned? EMBO J 2016 35: 1021–1044.
56. Levitt JG, Blanton RE, Smalley S, Thompson PM, Guthrie D, McCracken JT, Sadoun T, Heinichen L, Toga AW. Cortical sulcal maps in autism. Cereb Cortex 2003 13: 728–735.
57. Lacoboni M, Dapretto M. The mirror neuron system and the consequences of its dysfunction. Nat Rev Neurosci 2006 7: 942–951.
58. Kates WR, Ikuta I, Burnette CP. Gyrification patterns in monozygotic twin pairs varying in discordance for autism. Autism Res 2009 2: 267–278.
59. Nordahl CW, Dierker D, Mostafavi I, Schumann CM, Rivera SM, Amaral DG, Van Essen DC. Cortical folding abnormalities in autism revealed by surface-based morphometry. J Neurosci 2007 27: 11725–11735.
60. Zikopoulos B, Barbas H. Changes in prefrontal axons may disrupt the network in autism. J Neurosci 2010 30: 14595–14609.
61. Watanabe H, Nakamura M, Ohno T, Itahashi T, Tanaka E, Ohta H, Yamada T, Kanai C, Iwanami A, Kato N, Hashimoto R. Altered orbitofrontal sulcogyral patterns in adult males with high-functioning autism spectrum disorders. Soc Cogn Affect Neurosci 2014 9: 520–528.
62. Hoon AH, Reiss AL. The mesial‐temporal lobe and autism: case report and review. Dev Med Child Neurol 1992 34: 252–259.
63. Eyler LT, Pierce K, Courchesne E. A failure of left temporal cortex to specialize for language is an early emerging and fundamental property of autism. Brain 2012 135: 949–960.
64. Chi RP, Snyder AW. Treating autism by targeting the temporal lobes. Med Hypotheses 2014 83: 614–618.
65. Wallace GL, Dankner N, Kenworthy L, Giedd JN, Martin A. Age-related temporal and parietal cortical thinning in autism spectrum disorders. Brain 2010 133: 3745–3754.
66. Knaus TA, Tager-Flusberg H, Foundas AL. Sylvian fissure and parietal anatomy in children with autism spectrum disorder. Behav Neurol 2012 25: 327–339.
67. Pantelis PC, Byrge L, Tyszka JM, Adolphs R, Kennedy DP. A specific hypoactivation of right temporo-parietal junction/posterior superior temporal sulcus in response to socially awkward situations in autism. Soc Cogn Affect Neurosci 2015 10: 1348–1356.
68. Mishkin M, Ungerleider LG, Macko KA. Object vision and spatial vision: two cortical pathways. Trends Neurosci 1983 6: 414–417.
69. DeRamus TP, Black BS, Pennick MR, Kana RK. Enhanced parietal cortex activation during location detection in children with autism. J Neurodev Disord 2014 6: 37.
70. Tootell RBH, Hadjikhani NK, Vanduffel W, Liu AK, Mendola JD, Sereno MI, Dale AM. Functional analysis of primary visual cortex (V1) in humans. Proc Natl Acad Sci 1998 95: 811–817.
71. Rinehart NJ, Bradshaw JL, Moss SA, Brereton A V, Tonge BJ. Atypical interference of local detail on global processing in high‐functioning autism and Asperger’s disorder. J Child Psychol Psychiatry 2000 41: 769–778.
72. Robertson CE, Thomas C, Kravitz DJ, Wallace GL, Baron-Cohen S, Martin A, Baker CI. Global motion perception deficits in autism are reflected as early as primary visual cortex. Brain 2014 137: 2588–2599.
73. Kemner C, Verbaten MN, Cuperus JM, Camfferman G, Engeland VH. Visual and somatosensory event-related brain potentials in autistic children and three different control groups. Electroencephalogr Clin Neurophysiol Potentials Sect 1994 92: 225–237.
74. Leisman G, Melillo R. The basal ganglia: motor and cognitive relationships in a clinical neurobehavioral context. Rev Neurosci 2013 24: 9–25.
75. Lanciego JL, Luquin N, Obeso JA. Functional neuroanatomy of the basal ganglia. Cold Spring Harb Perspect Med. 2012 2: a009621.
76. Santini E, Huynh TN, MacAskill AF, Carter AG, Pierre P, Ruggero D, Kaphzan H, Klann E. Exaggerated translation causes synaptic and behavioural aberrations associated with autism. Nature 2012 493: 411–415.
77. Qiu T, Chang C, Li Y, Qian L, Xiao CY, Xiao T, Xiao X, Xiao YH, Chu KK, Lewis MH, Ke X. Two years changes in the development of caudate nucleus are involved in restricted repetitive behaviors in 2–5-year-old children with autism spectrum disorder. Dev Cogn Neurosci 2016 19: 137–143.
78. Langen M, Durston S, Staal WG, Palmen SJMC, Engeland VH. Caudate nucleus is enlarged in high-functioning medication-naive subjects with autism. Biol Psychiatry 2007 62: 262–266.
79. Sato W, Kubota Y, Kochiyama T, Uono S, Yoshimura S, Sawada R, Sakihama M, Tpichi M. Increased putamen volume in adults with autism spectrum disorder. Front Hum Neurosci 2014 8: 957.
80. Shafritz KM, Bregman JD, Ikuta T, Szeszko PR. Neural systems mediating decision-making and response inhibition for social and nonsocial stimuli in autism. Prog Neuro-Psychopharmacology Biol Psychiatry 2015 60: 112–120.
81. Schuetze M, Park MTM, Cho IYK, MacMaster FP, Chakravarty MM, Bray SL. Morphological alterations in the thalamus, striatum, and pallidum in autism spectrum disorder. Neuropsychopharmacol 2016 41: 2627.
82. Bedogni F, Hodge RD, Nelson BR, Frederick EA, Shiba N, Daza RA, Hevner RF. Autism susceptibility candidate 2 (Auts2) encodes a nuclear protein expressed in developing brain regions implicated in autism neuropathology. Gene Expr Patterns 2010 10: 9–15.
83. Park HR, Lee JM, Moon HE, Lee DS, Kim B-N, Kim J, Kim DG, Paek SH. A short review on the current understanding of autism spectrum disorders. Exp Neurobiol 2016 25: 1–13.
84. Varghese M, Keshav N, Jacot-Descombes S, Warda T, Wicinski B, Dickstein DL, Harony-Nicolas H, De Rubies S, Drapeau E, Buxbaum JD, Hof PR. Autism spectrum disorder: neuropathology and animal models. Acta Neuropathol 2017 134: 537–566.
85. Zalla T, Sperduti M. The amygdala and the relevance detection theory of autism: an evolutionary perspective. Front Hum Neurosci 2013 7: 894.
86. Chaddad A, Desrosiers C, Hassan L, Tanougast C. Hippocampus and amygdala radiomic biomarkers for the study of autism spectrum disorder. BMC Neurosci 2017 18: 52.
87. Cooper RA, Richter FR, Bays PM, Plaisted-Grant KC, Baron-Cohen S, Simons JS. Reduced hippocampal functional connectivity during episodic memory retrieval in autism. Cereb Cortex 2017 27: 888–902.
88. Codagnone MG, Podestá MF, Uccelli NA, Reinés A. Differential local connectivity and neuroinflammation profiles in the medial prefrontal cortex and hippocampus in the valproic acid rat model of autism. Dev Neurosci 2015 37: 215–231.
89. Silvestrin RB, Bambini-Junior V, Galland F, Bobermim LD, Santos AQ, Abib RT, Zanotto C, Batassini C, Brolese G, Goncalves CA, Riesgo R, Gottfried C. Animal model of autism induced by prenatal exposure to valproate: altered glutamate metabolism in the hippocampus. Brain Res 2013 1495: 52–60.
90. Micheau J, Vimeney A, Normand E, Mulle C, Riedel G. Impaired hippocampus‐dependent spatial flexibility and sociability represent autism‐like phenotypes in GluK2 mice. Hippocampus 2014 24: 1059–1069.
91. Hardan AY, Girgis RR, Adams J, Gilbert AR, Keshavan MS, Minshew NJ. Abnormal brain size effect on the thalamus in autism. Psychiatry Res Neuroimaging 2006 147: 145–151.
92. Nair A, Treiber JM, Shukla DK, Shih P, Müller R-A. Impaired thalamocortical connectivity in autism spectrum disorder: a study of functional and anatomical connectivity. Brain 2013 136: 1942–1955.
93. Beversdorf DQ, Nordgren RE, Bonab AA, Fischman AJ, Weise SB, Dougherty DD, Felopulos GJ, Zhou FC, Bauman ML. 5-HT2 receptor distribution shown by [18F] setoperone PET in high-functioning autistic adults. J Neuropsychiatry Clin Neurosci 2012 24: 191–197.
94. Ray MA, Graham AJ, Lee M, Perry RH, Court JA, Perry EK. Neuronal nicotinic acetylcholine receptor subunits in autism: an immunohistochemical investigation in the thalamus. Neurobiol Dis 2005 19: 366–377.
95. Haznedar MM, Buchsbaum MS, Hazlett EA, LiCalzi EM, Cartwright C, Hollander E. Volumetric analysis and three-dimensional glucose metabolic mapping of the striatum and thalamus in patients with autism spectrum disorders. Am J Psychiatry 2006 163: 1252–1263.
96. Wolfe FH, Auzias G, Deruelle C, Chaminade T. Focal atrophy of the hypothalamus associated with third ventricle enlargement in autism spectrum disorder. Neuroreport 2015 26: 1017.
97. Kurth F, Narr KL, Woods RP, O’Neill J, Alger JR, Caplan R, McCracken JT, Toga AW, Levitt JG. Diminished gray matter within the hypothalamus in autism disorder: a potential link to hormonal effects? Biol Psychiatry 2011 70: 278–282.
98. Spratt EG, Nicholas JS, Brady KT, Carpenter LA, Hatcher CR, Meekins KA, Furlanetto RW, Charles JM. Enhanced cortisol response to stress in children in autism. J Autism Dev Disord 2012 42: 75–81.
99. Romano A, Tempesta B, Bonaventura MVM Di, Gaetani S. From autism to eating disorders and more: the role of oxytocin in neuropsychiatric disorders. Front Neurosci 2016 9: 497.
100. Peñagarikano O, Lázaro MT, Lu X-H, Gordon A, Dong H, Lam HA, Peles E, Maidment NT, Murphy NP, Yang XW, Golshani P, Geschwind DH. Exogenous and evoked oxytocin restores social behavior in the Cntnap2 mouse model of autism. Sci Transl Med 2015 7: 271ra8.
101. Kirsten TB, Bernardi MM. Prenatal lipopolysaccharide induces hypothalamic dopaminergic hypoactivity and autistic-like behaviors: Repetitive self-grooming and stereotypies. Behav Brain Res. 2017 331: 25–29.
102. Anderson GM, Scahill L, McCracken JT, McDougle CJ, Aman MG, Tierney E, Arnold LE, Martin A, Katsovich L, Posey DJ, Shah B, Vitiello B. Effects of short- and long-term risperidone treatment on prolactin levels in children with autism. Biol Psychiatry 2007 61: 545–550.
103. Hernández ME, del Mar Hernández M, Díaz-Muñoz M, Clapp C, Martinez de la Escalera G. Potentiation of Prolactin Secretion following Lactotrope Escape from Dopamine Action. Neuroendocrinology 1999 70: 31–42.
104. Courchesne E. Brainstem, cerebellar and limbic neuroanatomical abnormalities in autism. Curr Opin Neurobiol 1997 7: 269–278.
105. Courchesne E, Yeung-Courchesne R, Press GA, Hesselink JR, Jernigan TL. Hypoplasia of cerebellar vermal lobules VI and VII in autism. N Engl J Med 1988 318: 1349–1354.
106. Belmonte MK, Allen G, Beckel-Mitchener A, Boulanger LM, Carper RA, Webb SJ. Autism and abnormal development of brain connectivity. J Neurosci 2004 24: 9228–9231.
107. Fatemi SH, Aldinger KA, Ashwood P, Bauman ML, Blaha CD, Blatt GJ, Chauhan A, Chauhan V, Dager SR, Dickson PE, Estes AM, Goldowitz D, Heck DH, Kemper TL, King BH, Martin LA, Millen KJ, Mittleman G, Mosconi MW, Persico AM, Sweeney JA, Webb SJ, Welsh JP. Consensus paper: pathological role of the cerebellum in autism. Cerebellum 2012 11: 777–807.
108. Yip J, Soghomonian J-J, Blatt GJ. Decreased GAD67 mRNA levels in cerebellar Purkinje cells in autism: pathophysiological implications. Acta Neuropathol 2007 113: 559–568.
109. Perez-Pouchoulen M, Toledo R, Garcia LI, Perez-Estudillo CA, Coria-Avila GA, Hernandez ME, Carrillo P, Manzo J. Androgen receptors in Purkinje neurons are modulated by systemic testosterone and sexual training in a region-specific manner in the male rat. Physiol Behav 2016 156: 191–198.
110. Miron O, Roth DA, Gabis L V, Henkin Y, Shefer S, Dinstein I, Geva R. Prolonged auditory brainstem responses in infants with autism. Autism Res 2016 9: 689–695.
112. McGinnis WR, Audhya T, Edelson SM. Proposed toxic and hypoxic impairment of a brainstem locus in autism. Int J Environ Res Public Health 2013 10: 6955–7000.
113. Pamphlett R, Jew SK. Locus ceruleus neurons in people with autism contain no histochemically-detectable mercury. Biometals 2016 29: 171–175.
114. Rizzolatti G, Fadiga L, Gallese V, Fogassi L. Premotor cortex and the recognition of motor actions. Cogn Brain Res 1996 3: 131–141.
115. Rizzolatti G, Craighero L. The mirror-neuron system. Annu Rev Neurosci 2004 27: 169–192.
116. Saffin J, Tohid H. Walk like me, talk like me. The connection between mirror neurons and autism spectrum disorder. Neurosciences 2016 21: 108–119.
117. Williams JHG, Whiten A, Suddendorf T, Perrett DI. Imitation, mirror neurons and autism. Neurosci Biobehav Rev 2001 25: 287–295.
118. Perkins T, Stokes M, McGillivray J, Bittar R. Mirror neuron dysfunction in autism spectrum disorders. J Clin Neurosci 2010 17: 1239–1243.
119. Bellamy TC. Interactions between Purkinje neurones and Bergmann glia. Cerebellum 2006 5: 116–126.
120. Chrobak AA, Soltys Z. Bergmann glia, long-term depression, and autism spectrum disorder. Mol Neurobiol 2017 54: 1156–1166.
121. Menassa DA, Sloan C, Chance SA. Primary olfactory cortex in autism and epilepsy: increased glial cells in autism. Brain Pathol 2017 27: 437–448.
122. Takano T. Role of microglia in autism: recent advances. Dev Neurosci 2015 37: 195–202.
123. Koyama R, Ikegaya Y. Microglia in the pathogenesis of autism spectrum disorders. Neurosci Res 2015 100: 1–5.
| Recibido: 08 de diciembre de 2018 | Aceptado: 15 de enero de 2019 |
Manzo-Denes Jorge. Av. Médicos y Odontólogos s/n, Unidad del Bosque, Xalapa, Veracruz, México. C.P. 91010, Tel: 52 (228) 8 418900 ext. 16309. Correo electrónico: jmanzo@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
