La prolactina promueve migración en las células de cáncer de próstata LNCaP
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Rojas-Durán Fausto1*, Herrera-Ortega Leobardo2, Aranda-Abreu Gonzalo E1, Herrera-Covarrubias Deissy1, Suárez-Medellin Jorge M1, Lara-Reyes Jesús A3, Jiménez-Buendía Mariana G3, Manzo-Denes Jorge1, Hernández-Aguilar María E1
1Centro de Investigaciones Cerebrales, Universidad Veracruzana, Xalapa, Ver. México. 2Facultad de Bioanálisis, Universidad Veracruzana, Xalapa, Ver. México. 3Doctorado en Investigaciones Cerebrales, Universidad Veracruzana, Xalapa, Ver. México.
Resumen/Abstract
Introducción
Material y métodos
Resultados
Discusión
Conclusión
Agradecimientos
Referencias
Correspondencia
Introducción: La prolactina (PRL) es una hormona que participa en el desarrollo normal de la próstata, pero también en el desarrollo de patologías como el cáncer. El principal problema del cáncer de próstata es su capacidad de producir metástasis. Durante la metástasis las células anormales exhiben mayor migración celular comparado con las células normales; por lo tanto, el aumento de la migración celular es el principal mecanismo para que las células cancerígenas hagan metástasis durante el desarrollo del cáncer. Existe poca información acerca de la participación de la PRL en la migración celular, en especial en el cáncer de próstata. Por lo anterior, se evaluó el efecto de la PRL en la migración celular utilizando como modelo de estudio a las células LNCaP. Objetivo: Evaluar si la PRL induce migración en las células LNCaP. Materiales y Métodos: Utilizamos la técnica de “raspado y cicatrización de herida” para evaluar la migración celular. Se cultivaron células LNCaP en placas de 12 pozos hasta confluencia total, se hizo un rasguño a lo largo del eje de cada pozo y posteriormente fueron estimuladas con 0, 5, 10, 25, 50 100, 150 y 200 nM de PRL. La migración de las células dentro del rasguño fue fotografiada a las 48 h. Resultados: La PRL indujo migración en las células LNCaP. Conclusiones: La PRL indujo migración en las células LNCaP, por lo que esta hormona podría tener alguna participación en la metástasis.
Palabras clave: PRL, Cáncer de próstata, Migración celular, Metástasis.
Introduction: Prolactin (PRL) is a hormone that participates in the normal development of the prostate but also in the development of pathologies such as cancer. The main problem with prostate cancer is its ability to produce metastasis. During metastasis, abnormal cells exhibit increased cell migration compared to normal cells; therefore, increased cell migration is the main mechanism for cancer cells to become metastasized during cancer development. There is little information about the involvement of PRL in cell migration, especially in prostate cancer. Therefore, the effect of PRL on cell migration was evaluated using LNCaP cells as the study model. Objective: To evaluate whether PRL induce migration in LNCaP cells. Materials and methods: We used the "scratch/wound healing" technique to evaluate cell migration. LNCaP cells were grown in 12-well plates to full confluence, a scratch was made along the axis of each well and were subsequently stimulated with 0, 5, 10, 25, 50, 100, 150 and 200 nM PRL. Migration of the cells within the scratch was photographed at 48 h. Results: PRL induced migration in LNCaP cells. Conclusions: PRL induced migration in LNCaP cells, so this hormone could have some involvement in metastasis.
Keywords: PRL, Prostate cancer, Cell migration, Metastasis.
La PRL es una hormona proteica sintetizada en los lactotropos de la adenohipófisis y cuya producción es controlada por la dopamina.1
La dopamina es una molécula pequeña que cumple diversas funciones, por ejemplo, la regulación de la liberación de PRL al torrente sanguíneo. La secreción constante de dopamina por parte de las neuronas tuberoinfundibulares, tuberohipofisiales y periventriculares inhibe la liberación de PRL en los lactotropos. Para que la PRL sea liberada estas neuronas dopaminérgicas deben reducir la liberación de dopamina. Así, los lactotropos incrementan la liberación de PRL al torrente sanguíneo y la PRL a su vez activa un circuito de retroalimentación negativa que estimula a las neuronas dopaminérgicas del hipotálamo para que vuelvan a liberar dopamina, y por lo tanto detener la liberación de PRL.2 Cabe destacar que la liberación de PRL en el humano es pulsátil, con aumentos o picos secretorios durante la etapa de sueño. De esta forma la PRL regula varias funciones incluyendo las que llevan a cabo glándulas implicadas en la reproducción, como la próstata.3 En la próstata la PRL es esencial para llevar a cabo el desarrollo y crecimiento de esta glándula,4 llevando a cabo funciones como aumento en la síntesis de citrato, acumulación de zinc, síntesis de catepsina D, incremento en la expresión del IGF-1 (y su receptor) y del receptor a andrógenos, además de otras proteínas.3,5 También la PRL participa en la proliferación y diferenciación de la próstata.6 Mediante el uso de cultivos de órganos y líneas celulares de próstata se mostró que la PRL es capaz de inducir diferenciación y proliferación, tanto en la próstata de rata como en la del humano, así como estimular la secreción e incrementar la supervivencia del epitelio prostático.7,8 Al respecto, las acciones de la PRL son mediadas a través del receptor a PRL (PRLR) corto y largo, presentes en un gran número de tejidos (incluyendo la próstata),9desencadenando la activación de vías de transducción de señales.8 La PRL no solo participa en el desarrollo normal de la próstata sino también en el desarrollo y regulación de la hiperplasia prostática benigna (BPH) y el cáncer de próstata.3,8 Así, la PRL producida autócrina y/o parácrinamente puede contribuir al desarrollo de la patogénesis del cáncer de próstata.7,10 Se ha observado en ratones que la expresión transgénica de PRL en la próstata induce hiperplasia (aumento del número de células) y displasia (desarrollo anormal de las células), que puede progresar a una neoplasia (crecimiento anormal de un tejido nuevo, benigno o maligno) intraepitelial e incluso a un adenocarcinoma,5,10 con aumento del número de células basales/stem las cuales han sido recientemente identificadas como células iniciadoras del cáncer de próstata.5 En la clínica, la expresión de PRL y la activación del transductor de señal y activador de la transcripción 5 (Stat5), en tumores de próstata humana, están correlacionados con tumores de alto grado (o pobremente diferenciados) y con enfermedades más agresivas.5,10 También se ha propuesto que la PRL autócrina, a través de la vía de señalización Jak2/Stat5a/b, promueve el crecimiento del cáncer de próstata.11 Además se han observado mayores niveles séricos de PRL en algunos hombres con cáncer de próstata.3 Si bien no se sabe aún si la PRL promueve el desarrollo de cáncer de próstata o si el cáncer de próstata incrementa los niveles de PRL, lo que sí es claro es que si se induce un incremento en los niveles séricos de PRL la probabilidad de que se desarrolle una patología prostática se incrementa significativamente, por lo que la PRL es considerada como un factor de riesgo en la etiología de las patologías prostáticas.3 A pesar de estas evidencias, aun es desconocido cómo es que la PRL puede estar desencadenando todas estas acciones, pero es sabido que la PRL junto con la testosterona hacen algo al respecto.3 De hecho, se sabe que la PRL promueve el crecimiento y proliferación de las células prostáticas en sinergismo con la testosterona y dihidrotestosterona y se ha propuesto que la PRL puede incrementar la concentración de testosterona libre en la sangre así como la absorción de esta hormona en las células prostáticas,8 lo cual podría favorecer el desarrollo del cáncer de próstata.
Si bien la participación de la PRL en algunos aspectos del desarrollo del cáncer de próstata parece ser evidente, no se sabe si esta hormona tiene alguna participación en la metástasis, la principal problemática en la lucha contra el cáncer.
La metástasis es la principal causa de mortalidad en los pacientes que sufren algún tipo cáncer avanzado.12 Durante la metástasis, las células anormales con heterogeneidad genómica sufren una transición epitelio-mesenquimal (EMT) y fenotípicamente exhiben un aumento de la migración e invasión en comparación con las células normales; por lo tanto, el aumento de la migración celular es el principal mecanismo por el cual las células cancerígenas invaden y hacen metástasis durante el desarrollo del cáncer.12 La migración celular es un evento crucial para llevar a cabo numerosos procesos fisiológicos y de desarrollo como por ejemplo la gastrulación, formación de órganos, función inmune y la cicatrización de heridas. Por el contrario, una migración celular aberrante contribuye al desarrollo de enfermedades como la metástasis.13 Por lo tanto, conocer los mecanismos que controlan el movimiento de las células hacia órganos distantes es una de las principales metas en la investigación contra el cáncer.14
La participación de la PRL en los procesos metastásicos es prácticamente desconocida. Existe poca información al respecto y no existe información con relación al cáncer de próstata. Sin embargo, la información existente deja de manifiesto su participación en los procesos metastásicos. Por ejemplo, cuando la línea celular de trofoblastos HTR-8/SVneo fue estimulada por 24 h con 100 ng/ml de PRL la migración de estas células fue significativamente incrementada en un 125%, y en un 138% cuando fueron estimuladas con 1000 ng/ml de PRL, respecto a las células control que no fueron estimuladas con la hormona.15 Además, el incremento de la migración celular llevado a cabo por la PRL fue bloqueado cuando las células HTR-8/SVneo fueron estimuladas con 10 mg/ml del anticuerpo de ratón dirigido contra el PRLR (anti-PRLR IgG), el cual se sabe tiene una actividad de neutralización del receptor.15 De esta forma se confirmó que el efecto positivo de la PRL sobre la migración celular fue llevado a cabo a través del PRLR.15 También en células de cáncer de ovario se ha evaluado la participación de la PRL sobre la migración celular. Cuando las células TOV112D fueron estimuladas con 500 ng/ml de PRL por 16 h se observó un incremento significativo del 30% en la migración de estas células con respecto a aquellas células que no fueron estimuladas con la hormona.16 En otros experimentos, mediante una técnica de raspado con navaja de afeitar, se mostró que cuando las líneas celulares de cáncer de mama T47D, ZR75-1 y MCF-7 fueron estimulas por 48 h con PRL (50 y 100 ng/ml) se observó un incremento significativo de la migración celular en las tres líneas celulares. No hubo diferencias significativas entre ambas concentraciones empleadas. Además, la PRL llevó a cabo estos efectos a través del PRLR. En un experimento separado las células T47D, ZR75-1 y MCF-7 fueron previamente transfectadas con un RNA pequeño de interferencia anti-hPRLR (anti-hPRLRsiRNA) lo cual resultó en un silenciamiento efectivo de la expresión del PRLR. Posteriormente cuando las diferentes líneas celulares de cáncer de mama fueron estimuladas con PRL (bajo las mismas condiciones mencionadas anteriormente) no se observó ningún aumento en la migración celular.17
Si bien la PRL participa en la migración celular de diferentes líneas celulares, su participación en la migración en el cáncer de próstata es desconocida. A este respecto, nuestra hipótesis de investigación postula que la PRL promueve migración en la línea celular de cáncer de próstata humano LNCaP (nuestro modelo de estudio). Por lo anterior, el propósito de este estudio fue evaluar si la PRL induce migración en las células LNCaP.
2.1 Cultivo de la línea celular LNCaP
La línea celular de cáncer de próstata humano LNCaP fue amablemente proporcionada por la doctora Elizabeth Langley-McCarron del Instituto Nacional de Cancerología. Las células fueron rutinariamente cultivadas en cajas Petri estériles de 90 × 20 mm (área de crecimiento de ~46 cm2; Sarstedt) y utilizando medio de cultivo RPMI-1640 (Sigma-Aldrich), complementado con 8% (v/v) de FBS inactivado (Gibco) y 1% (v/v) de penicilina/estreptomicina (Sigma-Aldrich). Las células fueron incubadas en una incubadora (Nuaire) mantenida a 37ºC y con una atmósfera de 5% de CO2 y 95% de aire. El medio de cultivo de las células se cambió cada tercer día. Cuando las células alcanzaron una confluencia de ~80% fueron utilizadas para llevar a cabo los experimentos de migración celular.
2.2 Ensayos de migración celular
La migración celular fue llevada a cabo utilizando la técnica de “raspado y cicatrización de herida”, de acuerdo al protocolo llevado a cabo por Stefanoska y colaboradores en 2013, con algunas modificaciones.15 En breve, células LNCaP fueron sembradas con medio RPMI-1640 complementado (Sigma-Aldrich), a una densidad de 31,250 células/cm2, en placas de 12 pozos (área de crecimiento de 3.2 cm2; Sarstedt) previamente tratadas por 2 h con 500 ml de una solución de Poli-L-lisina (15 mg/ml; Sigma), y se incubaron a 37ºC en una atmosfera de 5% de CO2 y 95% de aire. Cuando las células alcanzaron ~100% de confluencia se les retiró el medio de cultivo y se incubaron por 24 h con medio RPMI-1640 sin suero. Posteriormente, con la ayuda de una punta de pipeta de 200 ml se hizo un raspado a lo largo de la monocapa de células en cada uno de los pozos. Las células se lavaron dos veces con PBS (Sigma) para eliminar las células desprendidas y medio RPMI-1640 complementado con 5% de FBS (Gibco), sin o con PRL ovina (stock 100 mM; Sigma-Aldrich) a concentraciones de 0, 5, 10, 25, 50, 100, 150 y 200 nM, fue adicionado. Las células se cultivaron en condiciones normales. La migración de las células dentro de la herida fue fotografiada a las 48 h con la ayuda de una cámara digital (Nikon D3200) y con un microscopio invertido (Zeigen XD-1012B) utilizando el objetivo de 10x. La cuantificación del área restante de la herida, es decir el área de la herida que no ha sido cubierta por las células que están migrando, fue medida utilizando el software ImageJ para MacOS versión 1.50i.
3. Análisis estadístico
Los experimentos se realizaron con cinco repeticiones en diferentes días. Los datos cuantitativos se presentaron como la media +/- SEM y fueron analizados con ANOVA de una vía seguido de una prueba post-hoc de Dunnett utilizando el software estadístico Prism 6 para Mac OSX versión 6.0 (La Jolla California USA). Valores de p<0.05 fueron considerados significativos.
En este estudio evaluamos la participación de la PRL en la migración de las células LNCaP, llevada a cabo mediante el ensayo de “raspado y cicatrización de herida”. La PRL fue probada a concentraciones de 0, 5, 10, 25, 50, 100, 150 y 200 nM en el ensayo de migración celular (Figura 1). Después de 48 h de estimulación con PRL, la migración de las células LNCaP incrementó significativamente en un 19.44 % con 25 nM de PRL, en un 81.25% con 50 nM de PRL y en un 49.58% con 100 nM de PRL, con respecto al grupo control (células no estimuladas con PRL) (Figura 2).
Figura 1. Efecto de la PRL en la migración de las células LNCaP utilizando el modelo clásico de raspado y cicatrización de herida. Se puede observar la migración de las células LNCaP después de que fueron estimuladas por 48 h con diferentes concentraciones de PRL (nM). Las imágenes fueron convertidas a escala de grises. Se muestra un campo representativo por tratamiento de uno de los 5 experimentos. Figura 2. Efecto de la PRL en la migración de las células LNCaP. La estimulación de las células LNCaP con PRL incrementó significativamente la migración celular, observada a las 48 h después de que un rasguño fue hecho sobre una capa confluente de células usando una punta de pipeta. Los datos fueron cuantificados como área restante de la herida en m2
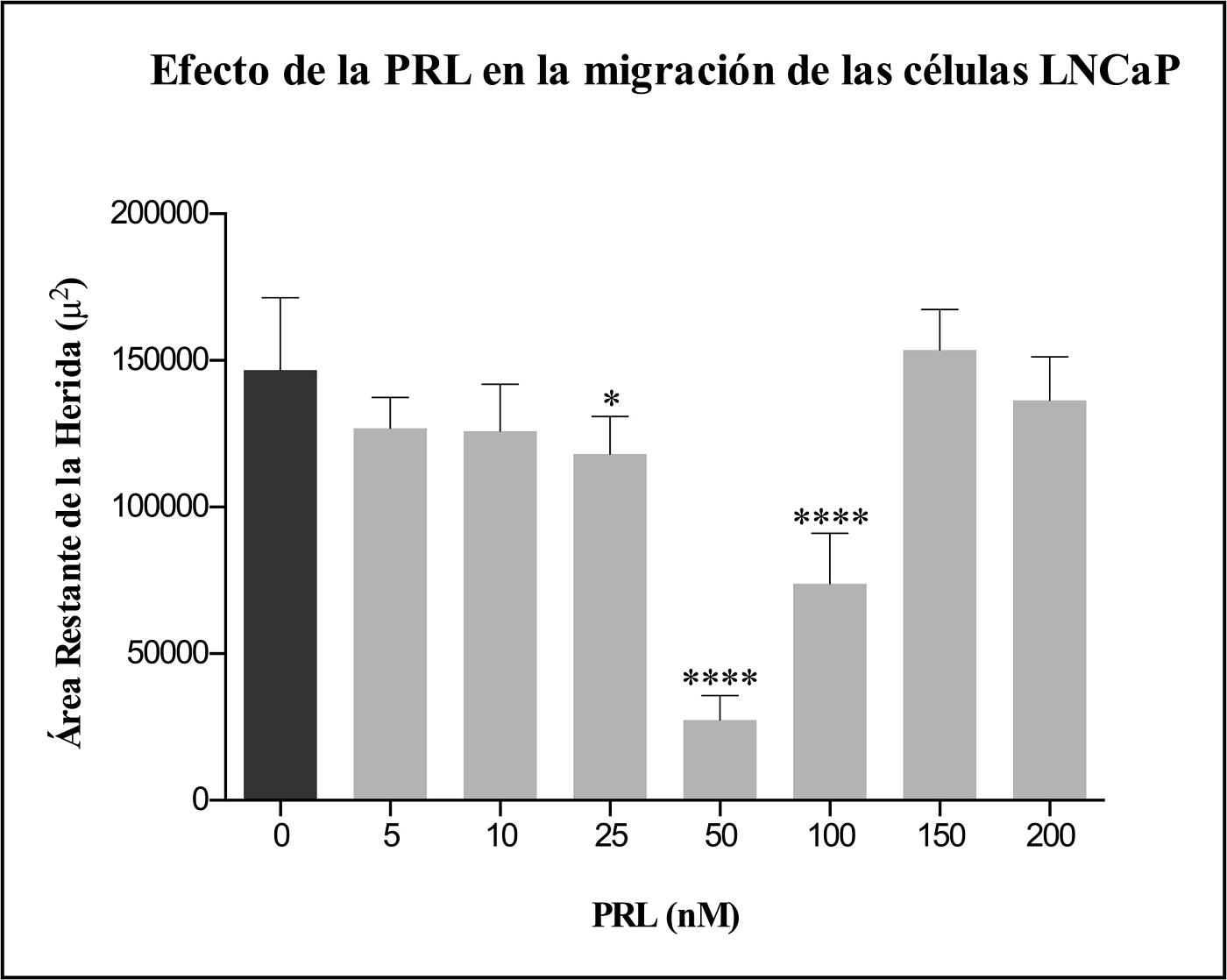
Nuestros datos apoyan la hipótesis de que la PRL induce migración en la línea celular de cáncer de próstata humano LNCaP. Un aumento significativo en la migración se observó después de probar un rango de concentraciones de PRL, observándose que la concentración de 25 nM indujo un aumento del 19.44 %, la de 50 nM un aumento del 81.25% y la de 100 nM un aumento del 49.58%, después de 48 horas de estimulación con PRL. Si bien nuestros datos indican que la PRL promueve migración en las células LNCaP, lo que se comprobó mediante un método clásico para estudiar migración celular (técnica de “raspado y cicatrización de herida”), aún se requieren hacer más estudios donde se evalué a la PRL sobre la migración utilizando diferentes líneas celulares de cáncer de próstata y utilizando métodos más precisos; así como estudiar los mecanismos a través de los cuales la PRL induce la migración celular.
A la fecha, son escasos los trabajos que estudian el efecto de la PRL en la migración celular y no existen estudios que evalúen la participación de esta hormona en la migración de líneas celulares derivadas de la próstata, por ejemplo, las células LNCaP. Se sabe que la PRL incrementa la migración de las líneas celulares de cáncer de mama T47D, ZR75-1 y MCF-7 a través de inducir cambios en la remodelación de la actina.17 Esto sugiere que los efectos de la PRL pueden estar asociados a la matriz extracelular. Dichos efectos fueron observados a dosis de 50 ng/ml (2.17 nM) y 100 ng/ml (4.35 nM) y después de 48 horas de estimulación; utilizando la técnica de raspado con navaja de afeitar para evaluar la migración celular. No hubo diferencias entre ambas dosis. Si bien el tiempo de estimulación es igual al empleado por nosotros, las concentraciones de PRL con las que observamos diferencias significativas en la migración celular son diferentes. Estas diferencias pueden ser debidas, en parte, a las condiciones de cultivo empleadas en el estudio de Da Silva y colaboradores, las cuales difirieron considerablemente del nuestro: suplementaron repetidamente (cada 12 h, el medio fresco y el tratamiento fueron reemplazados) y usaron una preparación de PRL humana recombinante, con una posible potencia biológica diferente. Además, también puede ser debido al tipo de línea celular empleada. Otro estudio reportó que la PRL estimuló la invasión y migración de la línea celular de trofoblastos HTR-8/SVneo. Cuando estas células fueron estimuladas por 24 h con 100 ng/ml (4.35 nM) de PRL humana la migración de estas células incrementó significativamente un 125%, y en un 138% cuando se estimularon con 1000 ng/ml (43.48 nM) de PRL, respecto a las células control que no fueron estimuladas con la hormona.15 Estos efectos fueron acompañados por un incremento de las integrinas a1 y a5, lo cual puede contribuir a un aumento de la invasión celular. Las integrinas participan en la migración celular y se ha mostrado que la subunidad a1 activa la vía proliferativa RAS/ERK y juega un rol importante en la proliferación y migración celular del carcinoma mamario.18 Luego entonces, podemos inferir que la PRL aumenta la migración de la línea celular de trofoblastos HTR-8/SVneo a través de activar la vía RAS/ERK como consecuencia de un incremento de la integrina a1 por PRL. Si bien en este trabajo no hemos evaluado los mecanismos a través de los cuales la PRL induce migración de las células LNCaP, nuestros datos concuerdan en que una concentración 50 nM de PRL induce migración significativa en las células LNCaP, concentración similar a la usada por Stefanoska y colaboradores (43.48 nM). No obstante, encontraron un mayor efecto y en menor tiempo. Esto puede ser debido al uso de PRL humana, la cual puede tener una potencia biológica diferente, así como al tipo de línea celular empleada. Esto también puede explicar por qué en células de cáncer de ovario TOV112D la PRL humana recombinante indujo un aumento del 30% en la migración de estas células a concentraciones más bajas (500 ng/ml=21.74 nM) y en menor tiempo (16 h), comparado con la concentración de 25 nM de PRL ovina la cual tuvo un efecto significativo sobre la migración de las células LNCaP, después de 48 h de estimulación.
Es sabido ampliamente que los efectos de la PRL son mediados por el receptor a PRL (RPRL).19 Mediante la técnica de Western blot determinamos la presencia del RPRL (dato no mostrado) en las células LNCaP, si bien no hemos elucidado que isoformas están presentes. No obstante, se ha reportado que las células LNCaP expresan una forma larga del RPRL, una forma corta 1b (SF1b) y no producen la forma intermedia.20,21 Los estudios donde se ha evaluado la participación de la PRL sobre la migración celular han descrito que los efectos de esta hormona son a través del RPRL.15,17 En células HTR-8/SVneo que fueron estimuladas con 10 mg/ml del anticuerpo de ratón anti-RPRL (que neutraliza al RPRL) no hubo migración de estas células cuando fueron estimuladas con 100 ng/ml de PRL por 24 h.15 Por otra parte, cuando las células de cáncer de mama (T47D, ZR75-1 y MCF-7) fueron previamente transfectadas con anti-hPRLRsiRNA (para llevar a cabo el silenciamiento efectivo de la expresión del RPRL) no se observó ningún aumento en la migración celular cuanto estas células fueron estimuladas con 50 y 100 ng/ml de PRL.17 Si bien se ha demostrado que la participación de la PRL en la migración celular es a través del RPRL, no se sabe a través de qué isoforma del receptor (largo o corto) se está llevando a cabo y menos aún las vías de segundos mensajeros que participan en dicho proceso. Además, en la migración, también participan las metaloproteasas de la matriz (MMPs), endopeptidasas dependientes de zinc cuya principal función es la degradación de proteínas de la matriz extracelular (ECM),22 facilitando así la migración y la metástasis.23 Dos MMPs de gran interés que participan en el movimiento de las células y promueven la migración celular, y por lo tanto están relacionadas con la migración y metástasis, son MT1-MMP (o MMP-14) y MMP-2.22,24 Además, se sabe que la PRL estimula, por ejemplo, la actividad de MMP-2,25 o puede inhibir al inhibidor de MMPs 1 (TIMP-1), aumentando así la actividad de MMP-2,26 lo cual puede estar directamente relacionado con un aumento en la migración celular. Por lo tanto, una de las propuestas de este trabajo de investigación que se llevarán a cabo, como parte complementaria para entender los mecanismos por los cuales la PRL induce migración en las células LNCaP, será evaluar el tipo de receptor a través del cual la PRL induce migración celular, las vías de segundos mensajeros que participan en ello y si la PRL es capaz de inducir migración a través de activar a MMP2 y MT1-MMP.
La PRL es una hormona que no solo participa en la síntesis de leche por la glándula mamaria, sino también en el desarrollo de enfermedades como el cáncer de próstata. Sin embargo, su participación en la migración celular, un mecanismo clave para llevar a cabo la metástasis, es prácticamente desconocido. La evidencia muestra que la PRL induce migración en líneas celulares de cáncer de mama, trofoblastos y ovario, sin embargo, en líneas celulares de cáncer de próstata no existe evidencia alguna. Los resultados obtenidos muestran por primera vez que la PRL indujo migración en la línea celular de cáncer de próstata LNCaP, lo que sugiere que esta hormona puede tener alguna participación en la metástasis. Por lo anterior, y tomando en cuenta que en el hombre los niveles plasmáticos de PRL incrementan con la edad, la PRL debe ser considerada como un blanco terapéutico potencial de estudio en la lucha contra el cáncer de próstata.
A la doctora Elizabeth Langley-McCarron del Instituto Nacional de Cancerología de la Ciudad de México por la donación de la línea celular de cáncer de próstata humana LNCaP.
A la doctora Cynthia Fernández Pomares por su apreciable ayuda para el cuidado y manejo del cultivo de la línea celular LNCaP.
Donativo PROMEP/103.5/13/9126 (PTC-716; FRD)
Los autores declaramos no tener conflicto de intereses.
- Bernichtein S, Touraine P, Goffin V. New concepts in prolactin biology. J. Endocrinol 2010 206: 1–11.
- Hernandez ME, Miquel M, Pascual LI, Herrera D, Aranda-Abreu G, López L, Rojas F, Toledo R, Manzo J. Temporalidad en el incremento de receptores a prolactina en el hipotalamo de la rata macho durante la conducta sexual. eNeurobiología 2010 1: 1–8.
- Hernandez ME, Wilson MJ. The role of prolactin in the evolution of prostate cancer. Open J. Urol. 2012 2: 188–197.
- Costello LC, Franklin RB. Effect of prolactin on the prostate. Prostate 1994 24: 162–166.
- Sackmann-Sala L, Goffin V. Prolactin-induced prostate tumorigenesis. En: Diakonova M, Recent advances in prolactin research. Springer 2015 221-242.
- Crépin A, Bidaux G, Vanden-Abeele F, Dewailly E, Goffin V, Prevarskaya N, Slomianny C. Prolactin stimulates prostate cell proliferation by increasing endoplasmic reticulum content due to SERCA 2b over-expression. Biochem. J. 2007 401: 49–55.
- Har̈könen P. Paracrine prolactin may cause prostatic problems. Endocrinology 2003 144: 2266–2268.
- Van Coppenolle F, Slomianny C, Carpentier F, Le Bourhis X, Ahidouch A, Croix D, Legrand G, Dewailly E, Fournier S, Cousse H, Authie D, Raynaud JP, Beauvillain JC, Dupouy JP, Prevarskaya N. Effects of hyperprolactinemia on rat prostate growth: evidence of androgeno-dependence. Am. J. Physiol. Endocrinol. Metab. 2001 280: E120–E129.
- Leav I, Merk FB, Lee KF, Loda M, Mandoki M, McNeal JE, Ho SM. Prolactin receptor expression in the developing human prostate and in hyperplastic, dysplastic, and neoplastic lesions. Am. J. Pathol. 1999 154: 863–870.
- O’Sullivan CC, Bates SE. Targeting prolactin receptor (PRLR) signaling in PRLR-positive breast and prostate cancer. Oncologist 2016 21: 523–526.
- Ben-Jonathan N, LaPensee CR, LaPensee EW. What can we learn from rodents about prolactin in humans? Endocr. Rev. 2008 29: 1–41.
- Chen H, Nalbantoglu J. Ring cell migration assay identifies distinct effects of extracellular matrix proteins on cancer cell migration. BMC Res. Notes 2014 7: 1–9.
- Doyle AD, Petrie RJ, Kutys ML, Yamada KM. Dimensions in cell migration. Curr. Opin. Cell Biol. 2013 25: 642–649.
- Han T, Kang D, Ji D, Wang X, Zhan W, Fu M, Xin HB, Wang JB. How does cancer cell metabolism affect tumor migration and invasion? Cell Adhes. Migr. 2013 7: 395–403.
- Stefanoska I, Jovanović-Krivokuća M, Vasilijić S, Ćujić D, Vićovac L. Prolactin stimulates cell migration and invasion by human trophoblast in vitro. Placenta 2013 34: 775–783.
- Tan D, Chen KE, Khoo T, Walker AM. Prolactin increases survival and migration of ovarian cancer cells: Importance of prolactin receptor type and therapeutic potential of S179D and G129R receptor antagonists. Cancer Lett. 2011 310: 101–108.
- Da Silva PL, do Amaral VC, Gabrielli V, Montt MM, Mannella P, Baracat EC, Soares JM, Simoncini T. Prolactin promotes breast cancer cell migration through actin cytoskeleton remodeling. Front. Endocrinol. 2015 6: 1–8.
- Boudjadi S, Carrier JC, Beaulieu JF. Integrin α1 subunit is up-regulated in colorectal cancer. Biomark. Res. 2013 1: 16.
- Goffin V, Touraine P. The prolactin receptor as a therapeutic target in human diseases: browsing new potential indications. Expert Opin. Ther. Targets 2015 19: 1229–1244.
- Wu W, Ginsburg E, Vonderhaar BK, Walker AM. S179D prolactin increases vitamin D receptor and p21 through up-regulation of short 1b prolactin receptor in human prostate cancer cells. Cancer Res. 2005 65: 7509–7515.
- Coppenolle FV, Skryma R, Ouadid-Ahidouch H, Slomianny C, Roudbaraki M, Delcourt P, Dewailly E, Humez S, Crépin A, Gourdou I, Djiane J, Bonnal JL, Mauroy B, Prevarskaya N. Prolactin stimulates cell proliferation through a long form of prolactin receptor and K+ channel activation. Biochem. J. 2004 377: 569–578.
- Benson CS, Babu SD, Radhakrishna S, Selvamurugan N, Sankar BR. Expression of matrix metalloproteinases in human breast cancer tissues. Dis. Markers 2013 34: 395–405.
- Chen P, Parks WC. Role of matrix metalloproteinases in epithelial migration. J. Cell. Biochem. 2009 108: 1233–1243.
- González-Ávila G, González A, Delgado J, Gutiérrez-González LH. Participación de las metaloproteasas de matriz en la progresión del cáncer. Rev. del Inst. Nac. Enfermedades Respir. 2009 22: 328–336.
- Goto T, Endo T, Henmi H, Kitajima Y, Kiya T, Nishikawa A, Manase K, Sato H, Kudo R. Gonadotropin-releasing hormone agonist has the ability to induce increased matrix metalloproteinase (MMP)-2 and membrane type 1-MMP expression in corpora lutea, and structural luteolysis in rats. J. Endocrinol. 1999 161: 393–402.
- Nagafuchi H, Suzuki N, Kaneko A, Asai T, Sakane T. Prolactin locally produced by synovium infiltrating T lymphocytes induces excessive synovial cell functions in patients with rheumatoid arthritis. J. Rheumatol. 1999 26: 1890–900.
| Recibido: 26 de octubre de 2017 | Aceptado: 20 de diciembre de 2017 |
Dr. Fausto Rojas Durán, Centro de Investigaciones Cerebrales, Universidad Veracruzana, Xalapa, Ver. México. Avenida Dr. Luis Castelazo Ayala S/N, colonia Industrial Ánimas, C.P. 91190. Tel.: (228) 8418900 Ext. 16311. Correo: frojas@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
