El sistema olfatorio de las salamandras (Plethodontidae) y su relación con la detección de depredadores
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Rivera-Hernández Ita Andehui1, Bello-Sánchez Edgar A1, Hernández-Salazar Laura T1, Morales-Mávil Jorge E1*
1Laboratorio de Biología del Comportamiento, Instituto de Neuroetología, Universidad Veracruzana, Veracruz, México.
Resumen/Abstract
Introducción
Conclusión
Agradecimientos
Conflicto de intereses
Referencias
Correspondencia
Las salamandras de la familia Plethodontidae, ante las presiones de depredación, han tenido que desarrollar diversas estrategias para reducir la probabilidad de un ataque. Las pistas químicas tienen un papel importante en las interacciones depredador-presa. En las salamandras existen dos subsistemas con la capacidad para detectar químicos, el sistema olfatorio principal y el vomeronasal (o sistema accesorio). Se reconoce que la capacidad de detectar e interpretar el reconocimiento de depredadores a partir de estímulos químicos que se pueden encontrar en los sustratos, provoca procesos internos que activan el sistema nervioso autónomo y el sistema endócrino, preparando fisiológicamente a los individuos para dar una respuesta conductual apropiada ante una posible situación de peligro. El eje hipotálamo-hipofisario-adrenal coordina las respuestas adaptativas del organismo a estímulos estresantes, de manera que se activa ante la presencia de un depredador, permitiéndole responder de forma más rápida y eficaz para ajustar la homeostasis y aumentar sus posibilidades de supervivencia. La detección de los depredadores ya sea de manera innata o aprendida, provee a las salamandras de una capacidad de respuesta ante posibles ataques, y muestra la plasticidad neural (memoria olfativa) para mantener almacenada la información o bien, de aprender nueva información, y evocarla cada vez que sea necesaria, para aumentar la eficiencia de la respuesta ante situaciones de peligro. El objetivo de esta revisión es mostrar la información conocida y actualizada de las características morfológicas y fisiológicas de las salamandras pletodóntidas para el reconocimiento de depredadores a través del olfato, como un proceso complejo y vital que involucra distintos componentes, y tiene como finalidad aumentar la probabilidad de éxito de supervivencia de los individuos.
Palabras clave: Depredador, Olfato, Órgano vomeronasal, Plethodontidae, Reconocimiento.
Salamanders of the Plethodontidae family in the face of predation pressures have had to develop various strategies to reduce the likelihood of an attack. Chemical cues play an important role in predator-prey interactions. In salamanders there are two subsystems with the ability to detect chemicals, the main olfactory system and vomeronasal (or accessory system). It is recognized that the ability to detect and interpret the recognition of predators from chemical stimuli that can be found in substrates causes internal processes that activate the autonomic nervous system and the endocrine system, physiologically preparing individuals to give a behavioral response appropriate to a potentially hazardous situation. The hypothalamic-pituitary-adrenal axis coordinates the adaptive responses of the organism to stressful stimuli, so that it is activated in the presence of a predator, allowing it to respond more quickly and effectively to adjust homeostasis and increase its chances of survival. The detection of predators, either innately or learned, provides salamanders with a capacity to respond to possible attacks, and shows the neural plasticity (olfactory memory) to keep information stored, or learn new information, and evoke it whenever necessary, to increase the efficiency of response to hazardous situations. The aim of this review is to show the known and updated information of the morphological and physiological characteristics of the plethodontid salamanders for the recognition of predators through smell as a complex and vital process that involves different components, and aims to increase the probability of success of survival of individuals.
Keywords: Predator, Olfaction, Vomeronasal organ, Plethodontidae, Recognition.
La señalización química es el método más antiguo de comunicación. Los primeros organismos unicelulares que habitaban los océanos poseían la habilidad de detectar diferentes clases de compuestos químicos.1 Una vez que los organismos evolucionaron para ser capaces de diferenciar entre los componentes químicos emanados de sus congéneres y los componentes de los alimentos, se utilizó el reconocimiento de otro tipo de estímulos químicos como fuente de información ambiental.1,2 Trabajos recientes han mostrado que el sentido del olfato depende del desarrollo de dos subsistemas olfativos, el bulbo olfatorio principal y el órgano vomeronasal,3 por medio de estos, los organismos son capaces de identificar y diferenciar entre estímulos químicos. Los individuos utilizan señales o pistas químicas en diferentes momentos de su vida, por ejemplo, durante el ciclo estral, para el marcaje de territorio, o cuando son emanadas por las presas en encuentros con un depredador, e incluso el reconocimiento del olor de los depredadores per se.1-4 La capacidad que tienen los organismos para reconocer a sus depredadores y a los estímulos químicos de conespecíficos ante una situación de peligro, es relevante en la realización de estrategias antidepredatorias y por consiguiente, también en su adaptación y desarrollo.2
Las pistas olfativas tienen un importante papel en la interacción depredador–presa, por ejemplo, cuando las presas van dejando rastros odorantes que usan los depredadores para ubicarlas.5 Existen presas que pueden identificar el olor de un depredador potencial, con la ventaja de reducir el riesgo a ser depredadas o evitar situaciones de peligro.6,7 En este sentido, se ha documentado que las salamandras son un grupo que basa gran parte de su detección de conespecíficos y depredadores a través del olfato.2 Estudios conductuales han mostrado que Batrachoseps attenuatus, tiene la capacidad de reconocimiento de su propio olor, lo que es importante en aspectos de territorialidad.8 Se ha mostrado la efectividad del olfato en las salamandras Plethodon cinereus, quienes cazan a sus presas (Drosophila melanogaster) durante la oscuridad.9 La efectividad del olfato también es dependiente de la temperatura, tal y como se ha mostrado con Desmognatus conanti.10 Las salamandras de espalda roja (Plethodon cinereus), son atraídas hacia estímulos químicos provenientes de sus presas.11 Por otra parte, se ha mostrado que la sola exposición a un estímulo odorante de un depredador, es capaz de provocar la inhibición del movimiento en salamandras Eurycea nana.12 Considerando que el olfato es un sistema dependiente de la interacción química entre receptores sensoriales y estímulos químicos. Se considera importante realizar una revisión que muestre las características morfológicas y respuestas fisiológicas, en las salamandras pletodóntidas (familia Plethodontidae, la más numerosa y diversa familia de salamandras, con 27 géneros y más de 375 especies)13 asociadas con la detección olfativa en el contexto de la depredación.
2. Olfato y depredación
En los anfibios, la depredación es considerada una importante presión selectiva que conduce a diversas adaptaciones y afecta aspectos de su ecología, fisiología, historia de vida y comportamiento.13,14 La adaptación y el desarrollo de las estrategias antidepredatorias de los anfibios, necesitan de factores que pueden no depender de la presencia del depredador (estrategias primarias), o bien estar supeditadas a él (estrategias secundarias).13,15,16
Consecuentemente, las estrategias de defensa están relacionadas con los sentidos que los depredadores utilizan para localizar y capturar a su presa. Sin embargo, cualquier mecanismo de defensa adquirido por una presa será seguido por la adaptación de mecanismos de depredación más efectivos o incrementará la resistencia por parte de los depredadores, generando una coevolución constante entre estrategias de caza y respuestas de supervivencia.15,17
En cualquier etapa de su vida, las salamandras de la familia Plethodontidae son potenciales presas de una amplia variedad de depredadores,13 que van desde artrópodos, aves, mamíferos, reptiles, e incluso otros anfibios.18 La principal vía que estas salamandras adoptaron para reconocer a sus posibles depredadores, es a través de olores depositados en los sustratos.19 Estos estímulos pueden provenir directamente de los depredadores o de eventos de depredación, y ayudan a las salamandras a reducir el riesgo de ser atacadas. La detección de estímulos químicos proporciona ventajas sobre el reconocimiento de otros estímulos, como los visuales y acústicos, bajo diferentes contextos. Por ejemplo, los estímulos químicos pueden ser detectados en un ambiente acuático, o bien, cuando se presentan obstáculos y los estímulos visuales suelen ser menos efectivos, además de que los olores pueden persistir en el ambiente, transmitiendo información a los individuos presa después de que el depredador dejó el área. Esto puede ser especialmente benéfico si los depredadores vuelven a visitar las mismas áreas de forrajeo,20,21 ya que las salamandras aprenden a evitar estos sitios.
Se ha documentado para algunas especies de anfibios, su capacidad para responder de manera innata a sus depredadores, aunque también se ha reportado que hay especies que requieren de la experiencia previa para aprender y llevar a cabo el reconocimiento de sus depredadores (condicionamiento).22,23 Cuando un individuo es depredado o herido, libera feromonas que indican alerta para sus conespecíficos e incluso para otras especies de anfibios muy emparentadas. Estos estímulos químicos van acompañados por el olor que deja el depredador, de tal manera que los individuos asocian la señal de alerta con la pista de olor, y aprenden a asociar estas mezclas odorantes con el peligro.23-25 Existen estudios que han mostrado que las salamandras son capaces de reconocer el olor del depredador y con ello, desarrollar una estrategia antidepredatoria, aunque el olor del depredador no esté acompañado con las feromonas de alerta liberadas por sus conespecíficos.23 Asimismo, está documentado que los anfibios tienen la capacidad de mostrar respuestas antidepredatorias en su primer encuentro con depredadores (o su olor) que son similares a otros depredadores ya conocidos. A este fenómeno se le conoce como generalización del reconocimiento de depredadores y, aparentemente, es muy extendido en los anfibios en comparación con la frecuencia de ocurrencia en otros animales (mamíferos, peces, aves, entre otros).22,23
Por otra parte, la información que los animales obtienen sobre el riesgo de depredación, es aprendida, por lo que para hacer estos ajustes dinámicos en su comportamiento, se requiere que los individuos integren la información sobre sus depredadores potenciales, así como, de su entorno.26,27 Para poder analizar el aprendizaje que tienen algunos anfibios sobre sus potenciales depredadores, se ha sugerido un modelo integral para la memoria asociada con el reconocimiento de “depredadores aprendidos”. En este modelo, se argumenta que una serie de factores internos y externos influyen en el paso de la información de un depredador de la memoria de corto plazo, a la memoria de largo plazo.28 Uno de estos factores internos, es la certeza asociada con la correcta identificación del depredador como una amenaza; cuanto más segura está la presa de que el individuo detectado es su depredador, la información será fijada para que el depredador sea reconocido como tal.23,27 Si aumenta la incertidumbre acerca de la información relacionada con un depredador potencial, entonces la información no parece ser consolidada y, en posteriores exposiciones al potencial depredador, los anfibios dejan de responder.28
La experiencia juega un papel importante en el reconocimiento de depredadores a través del olfato, les permite a las salamandras ajustar cuándo, dónde y cómo se alimentan y se reproducen, discriminar entre falsas alarmas e indicios reales de peligro, así como ajustar la intensidad de las respuestas antidepredatorias con el objetivo de optimizar su energía en respuesta al riesgo de depredación, el cual es variable en el espacio y en el tiempo. La información que los animales obtienen sobre el riesgo de depredación local es generalmente aprendida, por lo que, para hacer estos ajustes dinámicos en su comportamiento, necesitan integrar la información que recopilan acerca de factores extrínsecos (abundancia de presas estacionales, presencia o ausencia de depredadores) y factores intrínsecos (aquellos relacionados con el estado interno), para que coincida con las condiciones de riesgo actuales.16,22,23,26
3. Órganos olfatorios involucrados en la detección de estímulos
El sentido del olfato es responsable de la detección química de compuestos que están en el ambiente; de esta capacidad de detección, los organismos pueden tomar ventajas que son expresadas a nivel conductual, ya sea para encontrar presas,28-31 o bien para evitar la depredación.32,33 La detección de olores se realiza a través de los órganos quimiosensores, los cuales son de dos tipos: órgano olfatorio principal y órgano vomeronasal o de Jacobson. En los anfibios se encuentra una cavidad olfatoria larga (principal) y varias cámaras accesorias que se extienden lateralmente y ventralmente. El órgano vomeronasal está en una de las cámaras accesorias fuera de la cámara olfatoria principal,13,34,35 y consiste en un tubo de abertura única que se extiende entre la cavidad nasal y el techo de la boca (Figura 1).1 El modelo general de detección olfativa en vertebrados, inicia dentro del sistema olfatorio principal a través de la captación del odorante por medio de las microvellosidades localizadas en el epitelio sensorial, en el cual se encuentran receptores acoplados a proteínas G, y que asociados a una familia de multigenes, se acoplarán a compuestos odorantes de manera específica.36 Los receptores sensoriales del olfato, son llevados a través de las neuronas receptoras olfativas, las cuales se intercalan hacia el epitelio olfativo en la cavidad nasal. Los olores funcionan como un ligando, que al entrar en contacto con receptores olfativos específicos, se activan y generan una segunda cascada de AMPc, activando flujos que permiten la apertura de canales de Ca2+ lo que genera cambios eléctricos y un potencial de acción, con lo cual se realiza la identificación de olores.36,37 De manera general, se considera que el epitelio quimiosensor en la cámara olfatoria principal, es usado primariamente para detectar partículas volátiles de tamaño reducido. Por otra parte, se ha propuesto que el epitelio vomeronasal es el encargado de la detección de moléculas de mayor tamaño que no son volátiles, como es el caso de algunos compuestos feromonales.13
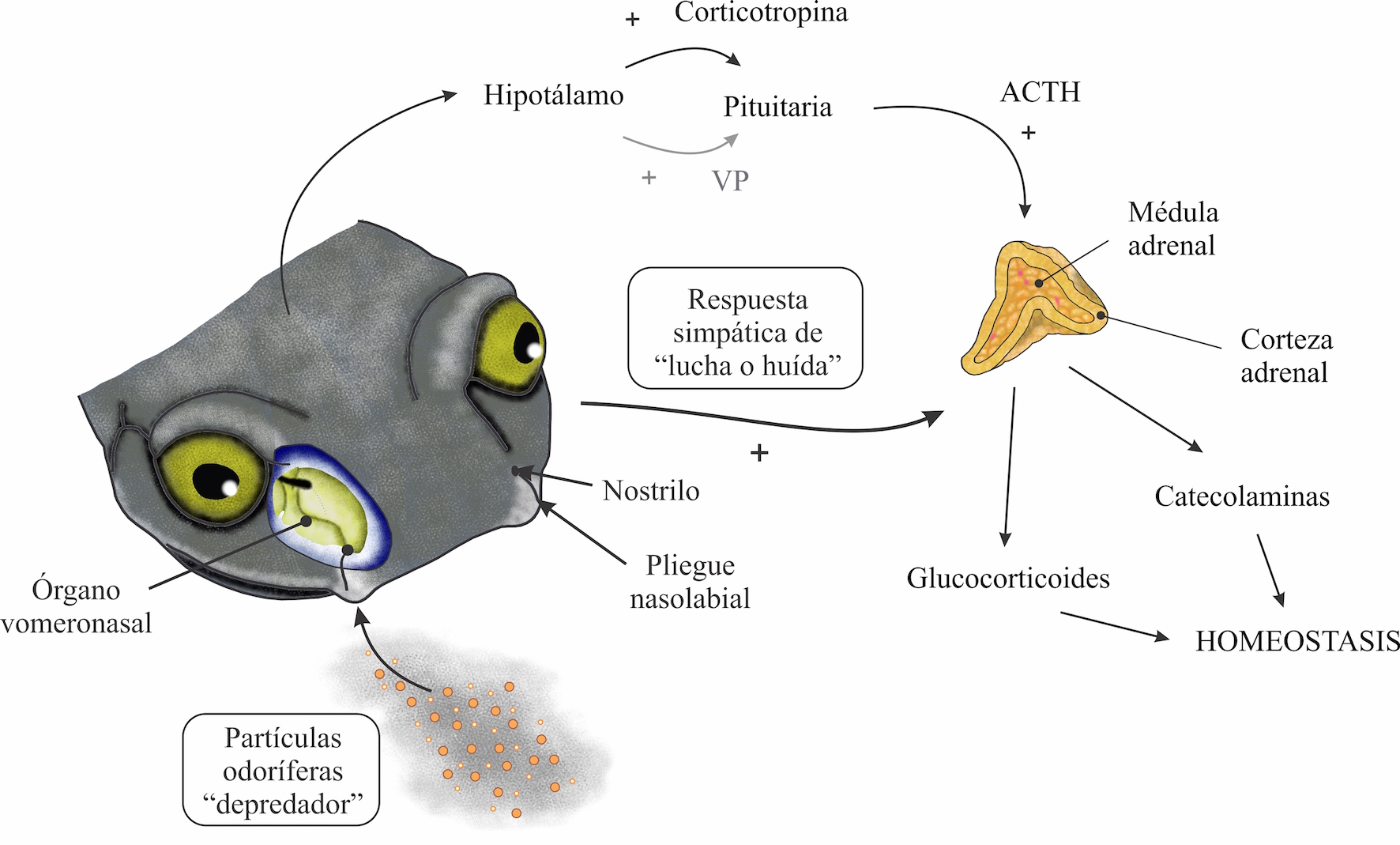
Figura 1. Órganos nasales quimiosensores de las salamandras. Se aprecia el área del cráneo donde se ubica el órgano nasal, y se muestran los principales componentes del eje hipotalámico-hipofisario-adrenal. Los estímulos externos percibidos como estresores inician una cascada de eventos que conducen a la activación de la división simpática del sistema nervioso y la estimulación de la hormona liberadora de corticotropina (CRH) y vasopresina (VP) liberadas por las neuronas hipotalámicas. La activación de la senda simpática inicia la liberación de catecolaminas de la médula adrenal la cual actúa en varios órganos y tejidos blanco. CRH y VP estimulan la liberación de la hormona adrenocorticotropa (ACTH) de los corticotropos de la pituitaria anterior que a su vez estimula la liberación de glucocorticoides de la corteza adrenal. Los glucocorticoides actúan en una variedad de órganos y tejidos blanco para mantener la homeostasis.
Las salamandras de la familia Plethodontidae, muestran unas estructuras únicas llamadas cirros y surcos nasolabiales, las cuales, acompañadas por un comportamiento llamado nose-tapping (toques con la nariz) (Figura 2), pueden transportar los compuestos químicos que se encuentran en las superficies de los sustratos u otros individuos, directamente al órgano vomeronasal, evitando la cámara olfatoria principal.13,34,38,39 Así, el contacto físico directo con la fuente del olor, puede ser necesario para la estimulación química y alcanzar el epitelio vomeronasal.34,38,39 Los surcos nasolabiales están equipados con glándulas que secretan un compuesto lipídico; este fluido recoge los químicos cuando la salamandra toca su hocico con el sustrato (toques con la nariz) o a otras salamandras, y el fluido y las moléculas químicas son entonces llevadas por acción capilar al órgano vomeronasal. El tamaño relativo de los órganos quimiosensores de las salamandras, está relacionado hasta cierto punto con el hábitat y la conducta, y también reflejan su historia filogenética.13

Figura 2. Se muestra un ejemplo de cómo se realiza la conducta nose tapping (toque de los cirros nasolabiales en las superficies). Esta conducta es básica dentro de la exploración de las salamandras y ayuda a la detección de partículas odoríferas en los sustratos.
La superficie de las cámaras que conforman los órganos quimiosensores está forrada con epitelio sensorial ciliado. El neuroepitelio ciliado se encuentra en tres parches; el parche más grande ocupa el techo, la pared medial y el extremo anterior de la cavidad principal.40 Un pequeño y protuberante parche se encuentra en medio del piso y otro pequeño está presente en la cámara del órgano vomeronasal.35,38
En ambos casos el epitelio olfatorio está formado por tres discernibles, pero no claramente delineadas capas nucleares: dendritas, células de soporte y vesículas de las células receptoras vomeronasales.1,34,38 Las células de soporte que están más superficiales, usualmente son las teñidas más ligeramente y muestran un patrón finamente dispersado de cromatina; están generalmente organizadas en dos capas en la porción anterior del órgano olfatorio principal (en donde el epitelio olfatorio es más grueso en su totalidad) y de una sola capa en la parte más posterior.34,38 La capa celular medial está compuesta por células receptoras bipolares teñidas de manera más oscura, las cuales muestran un patrón de cromatina similar al del "tablero de damas" que es muy característico;1,38 ésta es usualmente la capa más gruesa. En el órgano olfatorio principal, la capa de células receptoras bipolares se presenta con 10 a 12 células de profundidad en su sección anterior y con dos o tres células en la parte más posterior.38 En el caso del órgano vomeronasal, esta capa está formada por siete a ocho células de profundidad.1,38 La capa celular más profunda está compuesta por células basales, las cuales se encuentran menos teñidas que las células receptoras pero más que las de soporte.1,38,41 Asimismo, más superficial a las células de soporte, se encuentra una capa muy delgada compuesta por el citoplasma de las células de soporte (la cual ocupa una posición supra y perinuclear) y los procesos dendríticos de las células receptoras. Además, en el epitelio del órgano olfatorio principal, se pueden observar los ductos de las glándulas de Bowman a lo largo de todo el epitelio, y más profundo a la capa de células basales se encuentran las glándulas de Bowman.38
Se pueden observar dos diferencias principales entre el epitelio vomeronasal y el de la cámara principal. Los cilios sólo se encuentran en las células receptoras olfatorias, mientras que en las vomeronasales se pueden observar microvellosidades. Además, no se han encontrado glándulas de Bowman en la lámina propia profunda del epitelio vomeronasal, mientras que en la de la cámara olfatoria principal sí.1,38
El parche de epitelio sensible del órgano vomeronasal, está inervado por una rama olfatoria claramente separada de las que inervan el epitelio de la cámara principal.1,4,35,38 El nervio vomeronasal es muy pequeño al salir del órgano vomeronasal, pero crece considerablemente en espesor a lo largo de su curso. El tracto nervioso proveniente del órgano vomero nasal se proyecta hacia el bulbo olfatorio accesorio, mientras que el del órgano olfatorio principal se proyecta hacia el bulbo olfatorio principal.4,35,38,40 Estos tractos se mantienen siempre paralelos, aunque separados en todo momento.38
En un trabajo realizado con dos especies de salamandras pletodóntidas semiacuáticas, Desmognathus ochrophaeus y Eurycea bislineata, y seis terrestres, tres provenientes de la tribu Plethodontini, Ensatina eschscholtzii, Plethodon jordani y Aneides flavipunctatus, y tres provenientes de la tribu Bolitoglossini, Hydromantes italicus, Bolitoglossa subpalmata y Batrachoseps attenuatus, se observó que todas las especies presentan una proyección olfatoria principal de forma y extensión similar, mientras que la proyección vomeronasal es diferente. Las especies semiacuáticas exhibieron varios campos de proyección vomeronasal, sin embargo, las especies terrestres, mostraron sólo uno y a veces dos campos de proyección vomeronasal. Se pudo observar que estas especies estrictamente terrestres que representan a los pletodóntidos más avanzados y especializados poseen campos de proyección vomeronasal que se reducen en número y extensión en comparación con otros pletodóntidos y salamándridos acuáticos. La reducción de los campos de proyección vomeronasal encontrada, puede deberse a una restricción de todo el sistema vomeronasal correlacionado con la vida terrestre de estos grupos de salamandras. Teniendo en cuenta el papel del sistema vomeronasal para todas las salamandras pletodóntidas con respecto a la percepción de feromonas, la reducción no significa necesariamente una pérdida de funcionalidad, sino que es plausible que esté relacionada con una especialización del sistema vomeronasal o con las diferencias en el desarrollo ontogénico de estas especies de estos grupos.4
Ambos tractos nerviosos (olfatorio principal y vomeronal) se proyectan a la corteza olfatoria, la cual está conformada por cinco áreas: el núcleo olfatorio anterior, la corteza piriforme, partes de la amígdala, el tubérculo olfatorio y parte de la corteza entorrinal.42 El principal componente olfativo de la amígdala se encuentra en la parte ventral del pálio lateral caudal. Se distingue del pálio lateral más rostral por una proyección al hipotálamo ventral. En las salamandras, los campos terminales axonales de los bulbos olfativos principales y accesorios se segregan en una región lateral y medial respectivamente en el polo caudal del telencéfalo, paralelo a los campos dendríticos de las neuronas laterales y mediales situadas en esta región.43,44 Esto sugiere que el componente olfativo principal de la amígdala en los anfibios recibe la entrada olfativa sólo del bulbo olfatorio principal. El componente olfatorio accesorio o vomeronasal, se encuentra en el telencéfalo caudal, apenas medial al componente olfativo principal. Rostralmente, se extiende dorsal al pálio-estriado y caudalmente se fusiona con la región dorsal preóptica. Así, la amígdala vomeronasal extendida comprende tanto la amígdala pars lateralis, también llamada amígdala medial, y la zona de transición estriado-paliativa, también llamada amígdala anterior.44 El bulbo olfatorio accesorio envía sus proyecciones al componente caudal de la amígdala vomeronasal y se proyecta fuertemente hacia el área preóptica y el hipotálamo.43,44 La parte anterior comparte estas proyecciones descendentes con la parte caudal, está conectada recíprocamente con ésta y también puede recibir la entrada del bulbo olfatorio accesorio.44
4. Vías de detección de estímulos depredatorios
Las vías olfatorias que conducen al núcleo amigdalino, intervienen en aspectos conductuales del individuo.42 Además, la amígdala es reconocida como parte del cerebro emocional y un centro crítico para las formas básicas de aprendizaje emocional (por ejemplo, miedo condicionado),44 y está relacionada con la evaluación del ambiente para detectar peligros potenciales. Una vez detectados, la amígdala tendrá un papel de organización en montar una respuesta apropiada para el peligro,45 como el despliegue de conductas de huida y la expresión del miedo,46 de esta manera, la amígdala se relaciona con el significado adaptativo para la supervivencia del organismo.45 La amígdala manda la información al hipotálamo y se estimula el eje hipotálamo-hipofisario-adrenal (HHA) (Figuras 1 y 3).1,46
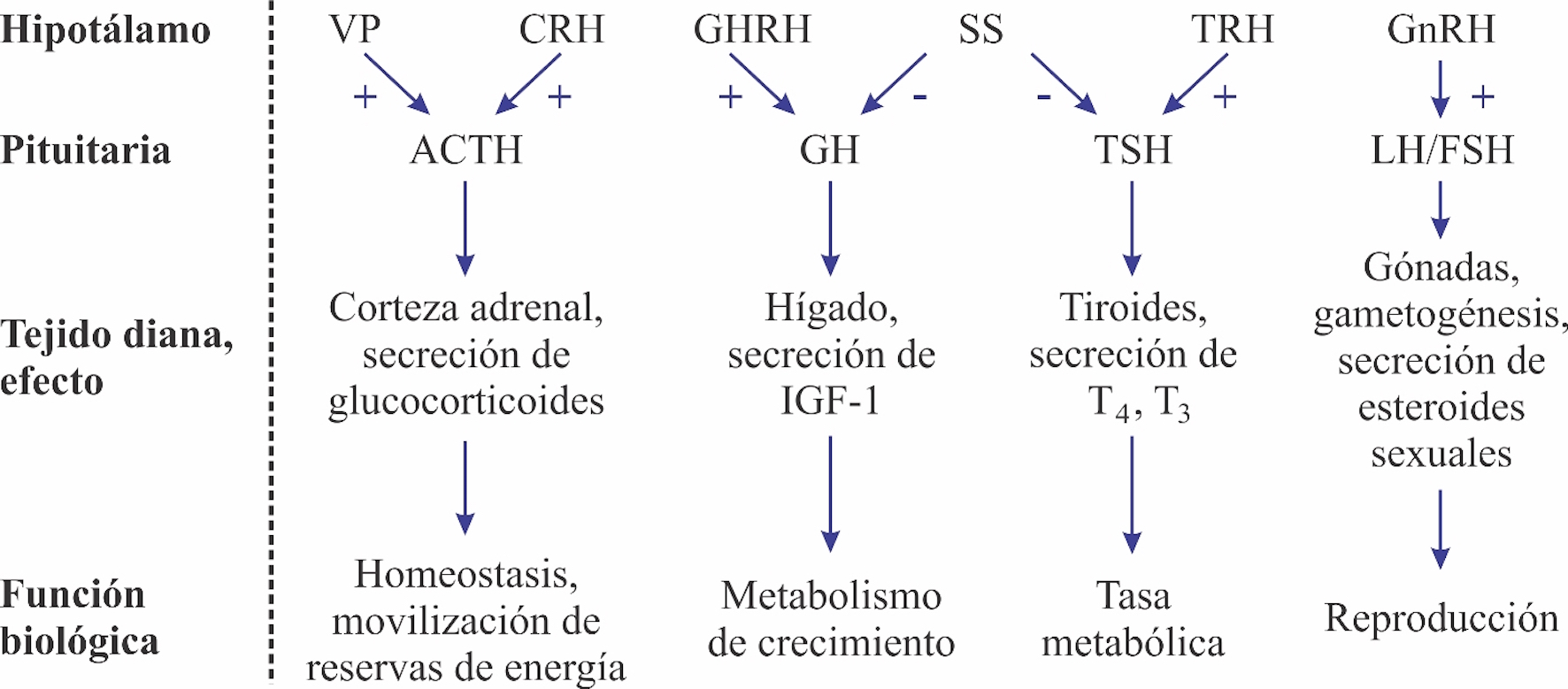
Figura 3. Representación esquemática del eje neuroendocrino hipotalámico-hipofisario y las acciones mayores. Factores hipotalámicos: CRH (hormona liberadora de corticotropina), GHRH (hormona liberadora de hormona del crecimiento, GnRH (hormona liberadora de gonadotropina), SS (somatostatina), TRH (hormona liberadora de tirotropina), VP, vasopresina. + (factor hipotalámico estimulatorio), - (factor hipotalámico inhibitorio). Hormonas hipofisarias: ACTH (hormona adrenocorticotropa), FSH (hormona folículo estimulante), GH (hormona de crecimiento), LH (hormona luteinizante), TSH (hormona estimulante de la tiroides), IGF (factor de crecimiento insulínico). Modificado de Matteri et al. (2000).
El eje HHA coordina las respuestas adaptativas del organismo a estímulos estresantes de cualquier tipo, de manera que se activa cuando la situación o el ambiente (interno o externo) condicionan al organismo (como la presencia de un depredador), permitiéndole responder de forma más rápida y eficaz, conduciendo a cambios conductuales y periféricos que mejoran la capacidad del organismo para ajustar la homeostasis y aumentar sus posibilidades de supervivencia.40,47 Se activa el sistema nervioso simpático induciendo la secreción de catecolaminas, adrenalina y noradrenalina, en la médula adrenal y produciendo así efectos sobre la función cardiovascular y el metabolismo, como aumento en la frecuencia cardiaca y respiratoria, e incremento de estado de alerta; además, se libera la hormona liberadora de corticotropina (CRH) desde el hipotálamo, que activa la glándula pituitaria o hipófisis para que libere la hormona adenocorticotropina (ACTH) y finalmente ésta actúa sobre la corteza de la glándula adrenal para que libere glucocorticoides (GC), mediante la absorción de colesterol y su conversión enzimática a cortisol y corticosterona. Los efectos de estas hormonas van dirigidos a aumentar la disponibilidad de energía en determinadas partes del organismo, y permitir así una adaptación óptima a las demandas cambiantes del ambiente.47,48 Juegan un papel importante en la gluconeogénesis mediante la estimulación del hígado, para convertir las grasas y proteínas en metabolitos intermedios que finalmente se convierten en glucosa para obtener energía.40 Los glucocorticoides inhiben directamente la secreción de gonadotropina hipofisaria, GH y TSH, y hacen que los tejidos diana de esteroides sexuales y factores de crecimiento, sean resistentes a estas sustancias y supriman la deiodinasa 50, que convierte la tetraiodotironina relativamente inactiva (T4) en triyodotironina (T3), contribuyendo además de la supresión de las funciones reproductivas, del crecimiento y de la tiroides.40 Además, los glucocorticoides apoyan la gluconeogénesis, a través de la síntesis y la acción de la epinefrina (adrenalina), la cual también estimula la lipólisis, movilizando reservas de energía para la realización de las conductas antidepredatorias oportunas.48 En diversos trabajos se ha documentado que las conductas antidepredatorias que realizan las salamandras, se centran en la huida o el quedarse estáticas, adoptando posturas que permiten al individuo ser menos conspicuo; un ejemplo es aplastar el cuerpo contra el suelo, mientras mantienen las extremidades pegadas al tronco.19-21,49,50
En conclusión, el reconocimiento de depredadores a través del olfato es un proceso amplio y complejo que involucra distintos componentes externos e internos al individuo; puede destacarse el óptimo funcionamiento de los sistemas sensoriales, el sistema nervioso autónomo y el sistema endócrino. La detección de los depredadores muestra la capacidad de aprender nueva información, almacenarla y evocarla cada vez que sea necesaria, para aumentar la eficiencia de la respuesta ante situaciones de peligro, modulando la intensidad y el tipo de respuesta, y así aumentar la probabilidad de éxito de supervivencia de los individuos.
Al CONACyT, por la beca número 611077 otorgada a IAERH.
Los autores declaran no tener ningún tipo de conflicto de intereses.
- Bradbury J., Vehrencamp S. Principles of animal communication. Sinauer Associates, Inc. Massachusetts. 1998 pp 279-318.
- Rajchard J. Antipredator pheromones in amphibians: a review. Vet Med-Czech. 2006 51(8): 409-413. Front Neurosci 2013 7: 130.
- Meredith M. Sensory processing in the main and accessory olfactory systems: comparisons and contrasts. J. Steroid Biochem. Mol. Biol. 1991 39: 601-614.
- Schmidt A, Naujoks-Manteuffel C, Roth G. Olfactory and vomeronasal projections and the pathway of the nervus terminalis in ten species of salamanders. Cell Tissue. Res. 1988 251(1): 45-50.
- Thomas RS, Glen DM, Symondson WOC. Prey detection through olfaction by the soil-dwelling larvae of the carabid predator Pterostichus melanarius. Soil Biol. Biochem. 2008 40: 207-216.
- Wisenden B D. Olfactory assessment of predation risk in the aquatic environment. Phil. Trans. R. Soc. Lond. 2000 355: 1205-1208.
- Apfelbach R, Blanchard CD, Blanchard RJ, Hayes RA, McGregor IS. The effects of predator odors in mammalian prey species: a review of field and laboratory studies. Neurosci. Biobehav. Rev. 2005 29: 1123-1144.
- Gillette JR. Odor discrimination in the California slender salamander, Batrachoseps attenuatus: evidence for self-recognition. Herpetologica 2002 58: 165-170.
- Placyk Jr JS, Graves BM. Foraging behavior of the red-backed salamander (Plethodon cinereus) under various lighting conditions. J. Herpetol. 2001 35: 521-524.
- Marvin GA, Davis K, Dawson J. Effect of acute low body temperature on predatory behavior and prey-capture efficiency in a plethodontid salamander. Physiol Behav. 2016 158:121-127.
- Telfer AC, Laberge F. Responses of Eastern red-backed salamanders (Plethodon cinereus) to chemical cues of prey presented in soluble and volatile forms. Physiol Behav 2013 115:6-13.
- Davis DR, Gabor CR. Behavioral and physiological antipredator responses of the San Marcos salamander, Eurycea nana. Physiol Behav 2015 139: 145-9.
- Wells K. The ecology and behavior of amphibians. The University of Chicago Press. Chicago 2007 417 - 418.Stress and depression-induced immune dysfunction: implications for the development and progression of cancer. INT REV PSYCHIATR 2005 17: 515-27.
- Lima S, Dill L. Behavioral decisions made under the risk of predation – a review and prospectus. Can J Zool. 1990 68: 619–640.
- Brodie, Jr. ED. Antipredator adaptations of salamanders: Evolution and convergence among terrestrial species. En: Margaris, NS, Arianoutsou-Faraggitaki A and Reiter RJ. Plant, animal, and microbial adaptations to terrestrial environment. Plenum Publishing Corp. 1983 109-133. ¿CLIN CHILD FAM PSYCH 2005 8: 89-105.
- Kuchta S, Krakauer A, Sinervo B. Why does the Yellow-eyed Ensatina have yellow eyes? Batesian mimicry of Pacific newts (genus Taricha) by the salamander Ensatina eschscholtzii xanthoptica. Evolution 2008 62: 984-990.
- Toledo L, Sazima I, Haddad C. Behavioural defences of anurans: an overview. Ethol Ecol Evol. 2011 23: 1 - 25.
- Caldwell P, Thorp JH, Jervey TO. Predator-prey relationships among larval dragonflies, salamanders and frogs. Oecologia 1980 46: 285-289.http://apps.who.int/iris/bitstream/10665/43770/1/9789243591650_spa.pdf
- Crane A, McGrane C, Mathis A. Behavioral and physiological responses of ozark zigzag salamanders to stimuli from an invasive predator: the armadillo. Int J Ecol. 2012 2012: 1-7.
- Sullivan A, Madison D, Rohr J. Behavioural responses by red-backed salamanders to conspecific and heterospecific cues. Behaviour 2003 140: 553-564.
- Sullivan A, Madison D, Rohr J. Variation in the antipredator responses of three sympatric plethodontid salamanders to predator-diet cues. Herpetologica 2004 60(4): 401-408.
- Ferrari MC, Brown GE, Messier F, Chivers DP. Threat-sensitive generalization of predator recognition by larval amphibians. Behav Ecol Sociobiol. 2009 63(9): 1369-1375.
- Ferrari MC, Wisenden BD, Chivers DP. Chemical ecology of predator–prey interactions in aquatic ecosystems: a review and prospectus. The present review is one in the special series of reviews on animal–plant interactions. Can J Zool. 2010 88(7): 698-724.
- Ferrari MC, Messier, F, Chivers DP. First documentation of cultural transmission of predator recognition by larval amphibians. Ethology 2007 113(6): 621-627.
- Marvin G, Whitekiller R, Hutchison V. Avoidance of alarm chemicals by plethodontid salamanders (Genus Eurycea): Importance of Phylogeny, Ecology, and Methodology. Herpetologica 2004 60(1): 24-33.
- Chivers DP, Ferrari MC. Social learning of predators by tadpoles: does food restriction alter the efficacy of tutors as information sources? Anim Behav. 2014 89: 93-97. Biol Psychol 2016.
- Ferrari MC, Vrtělová J, Brown GE, Chivers DP. Understanding the role of uncertainty on learning and retention of predator information. Compar. Cogn. 2012 15(5): 807-813.
- Ferrari MC, Brown GE, Bortolotti GR., Chivers DP. Linking predator risk and uncertainty to adaptive forgetting: a theoretical framework and empirical test using tadpoles. Proc R Soc. Lond. B Biol Sci. 2010: 2205-2210.
- Nevitt GA. Olfactory foraging by antarctic procellariiform seabirds: life at High Reynolds numbers. Biol Bull. 2000 198: 245-253.
- Placyk Jr JS, Graves BM. Prey detection by vomeronasal chemoreception in a plethodontid salamander. J Chem Ecol. 2002 28: 1017-1036.
- Catania KC, Hare JF, Campbell KL. Water shrews detect movement, shape, and smell to find prey underwater. Proc Nat Acad Sci. 2008 105: 571-576.
- Chivers DP, Smith RJF. Free-living fathead minnows rapidly learn to recognize pike as predators. J Fish Biol. 1995 46:949-954.
- Madison DM, Maerz JC, McDarby JD. Chemosensory avoidance of snake odors by salamanders: freeze and flight contingencies. En: Johnston RE, Müller-Schwarze D, Sorensen P. Advances in chemical communication in vertebrates. Kluwer Academic/Plenum Press 1999 508-516.
- Dawley E M, Bass A H. Chemical access to the vomeronasal organs of a plethodontid salamander. J Morphol. 1989 200 (2): 163-174.
- Vitt L, Caldwell J. Herpetology. An introductory biology of amphibians and reptiles. Academic Press China 2014 70-71.
- Buck L. Axel R. A novel multigene family may encode odorant receptors: a molecular basis for odor recognition. Cell 1991 65: 175-187.
- Laberge F, Hara TJ. Neurobiology of fish olfaction: a review. Brain Res Rev. 2001 36: 46- 59.
- Dawley E, Bass A. Organization of the vomeronasal organ in a plethodontid salamander. J Morphol. 1988 198: 243 - 255.
- Dawley EM. Correlation of salamander vomeronasal and main olfactory system anatomy with habitat and sex: behavioral interpretations. En: Doty RL, Müller-Schwarze. Chemical Signals in Vertebrates VI. Plenum Press 1992 403-409.
- Tsigos C, Chrousos G. Hypothalamic–pituitary–adrenal axis, neuroendocrine factors and stress. J Psychosom Res. 2002 53: 865 - 871.
- Dennis JC, Aono S, Vodyanoy J, Morrison ED. Development, morphology, and functional anatomy of the olfactory epithelium. En: Handbook of olfaction and gustation (Ed. R.L. Doty). Publisher John Wiley & Sons, Inc. 2015 93-121.
- Kandel ER, Schwartz JH, Jessell TM, Agud JL. Principios de neurociencia. McGraw-Hill Interamericana, Madrid. 2001 pp 625-633.
- Laberge F, Roth G. Connectivity and cytoarchitecture of the ventral telencephalon in the salamander Plethodon shermani. J Comp Neurol. 2005 482(2): 176-200.
- Laberge F, Mühlenbrock-Lenter S, Grunwald W, Roth G. Evolution of the amygdala: new insights from studies in amphibians. Brain Behav Evol. 2006 67(4): 177-187.
- Amaral DG. The amygdala, social behavior, and danger detection. Ann NY Acad Sci. 2003 1000(1): 337-347.
- Davis M. The role of the amygdala in fear and anxiety. Annu Rev Neurosci. 1992 15: 353-75.
- Martínez S. Eje hipotálamo-hipofisario-adrenal. En: Martínez S. Hormonas, Estado de ánimo y función cognitiva. Publicaciones Delta. 2007 41-51.
- Matteri R, Carrol J, Dyer C. Neuroendocrine responses to stress. En: Moberg G y Mench J. The biology of animal stress. Basic principles and implications for animal welfare. CABI publishing 2000 43-76.
- Boyd, T., McGoldrick, J., Michanowicz, A., Thomas, R. Chemosensory adaptation in antipredator responses of common Pennsylvania salamanders. J Ecol Res. 2006 8: 9-14.
- Sullivan A, Maerz J, Madison D. Anti-predator response of red-backed salamanders (Plethodon cinereus) to chemical cues from garter snakes (Thamnophis sirtalis): laboratory and field experiments. Behav Ecol Sociobiol. 2002 51: 227–233.
| Recibido: 19 de septiembre de 2017 | Aceptado: 28 de noviembre de 2017 |
Jorge E. Morales Mávil, Instituto de Neuroetología, Universidad Veracruzana. Avenida Dr. Luis Castelazo s/n, Col. Industrial Ánimas, Km. 3.5, Carretera Xalapa-Veracruz, C.P. 91190, Xalapa, Veracruz, México. Teléfono: +52 (228) 8418900 Ext. 13629. Fax: +52 (228) 8418920. Correo electrónico: jormorales@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
