Distancia espacial de dos grupos de mono aullador de manto en función de la estacionalidad
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Quintana Morales Paulo C1*, Carmona Díaz Gustavo2, López-Galindo Adolfo1, Morales Mávil Jorge E1, Hernández-Salazar Laura T1
1Laboratorio de Biología de la Conducta, Instituto de Neuroetología, Universidad Veracruzana. 2Facultad de Ingeniería en Sistemas de Producción Agropecuaria, Universidad Veracruzana.
Resumen/Abstract
Introducción
Material y métodos
Resultados
Discusión
Conclusión
Agradecimientos
Referencias
Correspondencia
La fragmentación y pérdida del hábitat reducen las opciones alimenticias para los primates y alteran la dinámica social al interior de una población. Los monos aulladores de manto (Alouatta palliata mexicana) no son una especie territorial y, pocas veces se ha descrito la coexistencia de grupos en fragmentos de selva pequeños. Se ha planteado que la interacción espacial permite a los individuos ajustar conductualmente sus movimientos y mantener una coexistencia entre grupos. No obstante, no se conocen cuáles son las condiciones ambientales que regulan esta interacción. En este estudio se determinó la influencia del ambiente sobre la distancia entre dos grupos de monos aulladores. A partir de 950 horas de observación, se analizó la distancia intergrupal que fue de 288.7 ± 114.1 m, la cual se correlacionó con el número de especies arbóreas con frutos maduros y seniles, y con la temperatura mensual (Spearman, R= -0.63, P = 0.026; R= -0.68, P = 0.012; R = -0.57, P = 0.04; respectivamente). Se concluye que los monos ajustan sus movimientos grupales para buscar elementos vegetales que son parte de su dieta y evitar su exposición a altas temperaturas. Este estudio permite abordar de una manera más precisa los ajustes conductuales que hacen los monos en respuesta a los cambios ambientales.
Palabras clave: Los Tuxtlas, Interacciones intergrupales, Frutos, Fenología, Factores climáticos.
Landscape fragmentation and loss of habitat diminish the food options for the primates and alters the social dynamics within a population. Mantled howler monkey (Alouatta palliata mexicana) is not a territorial species, but the coexistence of its groups in small fragments has rarely been described. It has been proposed that spatial interaction allows individuals to behaviorally adjust their movements and to allow the coexistence of multiple groups. However, it is not clear what the environmental conditions that regulate this interaction are. We examined whether environmental factors may influence spatial dynamics between two groups of howler monkeys. We collected data during 950 observation hours through behavioral sampling, and we analyzed the distance between groups. The intergroup distance (288.7 ± 114.1 m) was negatively correlated with the number of tree species with mature and senile fruits, and the monthly temperature (Spearman, R = -0.63, P = 0.026; R = -0.68, P = 0.012; R = -0.57, P = 0.04, respectively). We conclude that monkeys adjust their group movements to look for items that are part of their diet and, to avoid to be exposed to high temperatures. These findings allow us to more accurately address the behavioral adjustments that monkeys made in response to food items and environmental changes.
Keywords: Los Tuxtlas, Intergroup interactions, Fruits, Phenology, Climate factors.
La estacionalidad ambiental es uno de los factores que determinan el uso del espacio y el aprovechamiento de los recursos en el hábitat por parte de los primates.1 Dicho factor conlleva una variación en componentes ambientales como la precipitación, la temperatura, o la radiación solar, los cuales influyen en la fenología de los árboles tropicales.2,3 Ocurre una variación en la fenología como producción de hojas, flores y frutos durante el año, aunque no necesariamente de manera sincrónica; como sucede para algunas especies de la familia Moraceae.4
La estacionalidad determina también la variación en la temperatura y la humedad durante el año. Aunque hay pocos trabajos que relacionan estas variables con la conducta de los primates, se tiene evidencia de que pueden incidir sobre la ecología del comportamiento de algunos primates de la familia Atelidae.5 Además, se ha señalado que la radiación solar y la velocidad del viento, promueven una serie de cambios fisiológicos y conductuales en la termorregulación de los primates.6 Por ejemplo, en los monos aulladores, particularmente en el caso de Alouatta caraya, estas variables climáticas determinan algunas estrategias como posturas para conservar el calor, la búsqueda de sitios soleados o la baja exposición ventral en determinadas circunstancias durante el descanso.7 Esto refleja la importancia de las variables climáticas en la conducta de estos primates y permite generar cuestionamientos acerca de su influencia en un contexto de conducta grupal relacionado con el uso del espacio.
En este escenario de cambios estacionales, los primates encuentran alimento distribuido de manera heterogénea, en forma de parches alimenticios distanciados en el tiempo y el espacio.5Condiciones que promueven competencia por el alimento, especialmente al tratarse de elementos vegetales importantes para la dieta de los individuos como flores o frutos.8 Esta competencia ejerce una presión en una población de primates tanto al interior de los grupos como entre diferentes grupos de la población. Al respecto, los grupos de algunas especies establecen y defienden territorios como en el caso de Indri indri, Cercophitecus aethiops, Lemmur catta y Pan paniscus.9,10 En contraste, especies como Colobus guereza,11 Callicebus Moloch,12 Callicebus turquatus,13 Hylobathes lar,14 Callithrix jacchus,15,16 y Alouatta sp.17,18 utilizan vocalizaciones para mantener un espaciamiento entre los grupos.
En el caso particular del género Alouatta, aun cuando implementan este tipo de mecanismos de defensa de sus recursos, los grupos frecuentemente presentan traslape en sus ámbitos hogareños.19,20-22 Esto implica una interacción espacial y posibles procesos para tolerarse mutuamente a lo largo de su vida.
La interacción espacial de grupos de monos A. palliata y los mecanismos que permiten la tolerancia entre los grupos, ha sido poco estudiada. En principio, poco se conoce sobre la distancia intergrupal necesaria que debe existir entre grupos vecinos de monos aulladores en condiciones de hábitat restringido espacialmente. Además, se ha indicado que la jerarquía de dominancia y la variación estacional, influyen en el acercamiento entre grupos de diferente tamaño.23
La evidencia relacionada con este tipo de interacciones, las estimaciones y revisiones sobre el tema del uso del espacio,24 muestran una falta de consenso sobre cómo y cuándo los grupos de monos aulladores A. palliata traslapan su ámbito hogareño o a qué distancia se localizan entre sí. Adicionalmente, muchos de los estudios han sido realizados en hábitat continuo (reservas con una extensión no menor a 100 ha) y se desconoce si el tamaño reducido de hábitat y la densidad poblacional influyen en la interacción espacial. Por lo que se ha sugerido que el tamaño del hábitat es un factor decisivo para su ocupación por parte de grupos de monos aulladores, pues se han detectado umbrales en el tamaño y estructura de la vegetación dentro del fragmento de selva para que sean utilizados por los primates.25-27
Por consiguiente, es posible que la estacionalidad, reflejada tanto en los procesos fenológicos de la vegetación como en las variables climáticas como la temperatura y la precipitación, repercuta en un mayor o menor desplazamiento de los grupos. En este trabajo se analiza si el espaciamiento de grupos de monos aulladores, Alouatta palliata mexicana está relacionado con las variables ambientales del sitio (fenología y variables climáticas). La hipótesis de trabajo plantea que los patrones de cercanía entre grupos vecinos, asociados con la búsqueda de alimento de mayor calidad, varían estacionalmente y son influenciados por las mismas variables climáticas como la temperatura o la precipitación. Se predice que el distanciamiento intergrupal debería variar a consecuencia de la disponibilidad de alimento y las variaciones climáticas.
2.1. Sujetos y zona de estudio
Estudiamos dos grupos de monos Alouatta palliata mexicana, cada uno formado por 27 y 29 individuos, siendo estos los grupos G1 y G2, respectivamente. Estos grupos conforman una población que habita un fragmento de selva en la isla Agaltepec en Los Tuxtlas, Veracruz, México (Fig. 1). El sitio se ubica entre las coordenadas 90° 25' 30” N - 90° 25' 30” y 28° 40' 56” W - 28° 40' 56”. La superficie de la isla consta de 8.3 ha y está cubierta en su mayor parte por selva mediana subcaducifolia. Además, tiene vegetación riparia, vegetación secundaria y una mínima porción de pastizal remanente, equivalente a no mayor al 3% aproximadamente. La vegetación arbórea consta de 107 especies pertenecientes a 51 familias y 97 géneros.28 Su densidad poblacional es equivalente a 11.4 ind/ha. Asimismo, el tipo de clima es el cálido húmedo, subtipo Am,29 la temperatura promedio anual es de 21.3 ºC, con una máxima de 28 ºC y una mínima de 19.0 ºC, y la precipitación promedio por año es de 2,037 mm,30 siendo febrero, marzo, abril y mayo los meses más secos.
2.2. Registro de ubicación y distanciamiento intergrupal
Durante 2010 (agosto – diciembre), 2011 (enero – junio, agosto – octubre, y diciembre) y 2012 (enero – marzo, y mayo) se registró de 07:00 a 12:00 y de 12:00 a 17:00 h (alternadamente) la ubicación de los grupos. Los dos grupos se observaron simultáneamente, cinco días por mes. Al final del estudio se lograron obtener 950 horas de registro. Los datos se registraron mediante coordenadas UTM de los grupos, obtenidas mediante un sistema de geoposicionamiento global portátil marca Garmin modelo 60csx. La distancia entre los grupos se estimó mediante la distancia en línea recta entre la posición geográfica simultánea de los grupos. La posición geográfica de cada grupo se obtuvo a través del promedio de las coordenadas de los árboles ocupados por los integrantes del grupo en un mismo periodo. Los árboles fueron marcado y georreferenciados una sola vez durante todo el estudio, a fin de que, el error propio del equipo de geoposicionamiento, no se acumulara y ocasionara variación en los datos geográficos. Las posiciones geográficas de los grupos debían ser simultáneas, ya sea al iniciar el muestreo o al final de su seguimiento diario, o en cualquier otra hora dentro del periodo de muestreo, pero siempre de forma simultánea.
Figura 1. Representación de la isla Agaltepec.
Tabla 1. Se muestran las especies que fueron monitoreadas para el registro de presencia de frutos.
Anacardiaceae |
Moraceae |
Astronium graveolens Jacq. |
Brosimum alicastrum Sw. |
Spondias mombin L. |
Chlorophora tinctoria (L.) Gaudish. |
Spondias radlkoferi Smith |
Ficus cotinifolia Kunth |
Anonaceae |
Ficus lundelli Standl. |
Annona reticulata L. |
Ficus maxima Miller |
Rollinia mucosa (Jacq). Baill |
Ficus obtusifolia Kunth |
Araliceae |
Ficus perforata L. |
Dendropanax arboreus (L.) Decne. & Planchon |
Ficus pertusa L. |
Burseraceae |
Ficus trigonata L. |
Bursera simaruba (L.) Sarg. |
Ficus tuerckheimii Standley |
Protium copal (Schdl. & Cham.) Engel. |
Sapotaceae |
Fabaceae |
Manilkara zapota (L.) van Royen |
Andira galeottiana Standl. |
Sideroxylon capiri (A. DC.) Pittier |
Gliricidia sepium (Jacq.) Steudel |
Sterculiaceae |
Leucaena leucocephala (Lam.) de Wit |
Guazuma ulmifolia Lambert |
Lonchocarpus cruentus Lundell |
Urticaceae |
|
Myriocarpa cordifolia Liebm. |
2.3. Proceso fenológico (frutos)
Se registró la presencia de frutos en 26 especies vegetales arbóreas (Tabla 1), reportadas con alto consumo por parte de los monos aulladores.31Además, periódicamente a 188 árboles adultos se les registró las fases fenológicas32 cada 15 días, a lo largo de un año (febrero de 2012 - enero de 2013), midiendo la presencia de frutos en tres estadios de maduración: inmaduro, maduro y senil.33,34 Estos datos fueron registrados mediante el uso de binoculares de 10 x 25 mm marca Mizar, modelo Matot-1025 Advanced, dentro de un radio de 8 m del tronco del árbol y a 25 m de distancia máxima entre el observador y la parte vegetal registrada. Se contabilizó mensualmente el número de árboles en cada una de las etapas de maduración antes mencionadas. Adicionalmente, se analizó la relación entre la fenología y los factores climáticos con el espaciamiento de los grupos. Para ello, se utilizaron los datos disponibles más inmediatos al periodo de muestreo, siendo esta la información de las variables climáticas de la base de datos de la Comisión Nacional del Agua. Los datos corresponden a la estación meteorológica instalada en la ciudad de Catemaco, de precipitación y temperatura promedio mensual de los años 2000 al 2010.30
2.4. Análisis de datos
La asociación de la distancia intergrupal mensual y el número de especies alimenticias, con frutos y con la temperatura y precipitación promedio, fueron relacionadas con el coeficiente de correlación de Spearman. Se utilizó este coeficiente debido a que las pruebas de normalidad de Shapiro-Wilk señalaron una falta de normalidad en los datos. Los resultados de las pruebas estadísticas, así como las estadísticas descriptivas, se expresan en términos de media y desviación estándar (media ± D. E.). Los análisis espaciales y pruebas estadísticas se realizaron en los programas ArcView© v.3.235 y Statistica v 7.0.36
3.1. Distancia intergrupal y fenología
En la Figura 2, se ilustra la ubicación de ambos grupos durante los meses del año en el sitio de estudio. Mediante la distribución de sus ubicaciones, se determinó que la distancia entre los grupos fue de 288.7 ± 114.1 m. Además, los meses en donde hubo una menor distancia promedio fueron los meses de mayo a agosto con 161.8 ± 17.4 m, mientras que la mayor distancia intergrupal se registró en el mes de noviembre con 379.5 ± 79.2 m (Fig. 3).
El número de especies al mes, con frutos inmaduros, maduros y seniles fue, 4.5 ± 3.8, 6.0 ± 4.4 y 7.1 ± 4.6, respectivamente. Asimismo, los meses en donde hubo un mayor número de especies con frutos inmaduros, maduros y seniles fueron junio, julio y agosto, respectivamente. En contraste, los meses con el menor número de especies fueron, de octubre a enero, con cero especies con frutos inmaduros; diciembre a enero, con cero especies con frutos maduros; y diciembre a enero con una sola especie con frutos seniles. Los meses en que la distancia promedio fue menor (mayo – agosto) coinciden con el periodo en donde comienza el declive en el número de especies con frutos inmaduros y en donde comienza el aumento en el número de especies con frutos maduros y seniles (Fig. 4). Por otra parte, el coeficiente de Spearman indica una correlación inversa entre la distancia intergrupal y el número de especies con frutos maduros (R= -0.63, P = 0.026) y la asociación con los frutos seniles (R= -0.68, P = 0.012). En el caso de frutos inmaduros, no hubo correlación (R = -0.40, P = 0.173, Fig. 5 a y b).
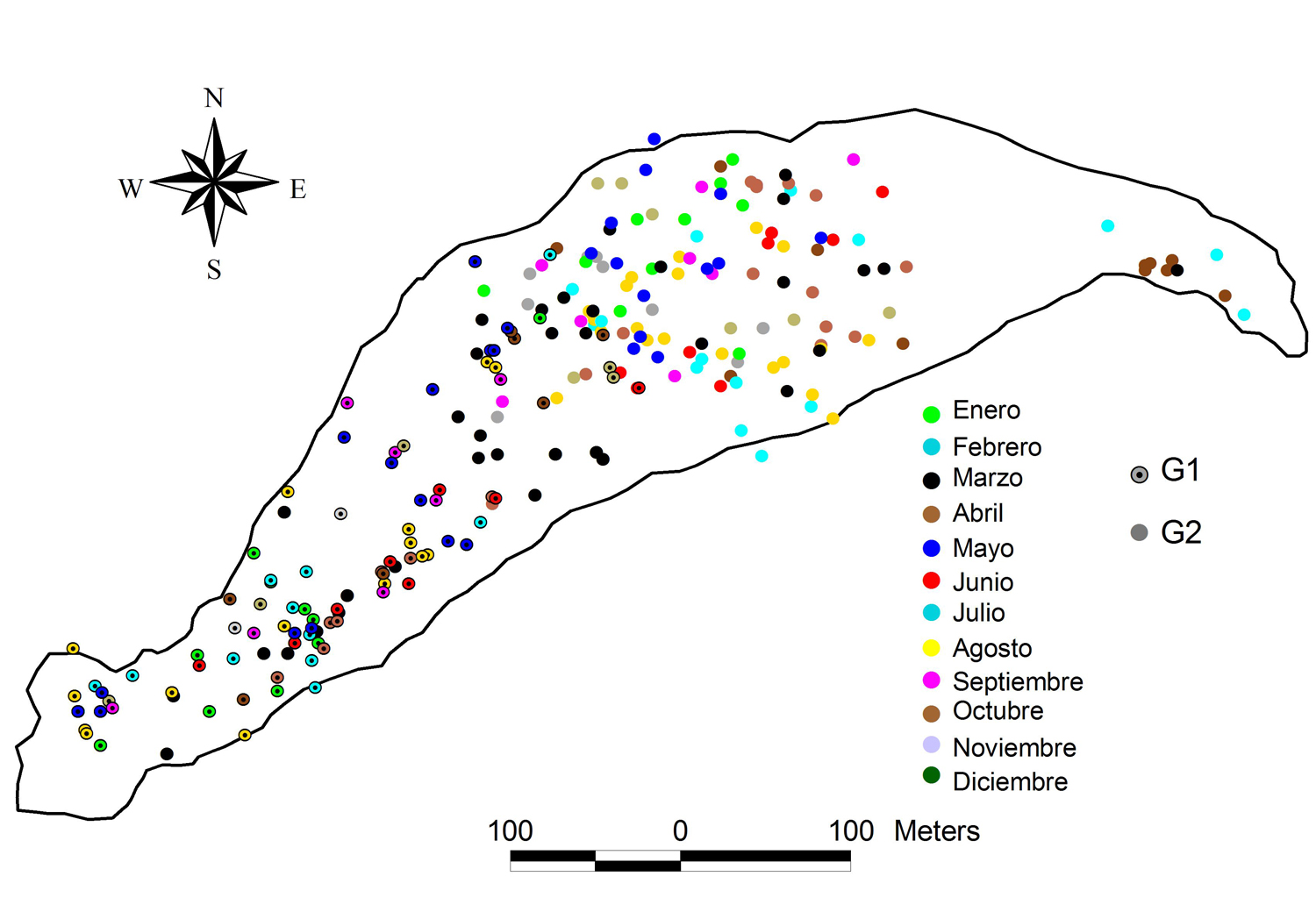
Figura 2. Se observa la ubicación de los grupos a lo largo del año en la isla Agaltepec.
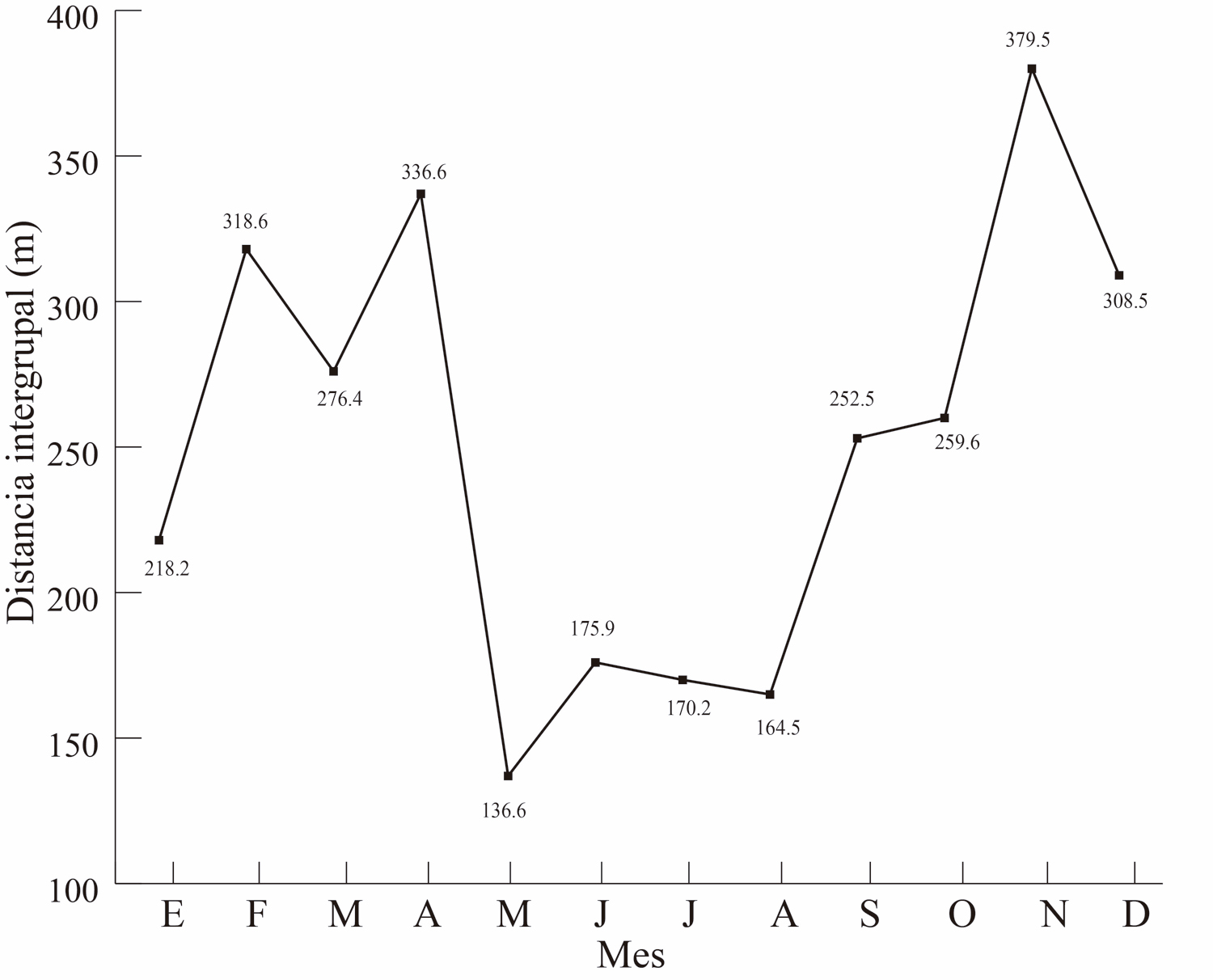
Figura 3. Se muestra cómo se comporta la distancia intergrupal durante los meses del año.
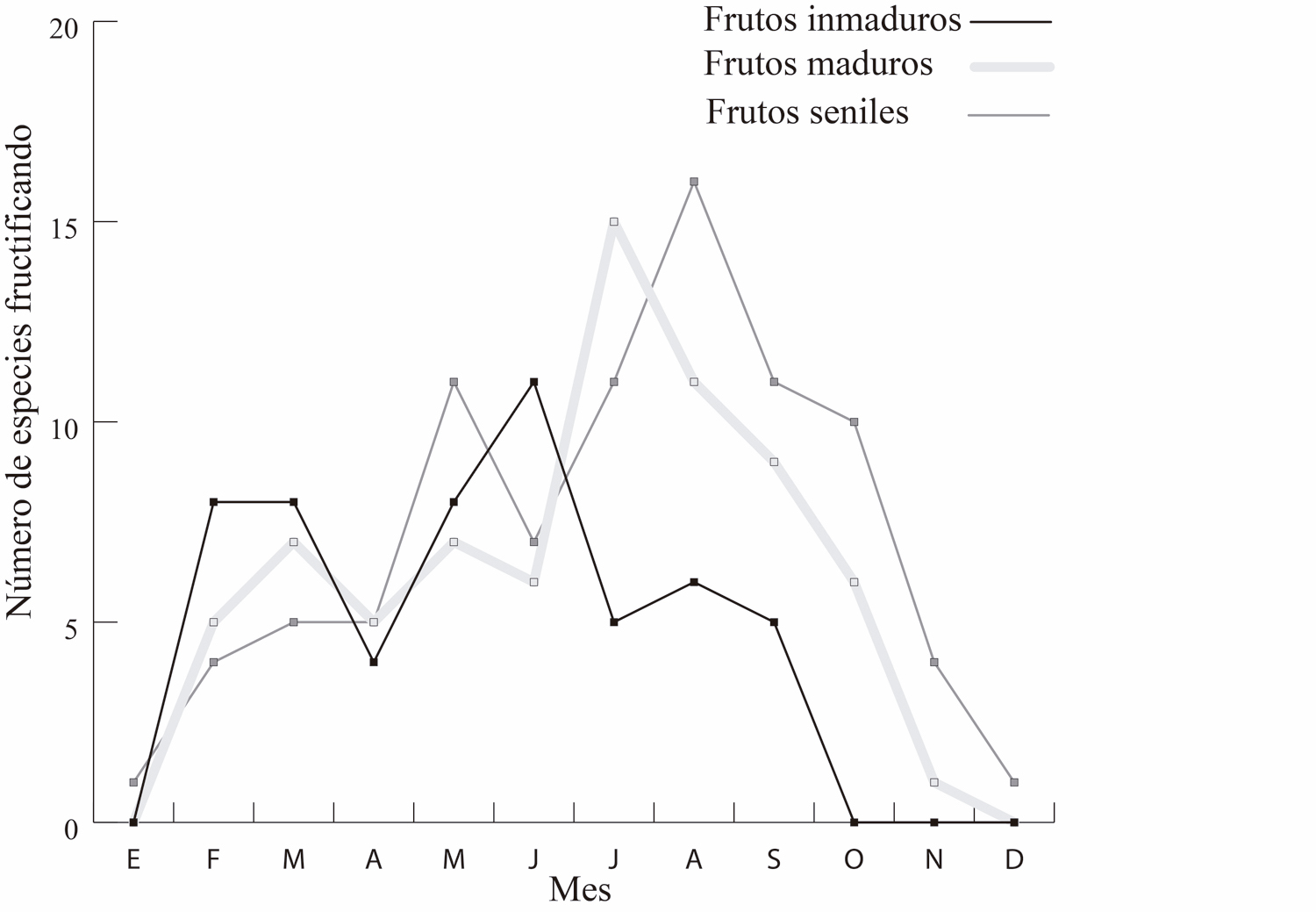
Figura 4. Se aprecia la variación del ciclo de producción de frutos para las especies arbóreas observadas.
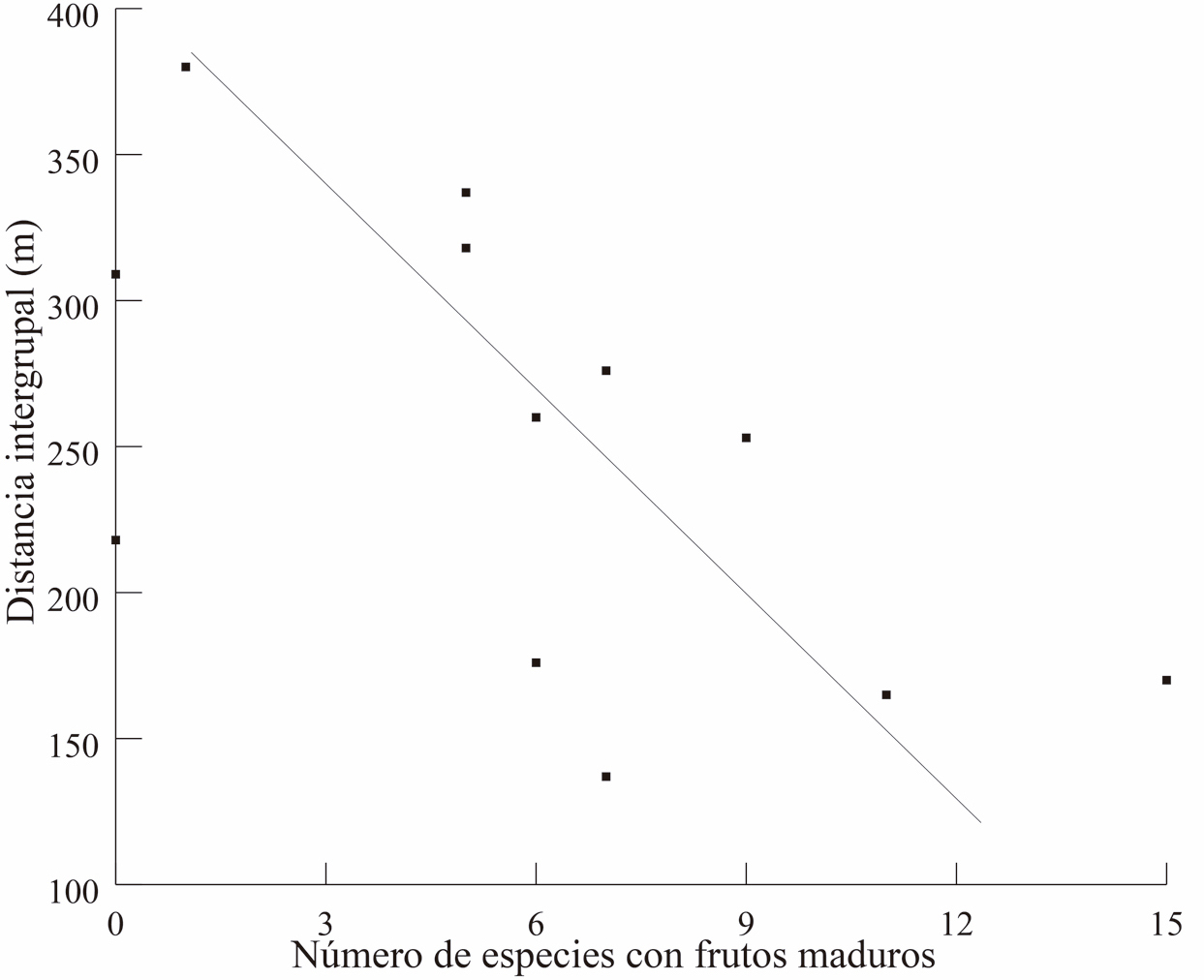
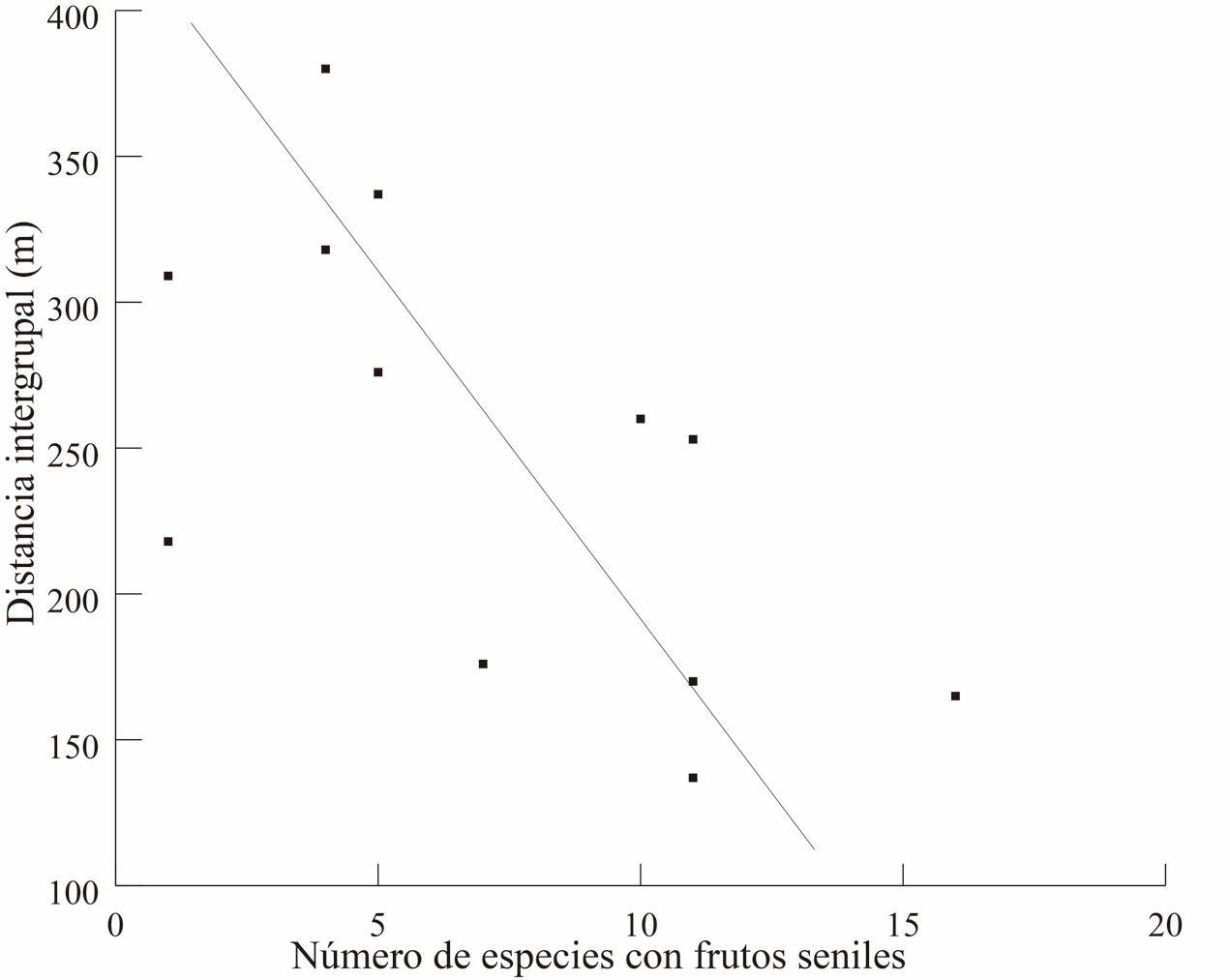
Figura 5. Muestra la correlación entre la precencia de frutos maduros (superior 5A) y frutos seniles (inferior 5B) con la distancia entre los grupos a lo largo de los meses del año.
3.2. Distancia intergrupal y variables climáticas
La temperatura promedio del ambiente relacionó con la distancia intergrupal (R = -0.57, P = 0.04), pero no hubo asociación con la precipitación (R = -0.39, P = 0.18, Fig. 6 a y b). En las Figura 7, se observa el comportamiento de estas dos variables climáticas en relación con la distancia entre los grupos a lo largo de los meses del año.
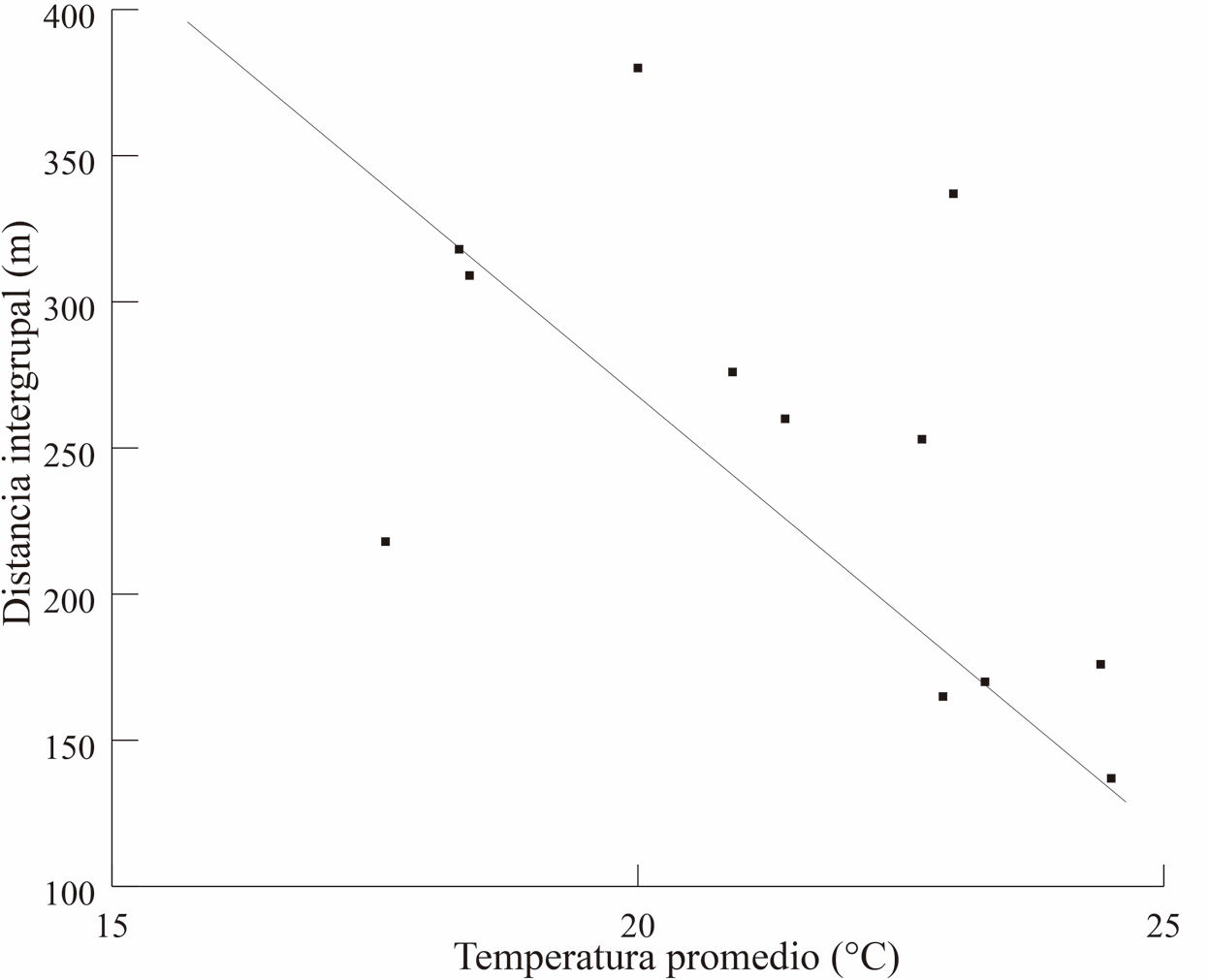
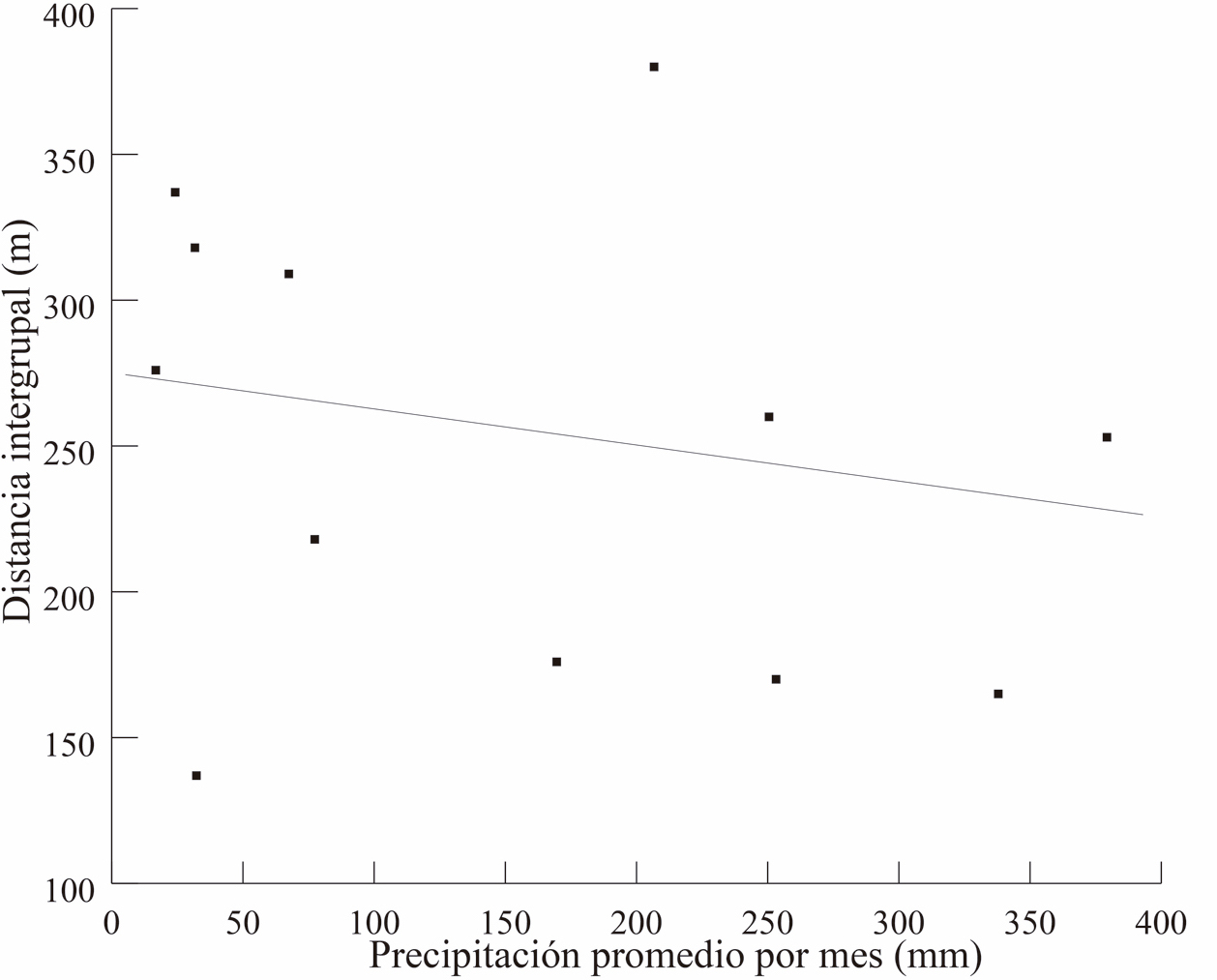
Figura 6. Temperatura (superior 6A) y precipitación (inferior 6B) a lo largo de los meses en relación con la distancia intergrupal a lo largo de los meses.
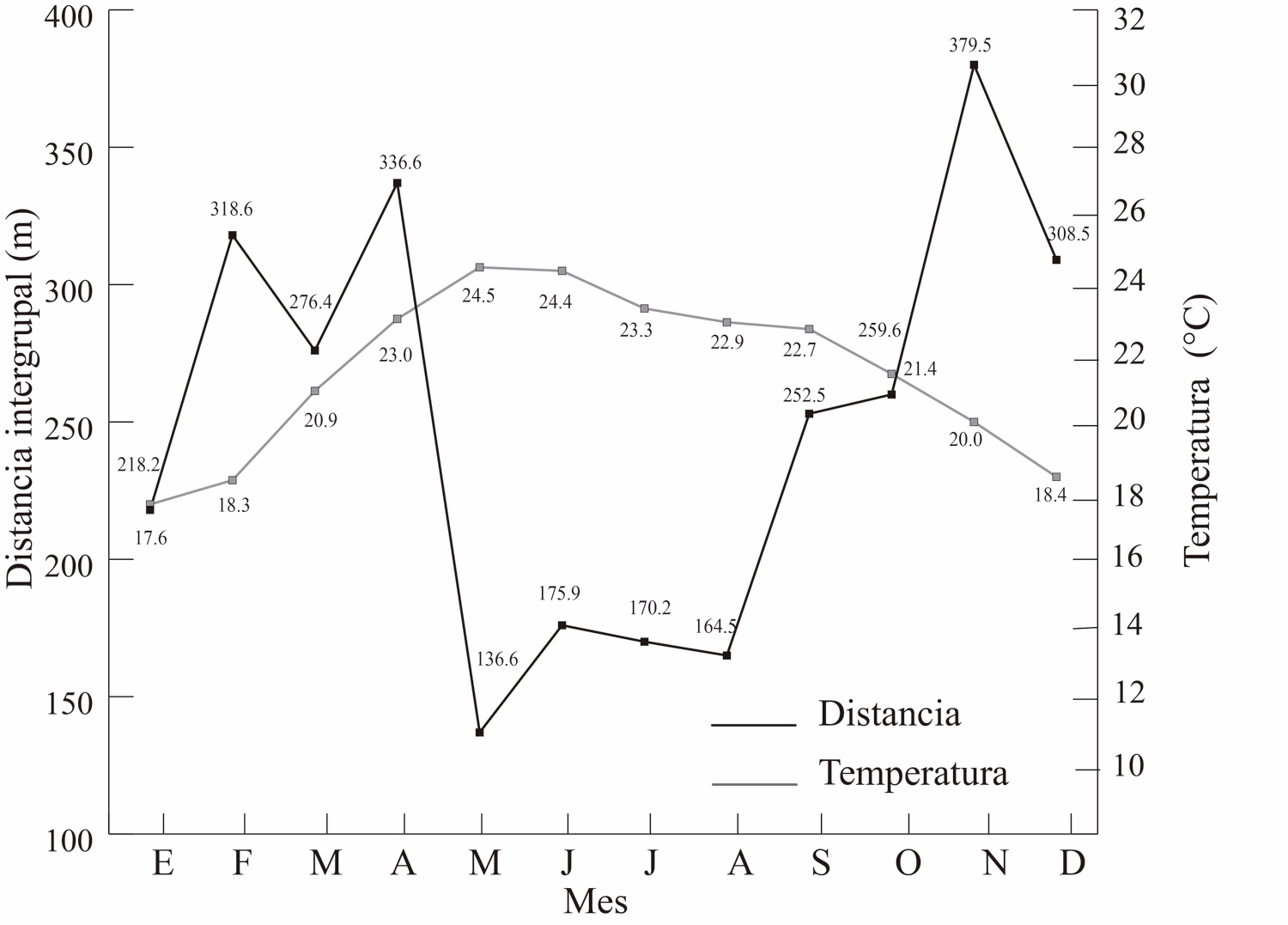
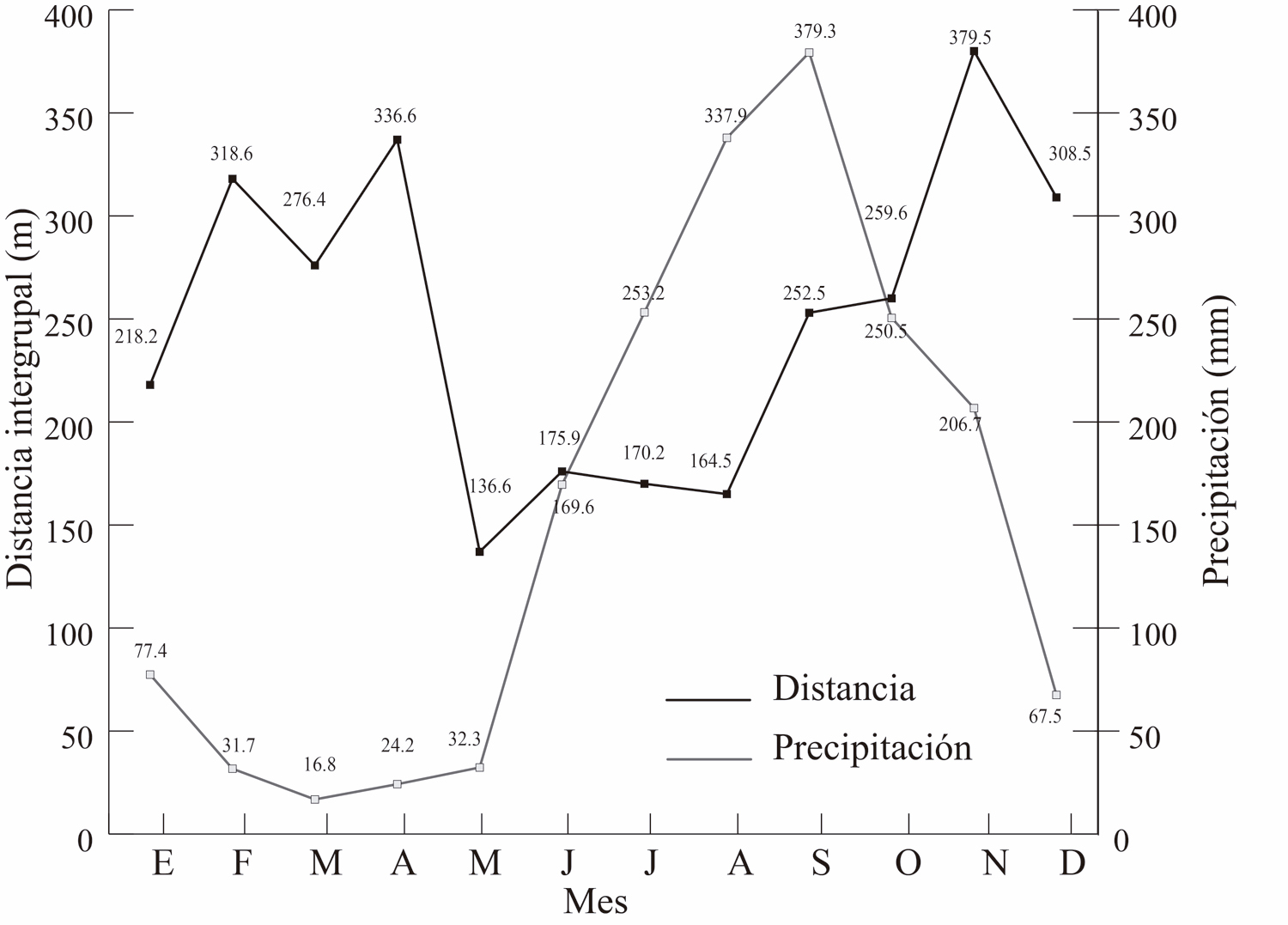
Figura 7. Se aprecia el comportamiento de las variables climática temperatura (superior 7A) y precipitación (inferior 7B) en relación con la distancia intergrupal a lo largo de los meses del año.
La variable climática con una mayor relación con la distancia intergrupal fue la temperatura. Esto implica que una temperatura ambiental baja, o el periodo del año en donde ocurren una temperatura más baja, se asocia con una mayor distancia entre los grupos. Por el contrario, un periodo, como la temporada seca, se asocia con un mayor acercamiento entre ellos.
Si bien es cierto, el objetivo de este trabajo no fue analizar el patrón de movimiento de los grupos, algunos trabajos aportan evidencias de la influencia de la temperatura ambiental en el desplazamiento de divesas especies de mamíferos ungulados como Cervus elaphus manitobensis, y Odocoileus virginianus.37 En el caso de los primates, se ha observado que la radiación solar, que en términos ecológicos está asociada con la temporada seca, está ligada con una disminución en los patrones de búsqueda de alimento.6 Esto puede ser el resultado de una estrategia de ahorro de energía por parte de los primates.
De manera específica, los efectos que tiene la temperatura ambiental en el metabolismo de los monos aulladores, y con ello en su conducta, ha sido poco abordada, sin embargo, se reconoce que el aumento en la temperatura ambiental modula los procesos conductuales de termorregulación (e.j. Alouatta caraya).7 Es probable que en Agaltepec, ciertas áreas, por su disponibilidad tanto de refugio como de alimento, sean prioritarias para los grupos durante la época de mayor temperatura a pesar de que los grupos deban tolerarse mutuamente.
Son pocos los estudios en donde se analiza las interacciones espaciales como la distancia entre grupos de monos A. palliata.17,23,24 En este trabajo se observó que los grupos se mantuvieron alejados a una distancia promedio, mayor a 120 m uno del otro. Al igual que el trabajo de Hopkins,23 en donde identifica características relativas a una jerarquía de dominancia por parte de grupos de Alouatta palliata, los eventos en donde los grupos estuvieron a una distancia igual o menor a 50 m, fueron poco frecuentes. Al respecto, los grupos de Agaltepec poseen un tamaño muy similar (27 y 29 individuos), por lo que no es factible determinar una relación de dominancia en esta población, al menos en términos de superioridad numérica o habilidades competitivas.18,39 El mayor acercamiento de los grupos sucedió al inicio de la fructificación (presencia de frutos inmaduros). Así mismo, los grupos estuvieron más alejados entre sí, cuando se presentó un menor número de especies con frutos inmaduros y más especies con frutos maduros. Sin embargo, la distancia intergrupal sólo estuvo asociada de manera negativa con la presencia de frutos maduros y seniles.
Para mantener un distanciamiento, los monos aulladores pueden estar utilizando en Agaltepec un mecanismo mediante el cual, los grupos se advierten mutuamente de su presencia, a fin de evitar encuentros agonísticos,37 tal como sucede con Alouatta pigra.38 Desde una perspectiva estrictamente espacial, A. palliata no es una especie territorial o no defiende de manera activa un territorio.19 Esta concepción acerca de la especie es relativa, ya que si bien los animales no se enfrentan de forma física entre los grupos, esta y otras especies de aulladores establecen su distancia a partir de sus vocalizaciones.18,23
Será importante analizar con mayor detalle el efecto de la presencia de frutos en las especies arbóreas de la isla Agaltepec sobre la dinámica del uso del espacio, se puede destacar que existe una tendencia significativa que contribuye a pensar que la fenología está relacionada con los patrones de uso del espacio, a nivel de grupo. Cabe mencionar, que actualmente, todos los individuos de la población son originarios del sitio de estudio, por lo que posiblemente conozcan tanto los recursos disponibles como sus procesos fenológicos. Será importante analizar en un futuro si la población utiliza esta información para equilibrar la competencia entre grupos, en un espacio relativamente pequeño. Este proceso cognitivo representa importantes ventajas, sobre todo para especies cuya interacción intergrupal está ligada a un proceso de tolerancia y advertencia,40 como sucede con este género de primates, a través del uso de vocalizaciones.
Por otra parte, dentro de los aspectos cognitivos de los primates, se ha señalado que el hecho de estructurar una representación mental del espacio en relación con los grupos vecinos, puede prevenir encuentros agonísticos y confrontaciones dañinas, mediante maniobras evasivas en el hábitat.41
Probablemente, la fisiología de los monos aulladores, que también está asociada con conductas como el descanso para conservar energía y aprovechar los nutrientes en los alimentos implica una menor tasa de desplazamiento dentro del hábitat,7,42 permaneciendo más cerca de su área de actividad y más alejados de los grupos vecinos. Esto resalta la importancia de estudiar la influencia de factores asociados al clima y al cambio climático sobre la conducta y supervivencia de la fauna silvestre.
Se puede concluir que la interacción espacial que se desarrolla entre dos grupos de monos aulladores dentro de un hábitat aislado y sin posibilidad de abandonarlo, requiere de un mecanismo de adaptación de la población. Dentro de este mecanismo influye de manera significativa las variables ambientales y ecológicas. De esta forma, los grupos utilizan el espacio disponible limitando los encuentros agonísticos, lo cual puede ser un factor clave para entender cómo la densidad poblacional del sitio ha llegado a ser de aproximadamente 1,140 ind/km2, sin que se haya observado enfrentamientos o agresiones entre individuos de los dos grupos. Será necesario analizar, además, si los grupos tienen a su disposición una diferente calidad y cantidad de alimentos dentro de sus áreas de actividad, ya que a pesar de ello, ambos grupos han logrado convivir de una manera ordenada espacialmente.
Esta investigación fue financiada por el Consejo Nacional de Ciencia y Tecnología con el apoyo No. 311405 para el trabajo de campo, técnico, de muestreo y logístico en la isla Agaltepec, en la ciudad de Catemaco.
Los autores declaran no tener conflictos de intereses.
- Van Schaik, CP, Brockman, DK. Seasonality in primate ecology, reproduction, and life history: an overview. En: Brockman DK and CP Schaik, Seasonality in primates, studies of living and extinct human and non-human primates. Cambridge University Press 2005 3-20.
- Wright SJ, Van Schaik CP. Light and phenology of tropical trees. Am Nat. 1994 143: 192-99.
- Sun C, Kaplin BA, Kristensen KA, Unyaligoga VM, Vukiyumwami JM, Kajondo KK, Moermond TC. Tree phenology in a tropical montane forest in Rwanda. Biotropica. 1996 28: 668–81.
- Muhanguzi HDR, Ipulet P. Fruiting phenology of fig trees in Kalinzu Forest, Uganda. Afr J Ecol. 2012 50: 90-101.
- González-Zamora A, Arroyo-Rodríguez V, Chávez OM, Sánchez-López S, Aureli F, Stoner KE. Influence of climatic variables, forest type, and condition on activity patterns of Geoffroyi’s spider monkeys throughout Mesoamerica. Am J Primatol. 2011 73: 1189-98.
- Hill RA, Weingrill T, Barrett L, Henzi SP. Indices of environmental temperatures for primates in open habitats. Primates. 2004 45: 7-13.
- Bicca-Marques J.C, Calegaro-Marques C. Behavioral thermoregulation in a sexually and developmentally dichromatic neotropical primate, the black-and-gold howling monkey (Alouatta caraya). Am J Phys Anthropol. 1998. 106: 533–546.
- Snaith TV, Chapman CA. Towards an ecological solution to the folivore paradox: patch depletion as an indicator of within-group scramble competition in red colobus monkeys (Piliocolobus tephrosceles). Behav Ecol Sociobiol. 2005 59: 185–90.
- Mitani JC, Rodman PS. Territoriality: the relation of ranging pattern and home range size to defendability, with an analysis of territoriality among primate species. Behav Ecol Sociobiol. 1979 5: 241-51.
- Herbinger I, Boesch C, Rothe H. Territory characteristics among three neighboring chimpanzee communities in the Taï National Park, Côte d'Ivoire. Int J Primatol. 2001 22: 143-67.
- Oates JF, Bocian CM, Terranova CJ. The loud calls of black-and-white colobus monkeys: new information and a reappraisal of their phylogenetic and functional significance. En: Whitehead PF and CJ Jolly, Old world monkeys, Cambridge University Press 2000 431-52.
- Robinson JG. An analysis of the organization of vocal communication in the titi monkey Callicebus moloch. Z Tierpsychol. 1979 49: 381-405.
- Kinzey WG, Robinson JG. Intergroup loud calls, range size, and spacing in Callicebus torquatus. Am J Phys Anthropol. 1983 60: 539-44.
- Cowlishaw G. Song function in gibbons. Behaviour. 1992 12: 131–53.
- Hubrecht RC. Home range size and use and territorial behavior in the common marmoset, Callithrix jacchus jacchus, at the Tapacura Field Station, Brazil. Int J Primatol. 1985 6: 533-50.
- Lazaro-Perea C. Intergroup interactions in wild common marmosets, Callithrix jaccus: territorial defense and assessment of neighbors. An Behav. 2001 62: 11-21.
- Whithead JM. Vocally mediated reciprocity between neighbouring groups of mantled howling monkeys, Alouatta palliata palliata. An Behav. 1987 35: 1615-27.
- Kitchen DM. Alpha male black howler responses to loud calls: effect of numeric odds, male companion behaviour and reproductive investment. An Behav. 2004 67: 125-39.
- Milton K. The foraging strategy of howler monkeys: a study in primate economics, Columbia University Press, New York. 1980.
- Baldwin JD, Baldwin JI. Population density and use of space in howling monkeys (Alouatta villosa) in southwestern Panama. Primates. 1972 13: 371–79.
- Zucker EL, Clarke MR, Glander KE, Scott Jr NJ. Sizes of home ranges and howling monkey groups at Hacienda La Pacifica, Costa Rica: 1972-1991. Brenesia. 1996 45/46: 153–56.
- Williams-Guillén K, McCann C, Martínez-Sánchez JC, Koontz F. Resource availability and habitat use by mantled howling monkeys in a Nicaraguan coffee plantation: can agroforests serve as core habitat for a forest mammal? An Cons. 2006 9: 331-38.
- Hopkins ME. Relative dominance and resource availability mediate mantled howler (Alouatta palliata) spatial responses to neighbors’ loud calls. Int J Primatol. 2013 34: 1032-54.
- Di Fiore A, Campbell CJ. The atelines, variation in ecology, behavior, and social organization. En: Campbell CJ, A Fuentes, KC Mackinnon, M Panger and MP Bearder Primates in Perspective, Oxford University Press 2007 pp155-85.
- Mandujano S, Estrada A. Detección de umbrales de área y distancia de aislamiento para la ocupación de fragmentos de selva por monos aulladores, Alouatta palliata, en Los Tuxtlas, México. Universidad y Ciencia 2005 2: 11-21.
- Arroyo-Rodríguez V, Mandujano S, Benítez-Malvido J, Cuende-Fanton C. The influence of large tree density on howler monkey (Alouatta palliata mexicana) presence in very small rain forest fragments. Biotropica. 2007 36: 760-66.
- Mandujano S, Escobedo-Morales LA. Population viability analysis of howler monkeys (Alouatta palliata mexicana) in a highly fragmented landscape in Los Tuxtlas, Mexico. Trop Cons Sc. 2008 1: 43-62.
- López-Galindo A, Acosta-Pérez R. Listado florístico de la isla Agaltepec, Lago de Catemaco, Veracruz. Foresta Veracruzana 1998 1: 1–4.
- Soto M. El clima. En: Guevara SJ, J Laborde and G Sánchez-Ríos, Los Tuxtlas, el paisaje de la sierra, Instituto de Ecología y Unión Europea, 2004 pp195-200.
- CONAGUA. Comisión Nacional del Agua. Base de datos climáticos de la Dirección General de Organismo DFE, Cuenca Golfo Centro, Dirección Técnica, Jefatura de Proyecto de Hidrometeorología, Estación Catemaco No. 30022. Comisión Nacional del Agua, 2010.
- Rodríguez-Luna E, Domínguez-Domínguez LE, Morales-Mávil JE, Martínez-Morales M. Foraging strategy changes in an Alouatta palliata mexicana troop released on an island. En: Marsh, LK, Primates in fragments, ecology and conservation, Kluwer Academic/Plenum Publishers, 2003 pp229–50.
- Ochoa-Gaona S, Pérez-Hernández I, De Jong BHJ. Fenología reproductiva de las especies arbóreas del bosque tropical de Tenosique, Tabasco, México. Rev Biol Trop. 2008 56: 657–73.
- Carabias-Lillo J, Guevara-Sada S. Fenología de una selva tropical húmeda. En: Gómez-Pompa A y RS del Amo, Investigaciones sobre regeneración de selvas altas en Veracruz, México II. Alhambra Mexicana 1985 27-78.
- Chapman CA, Chapman LJ, Zanne AE, Poulsen JR, Clark CJ. A 12-year phenological record of fruiting: implications for frugivore populations and indicators of climate change. En: Dew JL and JP Boubli, Tropical fruits and frugivores. Springer 2005 pp75-92.
- ESRI. ArcView GIS Software Version 3.2a. Environmental Systems Research Institute. California, 2000.
- StatSoft Inc. STATISTICA (Data Analysis Software System), version 7.0, 2004.
- Van Beest FM, Vander-Wal E, Stronen AV, Brook RK. Factors driving variation in movement rate and seasonality of sympatric ungulates. Journal of Mammalogy. 2013 94: 691-701.
- Van Belle S, Estrada A, Garber PA. Spatial and diurnal distribution of loud calling in black howlers (Alouatta pigra). Int J Primatol. 2013 34: 1209-24.
- Harris TR. Testing mate, resource and infant defence functions of intergroup aggression in nonhuman primates: Issues and methodology. Behaviour. 2007 144: 1521–35.
- Grueter CC. Home range overlap as a driver of intelligence in primates. Am J Primatol. 2014 77: 418-24.
- Noser R, Byrne RW. Mental maps in chacma baboons (Papio ursinus): using inter-group encounters as a natural experiment. Anim Cogn. 2007 10: 331–40.
- Strier K. Atelinae adaptations: behavioral strategies and ecological constraints. Am J Phys Anthropol. 1992 88: 515-24.
| Recibido: 26 de octubre de 2017 | Aceptado: 18 de diciembre de 2017 |
Paulo C. Quintana Morales. Laboratorio de Biología de la Conducta, Instituto de Neuroetología, Universidad Veracruzana. Av. Luis Castelazo Ayala s/n, Colonia Industrial Ánimas, Xalapa, Veracruz, C.P. 91190, México. Coordinación de Posgrado en Neuroetología, Instituto de Neuroetología, Universidad Veracruzana. Av. Luis Castelazo Ayala s/n, Colonia Industrial Ánimas, Xalapa, Veracruz, C.P. 91190, México. pquintana@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
