Mejoramiento de la marcha en personas con la enfermedad de Parkinson, utilizando un carril acuático. Un estudio piloto
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Arrieta-Gómez Jenny P1, Higuera-Velázquez Dulce M2, Hernández-Aguilar María Elena3, Herrera-Covarrubias Deissy3, Rojas-Durán Fausto3 y Aranda-Abreu Gonzalo E3*
1Maestría en Neurorehabilitación, Escuela Centro Mexicano Universitario de Ciencias y Humanidades/Centro de Rehabilitación e Inclusión Social del Estado de Veracruz (CRISVER), Xalapa, Veracruz, México. 2Escuela Centro de Rehabilitación y Educación Especial DIF, Tamaulipas. 3Centro de Investigaciones Cerebrales, Universidad Veracruzana, Cuerpo académico de Neuroquímica, Xalapa, Veracruz, México.
Resumen/Abstract
Introducción
Material y métodos
Resultados
Discusión
Agradecimientos
Referencias
Correspondencia
Introducción. La enfermedad de Parkinson es un padecimiento que no tiene cura hasta el momento, quizás en un ambiente acuoso, la persona se siente protegida de no caerse y la re-educación de los pacientes utilizando un carril de marcha acuático por un mes, será de beneficio para la persona en su vida diaria, ya que las labores usuales de la vida las podrá hacer de mejor manera. Metodología. Ochos sujetos con enfermedad de Parkinson (estadíos 1 al 3 en la escala de Hoehn-Yahr), fueron evaluados después de 10 sesiones llevadas a cabo en un carril acuático. Se realizarón pruebas, de funcionalidad, de marcha, de congelamiento, de equilibrio y de movilidad, antes y después del tratamiento. Resultados. Se muestra que cuando los sujetos son sometidos a terapia acuática en un carril de marcha, las pruebas de funcionalidad, congelamiento y equilibrio, mejoran de manera significativa. Conclusión. La repetición de ejercicios en un carril acuático mejora algunos parámetros de la funcionalidad motora en pacientes con la enfermedad de Parkinson, lo que les permite tener una mejor calidad de vida.
Palabras clave: Parkinson, Re-educación, Carril acuático, Funcionalidad, Congelamiento, Equilibrio.
Introduction. Parkinson's disease is a condition that has no cure so far, perhaps in an aqueous environment, the person feels protected from falling off and re-education of patients using a water walk lane for a month, will be of benefit for the person in their daily life, since the usual tasks of life can best be done. Methodology. Eight subjects with Parkinson's disease (stages 1 to 3 on the Hoehn-Yahr scale) were evaluated after 10 sessions conducted on a water lane. Testing, functionality, running, freezing, balance and mobility were performed before and after treatment. Results. It is shown that when subjects undergo aquatic therapy in a walking lane, functional tests, freezing and balancing, improve significantly. Conclusion. The repetition of exercises in a water lane improves some parameters of motor function in patients with Parkinson's disease, which allows them to have a better quality of life.
Key words: Parkinson, Re-education, Lane water, Functionality, Freezing, Balance.
La enfermedad de Parkinson fue descrita en 1817, cuyos síntomas inicialmente se determinaron como temblores, desórdenes en la marcha y bradicinesia.1
Se estima que a nivel mundial existen alrededor de 4.6 millones de personas y ésta cifra se duplicará para el año 2030. En México existen entre 100 mil y 300 mil pacientes con la enfermedad de Parkinson.2
Los síntomas de la enfermedad se empiezan a hacer visibles aproximadamente a la edad de 60 años, siendo los hombres quienes tienen mayor riesgo. El origen de la enfermedad es desconocido, aunque se han asociado a causas ambientales y genéticas.3
Dentro de los síntomas clínicos se manifiestan el temblor, la rigidez, la bradicinesia y la inestabilidad postural. Una postura flexionada y el congelamiento de la marcha son síntomas motores típicos. Las manifestaciones motoras se relacionan con la pérdida de las neuronas dopaminérgicas de la substancia nigra que inervan el cuerpo estriado.4
El congelamiento de la marcha es definido como un breve episodio donde la persona no puede mover el pie hacia adelante con la intención de caminar.5 El congelamiento puede ser una de las causas que lleva a un paciente a utilizar una silla de ruedas 5 años después de las primeras manifestaciones.6
Hasta ahora no se conocen las causas del congelamiento; sin embargo, se ha propuesto la hipótesis de que el congelamiento depende de la visión, la cual es necesaria para aumentar la deficiente retroalimentación propioceptiva defectuosa ascendente de los miembros inferiores.7
Otros estudios han demostrado, que la conectividad de la corteza del ganglio basal motor con el área motora suplementaria es afectada al iniciar el movimiento. Así mismo ha sido sugerido que la conectividad entre el núcleo pedunculopontino y la región locomotora del cerebelo, al igual que el área motora suplementaria y la corteza premotora se encuentra afectada.8
Estudios demuestran que el cerebro puede re-aprender a ejecutar la acción de la marcha, cuando son puestas señales repetidas de sincronización provenientes de osciladores rítmicos que son generadas por un sistema llamado “WalkMate”, que van a permitir que la persona pueda caminar sin congelamiento.9
Con base en lo anterior, el uso de un carril acuático le podría permitir a la persona con la enfermedad de Parkinson mediante conductas repetitivas, re-aprender a caminar disminuyendo el congelamiento.
Estudios han demostrado que la terapia acuática es eficaz en mejorar la coordinación del cuerpo al caminar, a través de estimular el balance en el agua y el ajuste sensor-motor,10 dando al paciente una mayor independencia en la vida diaria.11
Este proyecto fue realizado bajo cuidado del comité de ética del CRISVER y de acuerdo a la Sociedad Médica Mundial y la declaración de Helsinki.
2.1. Responsabilidades éticas
Protección de personas y animales. Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Aceptaron participar 8 pacientes diagnosticados con la enfermedad de Parkinson de tipo idiopático en estadíos 1 a 3 según la escala de Hoehn y Yahr12 y afiliados al Centro de Rehabilitación e Inclusión Social de Veracruz (CRISVER) en la Cd. de Xalapa, Veracruz, México, fueron evaluados para participar en un estudio sobre la marcha en un carril acuático (ver tabla 1).
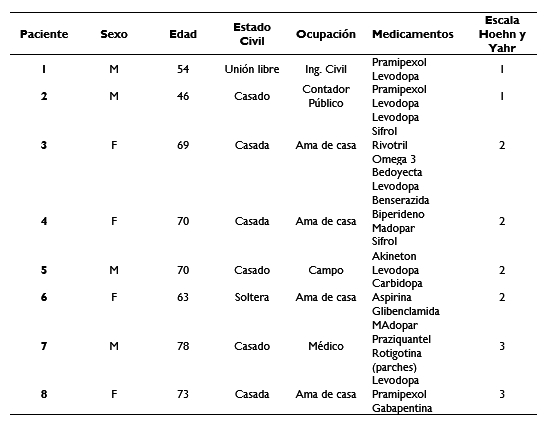
El criterio de inclusión fue que pudieran hacer la marcha en forma independiente y los de exclusión se determinó que no padecieran de anomalías posturales, discinesia, problemas circulatorios, contraindicaciones cardíacas, comportamiento agresivo o no cooperativo, deficiencias cognitivas graves, micosis.
Se utilizó un carril de marcha acuático de 7 m largo por 90 cm de ancho y una profundidad de 135 cm, a una temperatura entre 32 y 34°C.
Se clasificaron a los pacientes por medio del protocolo de Hoehn y Yahr.12 Las escalas de valoración fueron: a) medida de independencia funcional,13 la cual es una herramienta que ha sido aceptada como medida de la discapacidad y que evalúa el aspecto motor y cognitivo. Se valoran 18 actividades, donde 13 de ellas son motoras y 5 son cognitivos. Los 18 bloques evalúan: cuidado personal, control de esfínteres, transferencias, locomoción, comunicación y conciencia del mundo exterior. La puntuación final oscila entre 18 puntos que significa dependencia total hasta los 126 puntos que es la independencia completa. b) índice dinámico de la marcha (DGI),14 se enfoca en evaluar la marcha, el equilibrio y el riesgo de caídas, si se obtiene una puntuación de 21 a 24 indica mínimo riesgo de caídas, por lo contrario, un menor valor de 21, indica mayor riesgo de caídas. c) cuestionario de congelamiento de la marcha,15 es una medida con base en las observaciones del paciente, donde se les pregunta sobre las dificultades que tienen al caminar. d) prueba de Tinneti16 es una medida sobre la marcha y el equilibrio, donde la puntuación mayor a 20 puntos, representa menor riesgo de caídas y por debajo de esa medida, el paciente tiende a tener mayor riesgo de caída y e) prueba de TUG,17 “Time Up and Go”, es una prueba que detecta problemas de equilibrio y consiste en que la persona debe levantarse de una silla, caminar 3 metros, girar sobre si mismo, regresar y volver a sentarse, mientras el terapeuta cronometra el tiempo.
2.2. Procedimiento
El desempeño motriz de cada paciente se cuantificó por medio de una serie de pruebas: la prueba de índice de medida funcional, índice dinámico de la marcha, índice de congelamiento de la marcha, prueba de Tinneti y prueba de TUG. La primera cuantificación se hizo antes de iniciar el entrenamiento en el carril de marcha acuático y al final, después de todas las sesiones.
Sesiones de entrenamiento en el carril de marcha acuático: se realizaron 12 sesiones de 30 minutos a intervalos de 3 días. El paciente fue sometido a una valoración inicial antes de la primera sesión. De la sesión 2 a la 11 el paciente con Parkinson recibió entrenamiento de la marcha en el carril de marcha durante 30 minutos. En la última sesión (12) se realizaron nuevamente las valoraciones.
El tiempo total fue de 4 semanas.
3. Análisis estadístico
Como medida estadística se utilizó la media y la desviación estándar, para comparar al inicio y final de las sesiones acuáticas, también fue utilizada la t de student como prueba estadística.
La prueba de índice de funcionalidad independiente donde son evaluadas aspectos de la vida diaria, muestra que hay mejoría significativa en los pacientes después de las 12 sesiones en el carril de marcha (Figura1).
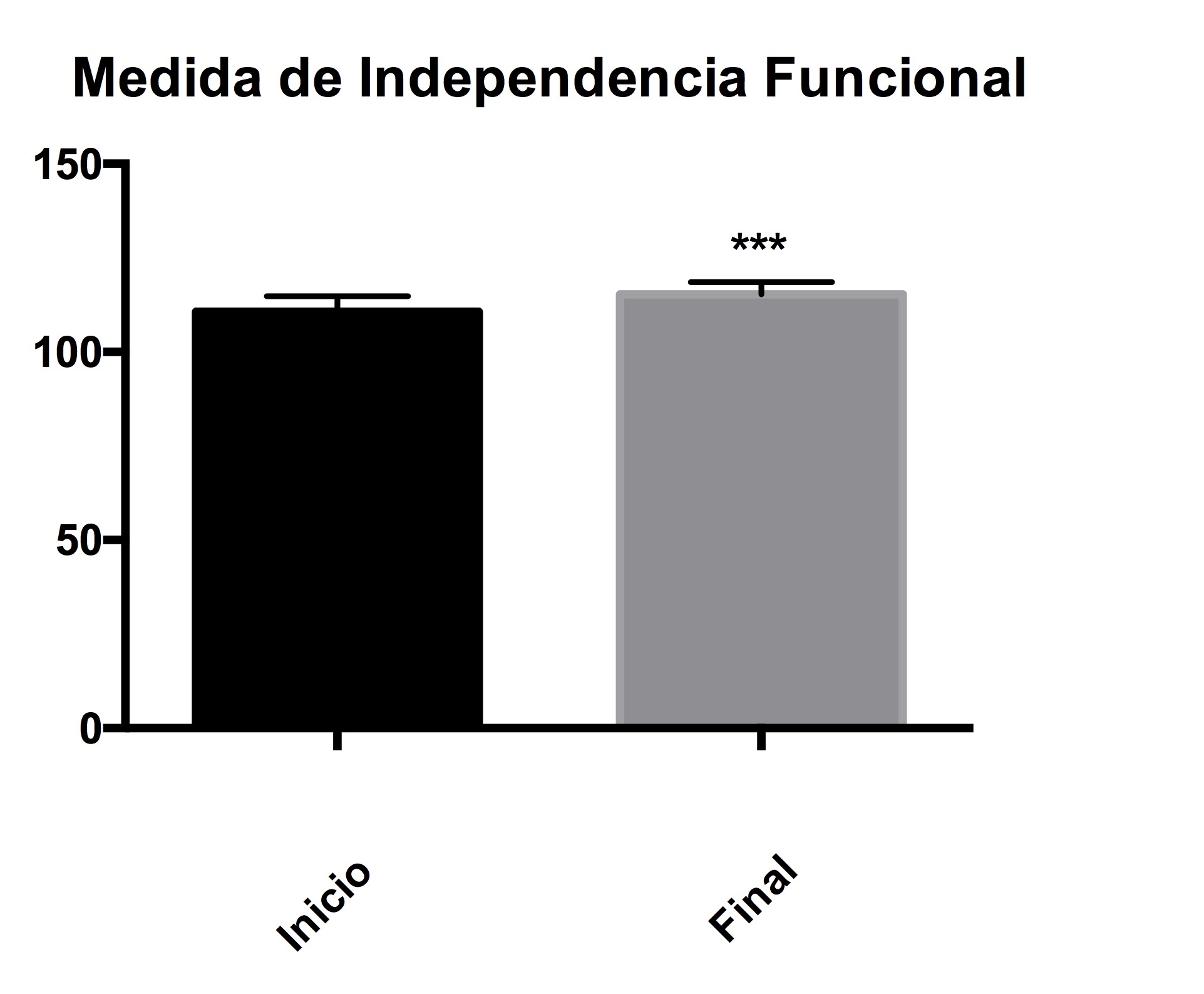
Figura 1. Medida de Independencia funcional. Evaluación de actividades de la vida diaria, al inicio y al final de 12 sesiones. Los asteriscos representan una diferencia significativa con una p<0.05.
En lo referente a la evaluación de la prueba dinámica de la marcha, los resultados muestran que hay una diferencia significativa después de que los pacientes utilizaron el carril acuático (Figura 2).
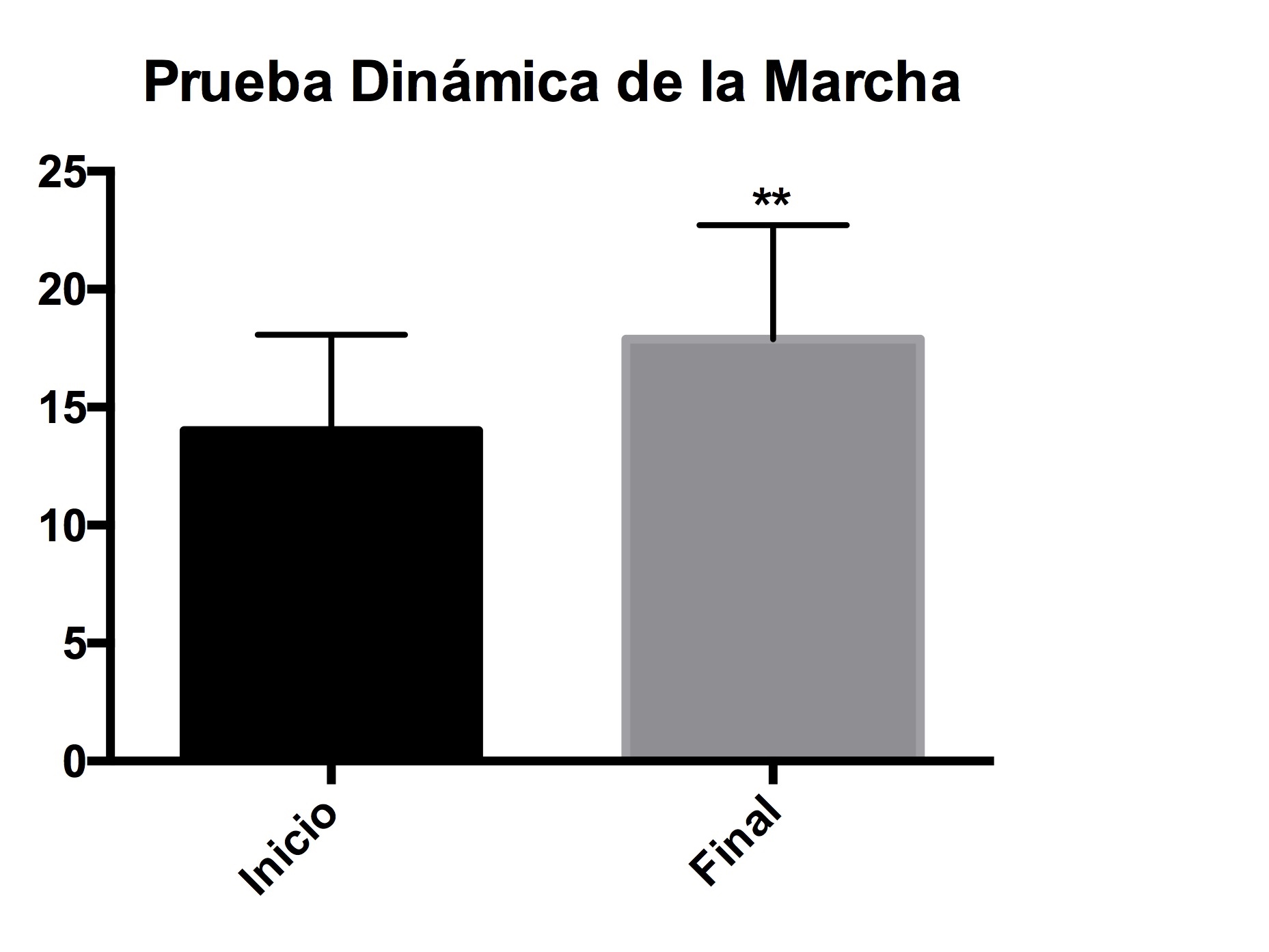
Figura 2. Índice dinámico de la marcha. Evaluación de la distancia al caminar, el equilibrio y la velocidad, al inicio y al final de 12 sesiones. Los asteriscos representan una diferencia significativa con una p<0.05.
Los resultados sobre el índice de congelamiento de la marcha, los pacientes mostraron una mejoría significativa al disminuir los eventos de congelamiento después del uso del carril acuático (Figura 3).
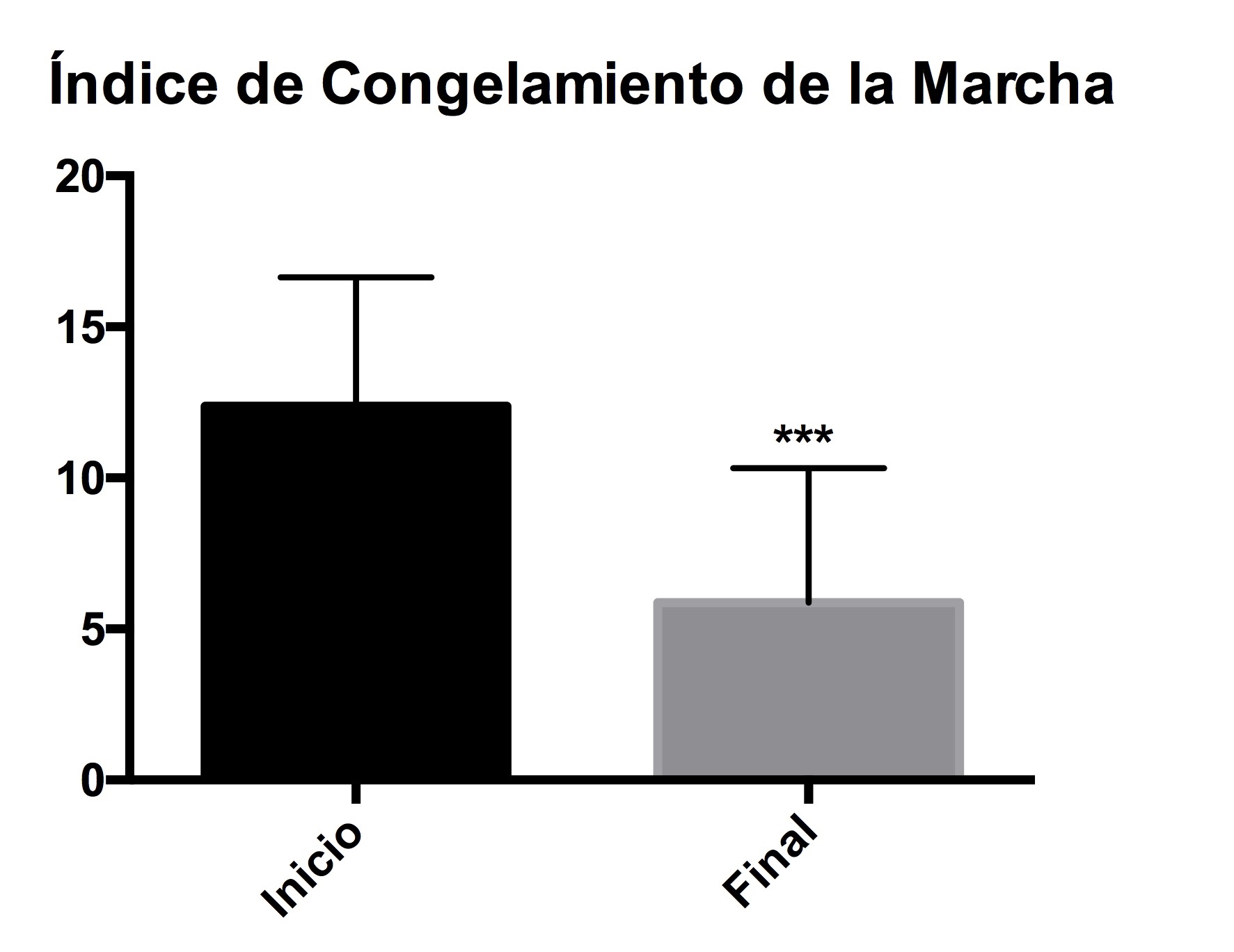
Figura 3. Congelamiento de la marcha. Evaluación de las dificultades del pacienteal caminar, así como el titubear al dar el paso y el congelamiento. Al inicio y después del tratamiento. Los asteriscos representan una diferencia significativa con una p<0.05.
La prueba de Tinneti, muestra que el riesgo de caídas disminuyó considerablemente y significativamente, después de las sesiones acuáticas (Figura 4).
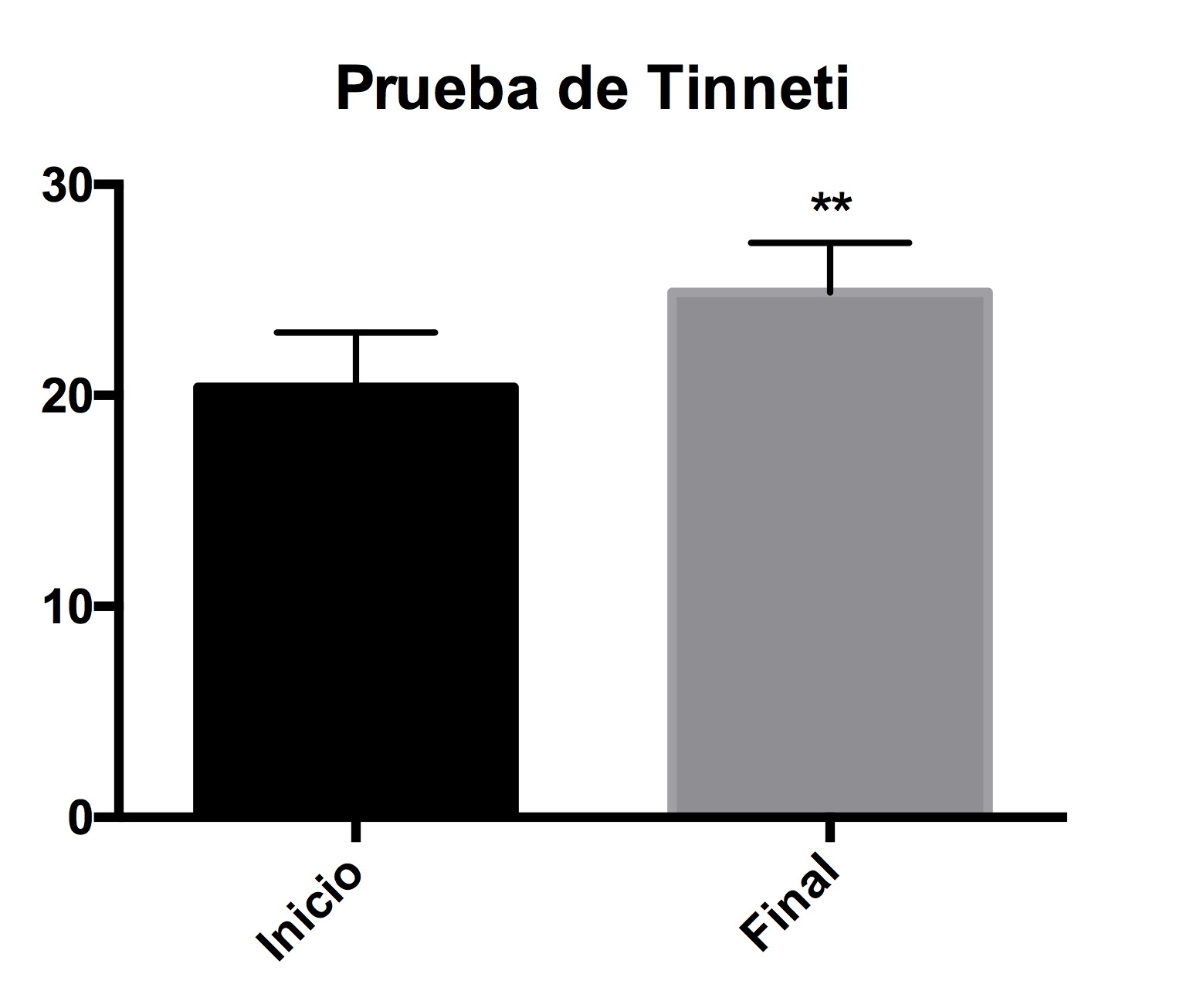
Figura 4. Evaluación de marcha y equilibrio (prueba de Tinneti). Evaluación del de riesgo de caída, antes y después de las sesiones. Los asteriscos representan una diferencia significativa con una p<0.05.
En el caso de la prueba de Tug, donde se cuantifica en segundos la movilidad del paciente, no mostró una diferencia significativa después del uso del carril acuático (Figura 5).
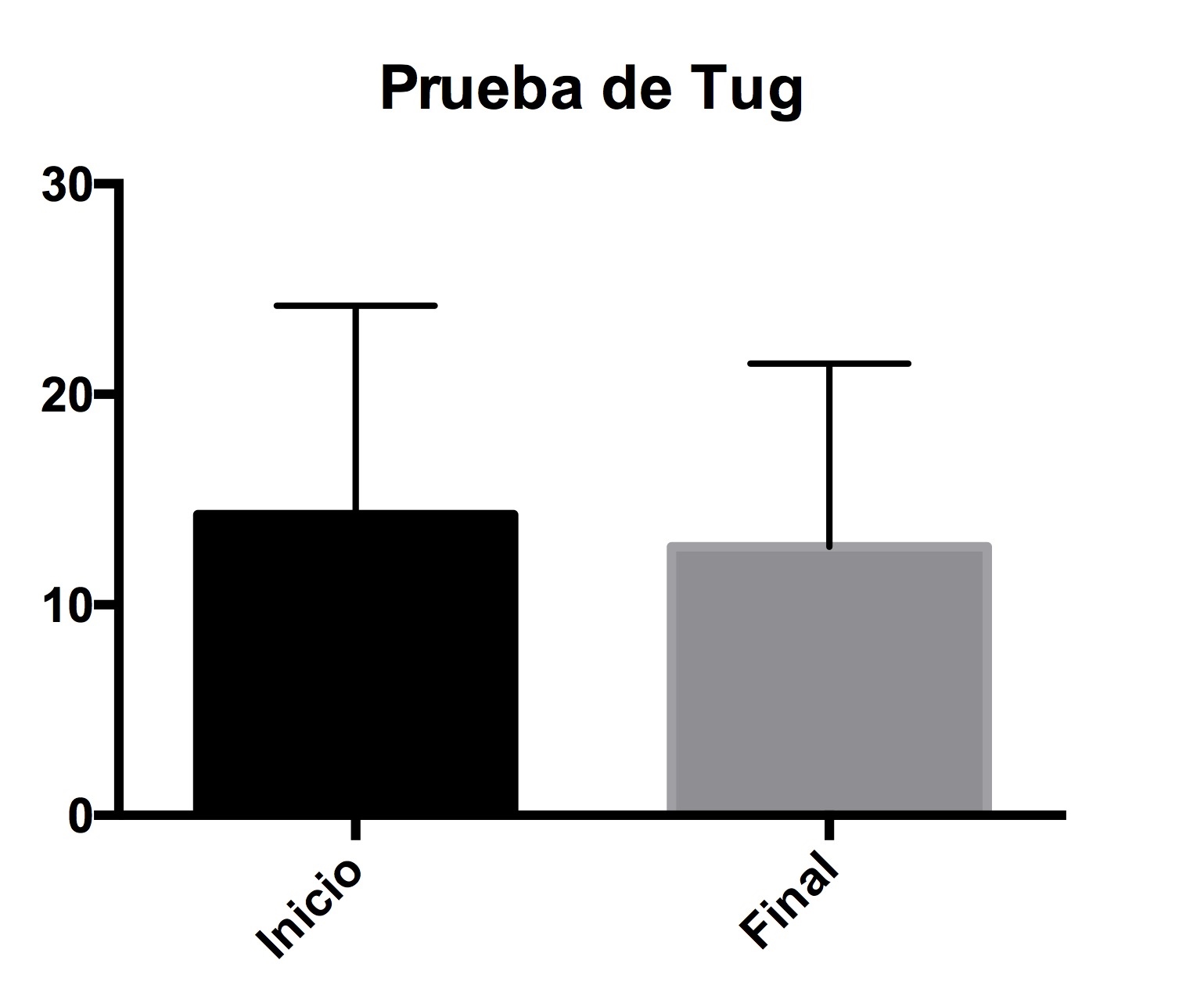
Figura 5. Evaluación de la movilidad del paciente. Cuantificación de la movilidad del paciente, por medio de la prueba de TUG.
Hasta hoy en día, no se conoce el origen de la enfermedad de Parkinson, ni tampoco existe una cura. A las personas con esta enfermedad, se les administra levodopa,18 para restaurar la función motora causada por la pérdida de dopamina en los ganglios basales, característica de esta enfermedad neurodegenerativa.
Dentro de las alternativas que se pueden implementar para mejorar la calidad de vida del paciente está la re-educación del cerebro, con base en repetición de acciones como es la marcha, estudios han demostrado que este proceso permite que las personas vuelvan a re-aprender a base de entrenamiento y señales, estos exámenes han sido efectuados en personas con Parkinson y ha sido aplicado a la marcha.9
Nuestros resultados indican que 10 sesiones de entrenamiento un carril acuático reduce significativamente el riesgo a caer, perder el equilibrio y el congelamiento en personas con la enfermedad de Parkinson, lo cual posiblemente se deba a una re-educación del cerebro, y que podría ser debido a que se refuerce el aprendizaje generando una posible potenciación a largo plazo.
Cuando se hizo la valoración del índice de independencia funcional, después de 10 sesiones acuáticas, los pacientes mostraron una mejoría significativa en la ejecución de acciones de la vida diaria. Los pacientes pudieron realizar mejor estas habilidades, lo que sugiere que el entrenamiento continuo ayuda a mejorar las habilidades motoras.19,20
En cuanto al índice dinámico de la marcha, las sesiones ayudaron a los pacientes a mejorar el caminar, por lo que marcha se observó favorecida después de las sesiones en el agua.
La evaluación del congelamiento después de las sesiones en el agua mostró un cambio significativo favorable, pues los pacientes tuvieron menos eventos de congelamiento aún después de haber pasado 3 a 5 horas de las sesiones. El uso del carril acuático, le dio al paciente seguridad al caminar, así evitando el riesgo de caer. Estudios han demostrado que el ejercicio continuo y programado por sesiones diarias, puede ser un factor importante para evitar el congelamiento.21
En la prueba de marcha y equilibrio, se demuestra que los pacientes mejoran satisfactoriamente después de las sesiones acuáticas, sin embargo, un estudio demuestra que no hay efectividad de actividad física en la marcha y equilibrio.22
En la prueba de TUG, no se obtuvo un cambio significativo, probablemente a que los pacientes están en etapa temprana a moderada.
Es importante mencionar que las sesiones acuáticas, pudieron haber dado al paciente una mayor seguridad y una mejoría en su humor.23 Estos ejercicios, quizás disminuyeron su ansiedad y depresión, ya ellos mismos decían que se sentían muy bien después de cada sesión.
Si comparamos este estudio con la terapia asistida por medio de un robot,2 creemos que el carril acuático le da un mejor balance al paciente, debido a que se siente más seguro en el agua.
Al no existir hasta el momento un cura para la enfermedad de Parkinson, se tienen que buscar alternativas en cuanto a rehabilitación de la persona, que le permita, tener una mejor calidad de vida.
A los pacientes y familiares de los pacientes que permitieron que este proyecto de investigación fuera posible.
Al Centro de Rehabilitación e Inclusión Social del Estado de Veracruz.
7. Financiamiento
Proyecto Financiado por el Centro de Rehabilitación e Inclusión Social del Estado de Veracruz.
Los autores declaran no tener conflictos de interés.
- Grosset D, Grosset K, Okun M, Fernandez H. Parkinson´s Disease. UK: Manson Publishing; 2009
- Díaz I. Día Mundial del Parkinson 2016, una enfermedad crónica e invalidante. Salud Diario, Medio para Médicos. 2016
- Jankovic J. Parkinson’s disease: clinical features and diagnosis. J Neurol Neurosurg Psychiatry. 2008;79:368-376.
- Fahn S. Description of Parkinson’s disease as a clinical syndrome. Ann N Y Acad Sci. 2003;991:1-14.
- Heremans E, Nieuwboer A, Vercruysse S. Freezing of gait in Parkinson’s disease: where are we now. Curr Neurol Neurosci Rep. 2013;13:350.
- Jankovic J. Gait disorders. Neurol Clin. 2015;33:249-268.
- Beck EN, Ehgoetz Martens KA, Almeida QJ. Freezing of Gait in Parkinson’s Disease: An Overload Problem. PLoS One. 2015;10:e0144986.
- Wu T, Hallett M, Chan P. Motor automaticity in Parkinson’s disease. Neurobiol Dis. 2015;82:226-234.
- Uchitomi H, Ota L, Ogawa K, Orimo S, Miyake Y. Interactive rhythmic cue facilitates gait relearning in patients with Parkinson’s disease. PLoS One. 2013;8:e72176.
- Gnoato T, Arruda S, Lucía V, Cunha A. Aquatic physical therapy for Parkinson´s disease. Advances in Parkinson´s Disease. 2013;2:102-107.
- Pompeu J, Okano R, Patines R, Luiz S, Alves M. Effects of aquatic physical therapy on balance and gait of patients with Parkinson’s disease. J Health Sci Inst. 2013;31:201-204.
- Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality. Neurology. 1967;17:427-442.
- Mahoney F, Barthel D. Functional Evaluation: The Barthel Index. Md State Med J. 1965;14:61-65.
- Herman T, Inbar-Borovsky N, Brozgol M, Giladi N, Hausdorff JM. The Dynamic Gait Index in healthy older adults: the role of stair climbing, fear of falling and gender. Gait Posture. 2009;29:237-241.
- Cervantes-Arriaga A, Rodriguez-Violante M. Validación de la versión en español del cuestionario de congelamiento de la marcha (FOG-Q) en enfermedad de Parkinson. Arch Neurocien Mex. 2011;16:173-178.
- Tinetti ME, Williams TF, Mayewski R. Fall risk index for elderly patients based on number of chronic disabilities. Am J Med. 1986;80:429-434.
- Podsiadlo D, Richardson S. The timed “Up & Go”: a test of basic functional mobility for frail elderly persons. J Am Geriatr Soc. 1991;39:142-148.
- Sacks OW, Kohl MS, Messeloff CR, Schwartz WF. Effects of levodopa in Parkinsonian patients with dementia. Neurology. 1972;22:516-519.
- Smiley-Oyen AL, Lowry KA, Emerson QR. Learning and retention of movement sequences in Parkinson’s disease. Mov Disord. 2006;21:1078-1087.
- Monticone M, Ambrosini E, Laurini A, Rocca B, Foti C. In-patient multidisciplinary rehabilitation for Parkinson’s disease: A randomized controlled trial. Mov Disord. 2015;30:1050-1058.
- Canning CG, Sherrington C, Lord SR, Close JC, Heritier S, Heller GZ, Howard K, Alien NE, Latt MD, Murray SM, O´Rourke SD, Paul SS Song J, Fung VS.. Exercise for falls prevention in Parkinson disease: a randomized controlled trial. Neurology. 2015;84:304-312.
- Park A, Zid D, Russell J, Malone A, Rendon A, Wehr A, Li X. Effects of a formal exercise program on Parkinson’s disease: a pilot study using a delayed start design. Parkinsonism Relat Disord. 2014;20:106-111.
- De Moor MH, Beem AL, Stubbe JH, Boomsma DI, De Geus EJ. Regular exercise, anxiety, depression and personality: a population-based study. Prev Med. 2006;42:273-279.
- Picelli A, Melotti C, Origano F, Neri R, Verzè E, Gandolfi M, Waldner A, Smania N. Robot-assisted gait training is not superior to balance training for improving postural instability in patients with mild to moderate Parkinson’s disease: a single-blind randomized controlled trial. Clin Rehabil. 2015;29:339-347.
| Recibido: 20 de junio de 2017 | Aceptado: 07 de septiembre de 2017 |
Dr. Gonzálo Emiliano Aranda-Abreu. Centro de Investigaciones Cerebrales, Universidad Veracruzana. Av. Luis Castelazo Ayala, km 3.5 carr., Xalapa-Veracruz, C.P. 91190. Xalapa, Veracruz, México. Tel: + 52 (228) 8418900 Ext. 16311 Correo electrónico: garanda@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
