Caracterización de las convulsiones y el status epilepticus producido por el pentilentetrazol en ratas de 14 días de edad
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Velazco-Cercas Eliseo1, Puig-Lagunes Ángel A1, Zamora-Bello Isaac1, Beltrán-Parrazal Luis2, Morgado-Valle Consuelo2, López-Meraz María-Leonor2
1Doctorado en Investigaciones Cerebrales, Universidad Veracruzana, Xalapa, Veracruz, México. 2Centro de Investigaciones Cerebrales, Universidad Veracruzana, Xalapa, Veracruz, México.
Resumen/Abstract
Introducción
Material y métodos
Resultados
Discusión
Conclusión
Agradecimientos
Referencias
Correspondencia
El status epilepticus (SE) es un tipo de actividad epiléptica con alta incidencia en niños; se caracteriza por crisis epilépticas por un tiempo prolongado, con consecuencias como muerte neuronal y desarrollo de epilepsia. A nivel experimental, el pentilentetrazol (PTZ) produce convulsiones tónico-clónicas generalizadas (CTCG) en la rata en desarrollo con alta mortalidad. En este estudio se realizó una curva dosis-respuesta con la finalidad de caracterizar las convulsiones producidas por una dosis única de PTZ (45, 50, 55, 60, 65, 70 y 75 mg/kg, i.p.) en ratas Wistar de 14 días de edad (P14). No se identificaron diferencias estadísticamente significativas entre las dosis de PTZ analizadas en la proporción de ratas que presentaron CTCG, SE o murieron después de la aplicación del PTZ. Con 45 mg/kg de PTZ ninguna rata presentó CTCG, con 50 mg/kg de PTZ el 25% de las ratas mostraron CTCG, mientras que a dosis mayores el 100% de las ratas presentaron estas convulsiones. Las ratas que presentaron CTCG y que no murieron desarrollaron enseguida SE en todas las dosis estudiadas, en un porcentaje que varió de 63% (55 y 60 mg/kg de PTZ) a 25-37% (70-50 mg/kg de PTZ). Todas las ratas inyectadas con 75 mg/kg de PTZ presentaron CTCG y murieron. Los datos de este estudio sugieren que la administración de una sola dosis de PTZ en la rata P14 puede ser un modelo útil para el estudio de CTCG y SE en la rata en desarrollo.
Palabras clave: Status epilepticus, Convulsiones, Rata en desarrollo, Pentilentetrazol.
Status epilepticus(SE) is a type of epileptic activity with a high incidence in children; it is characterized by prolonged epileptic seizures that produce neuronal cell death and increase the risk for epilepsy. Experimental studies have shown that pentylentetrazole (PTZ) produces generalized tonic-clonic seizures (GTCS) in the developing rat with high mortality. In this study we tested the effect of a single administration of different dose of PTZ (45, 50, 55, 60, 65, 70 and 75 mg/kg, i.p.) in 14-day-old (P14) Wistar rat pups. Non-statistically significant differences were observed between the doses of PTZ in the proportion of rats that presented GTCS, SE or died after PTZ. Rats injected with 45 mg/kg PTZ did not show GTCS, with 50 mg/kg PTZ 25% of the rats had GTCS, whereas at higher doses 100% of the rats had GTCS. Rats that had GTCS and did not die developed SE at all doses studied, varying from 63% (55 and 60 mg/kg of PTZ) to 25-37% (70-50 mg/kg of PTZ). All rats injected with 75 mg/kg PTZ showed GTCS and died. These data suggest that the administration of a single dose of PTZ in P14 rats may be a useful model for studying GTCS and SE in the developing rat.
Key words: Status epilepticus, Seizures, Developing rats, Pentylentetrazole.
La Organización Mundial de la Salud considera que en la actualidad 50 millones de personas en todo el mundo padecen epilepsia, con una prevalencia estimada que oscila entre 4 y 10 por 1000 personas.1En México, la prevalencia se calcula entre 6.8 y 18 por cada 1000 habitantes,2 lo que la hace un problema de salud pública. La epilepsia es un trastorno del cerebro caracterizado por una predisposición crónica a generar crisis epilépticas con consecuencias neurobiológicas, cognitivas, psicológicas y sociales.3 Un tipo de actividad epiléptica considerada la emergencia neurológica más común en la infancia4 es el status epilepticus (SE), una condición que resulta de una falla en los mecanismos responsables de la terminación de las crisis o de la iniciación de mecanismos que conducen a crisis anormalmente prolongadas.5
El efecto de las crisis epilépticas durante el desarrollo depende de múltiples factores y puede afectar al cerebro, incluso a largo plazo, dependiendo de su frecuencia.6 El SE produce muerte neuronal en diversas regiones cerebrales en humanos,7ratas5 y a nivel experimental, se ha demostrado ampliamente que el SE favorece el desarrollo de epilepsia.8,9
Los modelos animales de crisis epilépticas y epilepsia desempeñan un papel crucial en esclarecer los mecanismos que las originan, así como las consecuencias adversas en el desarrollo.10 El pentilentetrazol (PTZ) es un antagonista del receptor GABAA11,12 que produce convulsiones en ratas en desarrollo, ya sea tras la administración de una sola dosis13,14 o de dosis repetidas.15 Es bien conocido que en roedores, tanto adultos como en desarrollo, la administración de dosis altas de PTZ induce convulsiones tónico-clónicas generalizadas (CTCG).16 Sin embargo, en la rata en desarrollo (7, 12 y 18 días de edad) el PTZ produce, en un rango de 40 a 120 mg/kg, dos tipos diferentes de convulsiones, las mínimas que son predominantemente crisis clónicas faciales y de los miembros anteriores, preservando el reflejo postural; y las mayores, que corresponden a las CTCG con pérdida de la postura.17 No obstante, en esos estudios se hace una escasa referencia el desarrollo de SE, a pesar de su alta incidencia en infantes humanos.4 Para generar SE en ratas en desarrollo se ha empleado un esquema de aplicación repetida de dosis subconvulsivas de PTZ18-20iniciando con una aplicación de 40 mg/kg, seguida por una dosis de 20 mg/kg 10 minutos después y, posteriormente, 10 mg/kg cada 10 minutos hasta que se presente el SE. También en este esquema se presenta pérdida de control postural y CTCG, con el inconveniente de una alta mortalidad.15
Considerando lo anterior, el objetivo del presente trabajo fue realizar una curva dosis-respuesta para caracterizar el desarrollo de CTCG y SE después de aplicar PTZ en ratas Wistar de 14 días de edad (P14). Se seleccionaron ratas P14 considerando que la madurez cerebral a esta edad (12-18 días de edad) es equivalente a la de un niño.21
2.1.Sujetos experimentales
Se utilizaron ratas P14 de la cepa Wistar de ambos sexos al momento de inducir las convulsiones (25 a 30 g de peso corporal), las cuales fueron criadas en el bioterio del Centro de Investigaciones Cerebrales de la Universidad Veracruzana. Los progenitores de los animales utilizados en los experimentos provinieron de la compañía Rismart México. Después del periodo de apareamiento, las hembras adultas que resultaron gestantes se alojaron individualmente en cajas de acrílico transparente (15 × 24 × 37 cm). Las camadas fueron homogeneizadas por talla a 8 crías cada una para evitar diferencias en el peso de las ratas. Los animales se mantuvieron con sus madres en condiciones ambientales de temperatura (23-25°C) y humedad (65-85%), con ciclos normales de luz-oscuridad de 12 h (08:00 a 20:00 h) y libre acceso al agua y al alimento. El día de nacimiento fue considerado como el día posnatal cero. En todos los casos la inducción del SE se realizó entre las 9:00 y 10:00 h del día. Para el estudio se siguieron los lineamientos éticos nacionales para el uso y cuidado de animales de investigación según la NOM-062-ZOO-1999.
2.2. Inducción del SE
Durante el día postnatal 14 las ratas recibieron 45 (n=4), 50 (n=4), 55 (n=8), 60 (n=8), 65 (n=8), 70 (n=4) o 75 (n=4) mg/kg i.p. de PTZ (Sigma, St. Louis, Mo., USA), respectivamente, disuelto en NaCl al 0.9%. Un grupo de ratas control, a las que no se les aplicó PTZ y que por ende no convulsionaron, recibió un volumen equivalente de solución salina i.p. La manifestación conductual de las convulsiones fue videograbada y cuidadosamente monitoreada para determinar la severidad de las convulsiones, la latencia a las CTCG, así como el porcentaje de animales que presentaron convulsiones, SE y muerte. El SE se definió como actividad convulsiva continua con duración mayor de 30 min. No se aplicó ningún fármaco antiepiléptico para detener las convulsiones. Después de finalizado el SE, las ratas recibieron 1 ml de dextrosa al 5% por vía subcutánea para evitar la deshidratación y apoyarlas en su recuperación. Posteriormente, las crías se colocaron de nuevo con sus madres, aproximadamente 6 h después del inicio del SE, para evitar el canibalismo. Se registró la supervivencia de las ratas al día siguiente y hasta el día posnatal 21 (P21).
3. Análisis estadístico
Para comparar el número de ratas que presentaron CTCG y SE se utilizó una prueba de proporciones. En el caso de la latencia a las CTCG se verificó que los datos cumplieran los supuestos de normalidad y homogeneidad de varianzas realizando las pruebas de Kolmogorov-Smirnov y Levene, respectivamente. Dado que los datos no cumplieron dichos supuestos se analizaron con una prueba no paramétrica de Kruskal Wallis. Los resultados se representan como el porcentaje y la mediana y el rango intercuartil. Los análisis se realizaron con el programa STATISTICA y Prisma Graph Pad y se consideró un nivel de significancia de α= 0.05.
Las ratas que se inyectaron únicamente con solución salina isotónica no presentaron convulsiones. En todos los grupos a los que se les aplicó PTZ la inhibición de la actividad motora fue el preludio de las convulsiones y a continuación se observaron espasmos mioclónicos breves (mioclonus) y mioclonías, es decir crisis mínimas. El grupo de ratas a las que se les aplicó 45 mg/kg de PTZ sólo presentó mioclonus. Las dosis mayores de PTZ (50-75 mg/kg) produjeron crisis mínimas, temblor de todo el cuerpo, mioclonías faciales y masticación seguidos de una carrera violenta (wild running) y CTCG para culminar en SE. La secuencia convulsiva de la CTCG, consistió en una carrera brusca inicial o un salto seguido de una caída, acompañada por la pérdida del reflejo de enderezamiento. Inmediatamente después, las ratas alcanzaron una etapa tónica generalizada que se caracterizó por la pérdida de control postural y fuertes contracciones en los músculos extensores de los miembros anteriores, posteriores o ambos, para posteriormente presentar convulsiones clónicas de todas las extremidades. A partir de este momento las convulsiones se caracterizaron por pérdida del tono postural y movimientos de las extremidades tipo “nado” con el animal sobre un costado, y dada su duración esta correspondió a SE.
Al analizar la proporción de ratas que presentaron CTCG, SE o murieron después de la aplicación del PTZ, no se identificaron modificaciones entre las diferentes dosis de PTZ analizadas. Se observó que con 45 mg/kg de PTZ ninguna rata presentó CTCG, con 50 mg/kg de PTZ el 25% de las ratas inyectadas tuvieron CTCG, mientras que a dosis mayores el 100% de las ratas presentaron estas convulsiones. A partir de la dosis de 55 mg/kg de PTZ algunas de las ratas murieron después de la CTCG. Los animales que presentaron CTCG y que no murieron desarrollaron enseguida SE en todas las dosis estudiadas, en un porcentaje que varió de 63% (dosis de 55 y 60 mg/kg de PTZ) a 25-37% (dosis de 70-50 mg/kg de PTZ). Todas las ratas inyectadas con 75 mg/kg de PTZ presentaron CTCG y murieron (Tabla 1).
Tabla 1. Curva dosis-respuesta del efecto del pentilentetrazol (PTZ) en la presentación de convulsiones tónico-clónicas generalizadas (CTCG), status epilepticus (SE) y muerte debido a la CTCG en ratas de 14 días de edad.
Dosis de PTZ (mg/kg) |
n |
Porcentaje |
||
CTCG |
Muerte debido a la CTCG |
SE después de la CTCG |
||
0 |
4 |
0 |
0 |
0 |
45 |
4 |
0 |
0 |
0 |
50 |
4 |
25 |
0 |
25 |
55 |
8 |
100 |
37 |
63 |
60 |
8 |
100 |
37 |
63 |
65 |
8 |
100 |
63 |
37 |
70 |
4 |
100 |
75 |
25 |
75 |
4 |
100 |
100 |
0 |
Los datos se expresan como porcentaje para cada parámetro evaluado. No se identificaron diferencias entre las dosis de PTZ evaluadas.
Adicionalmente se analizó la latencia a las CTCG en las ratas tratadas con las diferentes dosis de PTZ registrándose una latencia de 154.5 s (100-316.8) para la dosis 55 mg/kg, 103 s (92.5-136.3) para 60 mg/kg, 82.5 s (64.25-97.75) para 65 mg/kg, 64.5 s (61.5-117.8) para 70 mg/kg y 91 s (51.25-133) para 75 mg/kg. No se observaron diferencias significativas entre los grupos experimentales en este parámetro, aunque la menor dosis de PTZ mostró una latencia mayor (Figura 1).
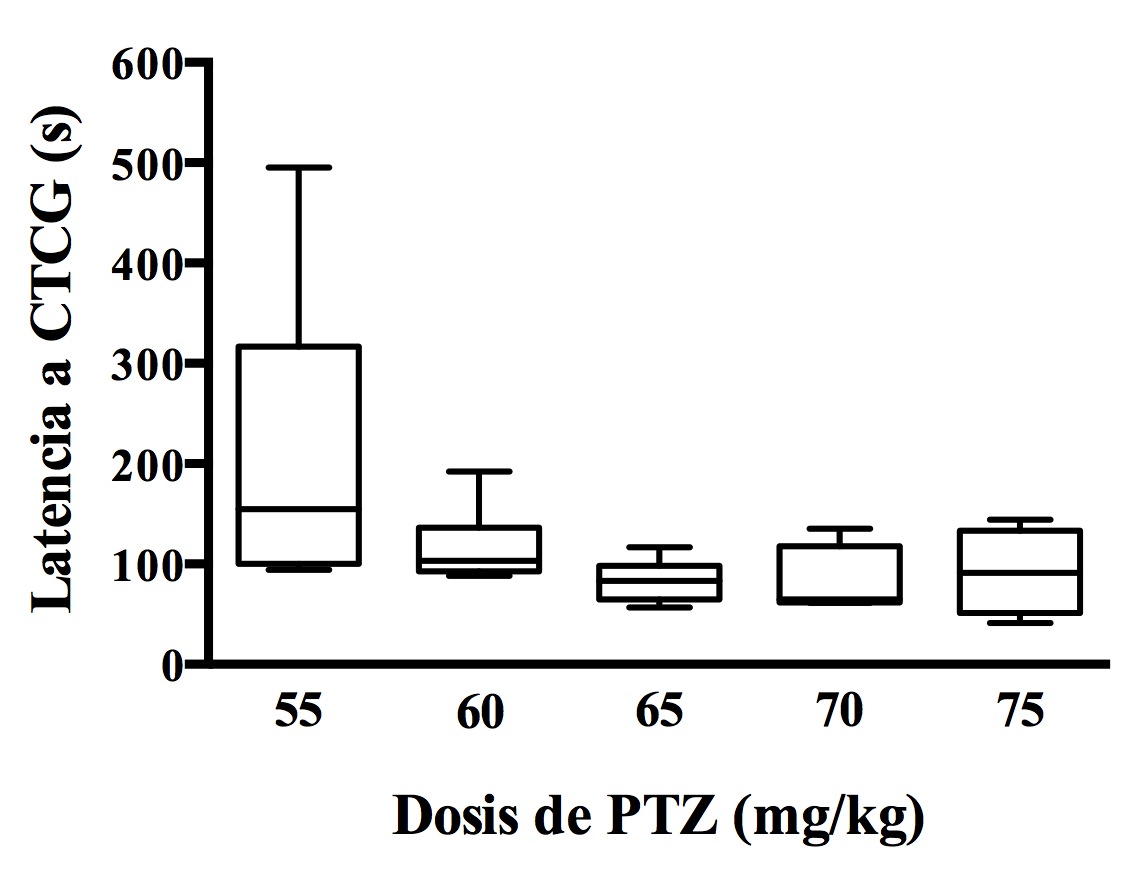
Figura 1. Latencia a las convulsiones tónico-clónicas generalizadas (CTCG) producidas por diferentes dosis de pentilentetrazol (PTZ) en ratas de 14 días de edad. Los datos se expresan como la mediana y el rango intercuartil, los bigotes corresponden a los valores mínimo y máximo para cada grupo. No existen diferencias entre los grupos experimentales.
Todas las ratas que presentaron SE sobrevivieron 24 h después del mismo y mostraron un comportamiento al día P21 similar a aquellas ratas a las que no se les aplicó PTZ (que no tuvieron convulsiones).
Los hallazgos de este estudio muestran que el PTZ produce CTCG y SE en la rata de 14 días de edad, aunque no existen diferencias en las dosis empleadas en el rango de 50-75 mg/kg. Sin embargo, en la práctica el efecto convulsivo del PTZ mostró una tendencia dependiente de la dosis en las convulsiones, de manera que la dosis de 45 mg/kg no produce CTCG, la dosis de 50 lo hace únicamente en 25% de las ratas, y dosis de 55 a 75 mg/kg producen CTCG en el 100% de las ratas. Para todas las dosis de PTZ analizadas, las ratas que no murieron debido a las CTCG desarrollaron SE y sobrevivieron a las convulsiones en condiciones similares a aquellas ratas que no convulsionaron hasta el día P21. La ausencia de diferencias estadísticamente significativas entre las dosis del PTZ empleadas puede deberse al reducido tamaño de muestra empleado (algunos grupos se conformaron por 4 ratas). Sin embargo, no se consideró usar un mayor número de ratas ya que con la dosis menor de PTZ ninguna convulsionó y con la dosis mayor todas tuvieron CTCG y SE y murieron.
Los resultados de esta investigación sugieren que el PTZ a una dosis única es capaz de producir CTCG que eventualmente evolucionan a SE. Tras la aplicación del PTZ estas ratas mostraron una latencia corta a las convulsiones con una rápida secuencia de conductas caracterizadas por temblor en todo el cuerpo, mioclonías faciales y de miembros posteriores y anteriores, seguida por una carrera violenta, CTCG y SE. Las convulsiones observadas a esta edad son similares a las observadas previamente por Velisek et al., con dosis de 40 a 120 mg/kg de PTZ en ratas de 7 a 25 días de edad.17 Sin embargo, en ese estudio no caracterizaron la presencia del SE. Lo anterior puede atribuirse a que cuando se emplea PTZ a dosis altas, la mayoría de las ratas desarrolla CTCG y muere. En un estudio realizado en ratas de 16-20 días de edad,15 se menciona que tras la aplicación de dosis repetidas de PTZ la mayoría de las ratas presentaron SE, pero con mortalidad superior al 50%, ratificando que cuando se emplea PTZ a dosis altas, la mayoría de las ratas muere después de las convulsiones. La diferencia entre las respuestas convulsivas observadas cuando se genera SE con una o con varias dosis, sugiere que éstas se presentan en función de la dosis empleada y a la sensibilidad al PTZ por parte de las estructuras cerebrales responsables de la ocurrencia del SE.17
La literatura menciona que el SE puede inducirse después de la aparición de CTCG con dosis múltiples de PTZ (60 a 120 mg/kg) en ratas en desarrollo de 16 a 20 días de edad15 de 10 y 21 días de edad18, 19 y 10, 14, 17 y 21 días de edad,20 así como en ratas adultas.22, 23 Nuestros resultados mostraron que una sola aplicación de PTZ en la rata P14 genera CTCG y SE, a diferencia de lo reportado en ratas P7, P10, P12 y P18 en las que sólo se reportan las CTCG.14, 17 Estas diferencias pueden deberse a cambios en las vías neuronales excitatorias e inhibitorias que presenta el cerebro de la rata en desarrollo,24 ya que por ejemplo alrededor del día P14, ocurre un cambio en las concentraciones iónicas neuronales que hacen que el GABA pase de ser excitador a inhibidor.25Además, no puede descartarse posibles diferencias en la absorción, penetración y eliminación del PTZ en el sistema nervioso central en ratas de diferente edad.26
Las convulsiones producidas por el PTZ tienen dos componentes principales, de inicio se observan manifestaciones clónicas seguidas de una extensión tónica de las extremidades y del cuerpo en general. Los estudios realizados han mostrado que las fases clónicas requieren la activación de redes neuronales del cerebro anterior, incluyendo la corteza prefrontal y los ganglios basales, para eventualmente reclutar a estructuras del tallo cerebral, responsables de la manifestación tónica de las convulsiones.27, 28 Nuestros resultados indican que, si la CTCG no es tan severa como para producir la muerte de la rata, se desarrolla SE, sugiriendo una falla en los mecanismos que culminan una crisis epiléptica. Si bien es cierto, los resultados de este estudio implican únicamente la evaluación de las convulsiones después de la aplicación del PTZ sin un registro de la actividad electrográfica simultáneo, otros autores ya han descrito que existe una correlación entre la severidad de la actividad electrográfica y las manifestaciones conductuales de las convulsiones producidas por el PTZ.29Sin embargo, sería importante para apoyar nuestros hallazgos realizar a futuro un análisis de la actividad electrográfica durante la transición de las CTCG al SE.
Los hallazgos de este estudio mostraron que la administración de una sola dosis de PTZ en la rata de 14 días de edad produce CTCG y SE, y esto puede representar un modelo útil para su estudio en la rata en desarrollo.
Al Conacyt por la beca de estudios de doctorado otorgada a EVC (Número de registro 326059) y por el apoyo otorgado al Cuerpo Académico de Neurofisiología (UV-CA-333).
Los autores declaran no tener conflictos de interés.
- Epilepsia. Nota descriptiva. Organización Mundial de la Salud OMS. http://www.who.int/mediacentre/factsheets/fs999/es/
- Resendiz JC. Epidemiología de la epilepsia en America Latina. En: Velasco AL, Epilepsia. Un punto de vista latinoamericano. Editorial Alfil, México, D.F. 2013 pp 1-9.
- Fisher RS, Acevedo C, Arzimanoglou A, Bogacz A, Cross JH, Elger CE, Engel JJr, Forsgren L, French JA, Glynn M, Hesdorffer DC, Lee BI, Mathern GW, Moshé SL, Perucca E, Scheffer IE, Tomson T, Watanabe M, Wiebe S. ILAE official report: a practical clinical definition of epilepsy. Epilepsia 2014 55: 475-82.
- Raspall-Chaure M, Chin RF, Neville BG, Scott RC. Outcome of paediatric convulsive status epilepticus: a systematic review. Lancet Neurol 2006 5: 769-779.
- Trinka E, Cock H, Hesdorffer D, Rossetti AO, Scheffer IE, Shinnar S, Shorvon S, Lowenstein DH. A definition and classification of status epilepticus--Report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia 2015 56: 1515-1523.
- Novorol CL, Chin RF, Scott RC. Outcome of convulsive status epilepticus: a review. Arch Dis Child 2007 92: 948-951.
- Fujikawa DG, Itabashi HH, Wu A, Shinmei SS. Status epilepticus-induced neuronal loss in humans without systemic complications or epilepsy. Epilepsia 2000 41: 981-991.
- Sankar R, Shin DH, Liu H, Mazarati A, Vasconcelos A, Wasterlain CG. Patterns of status epilepticus-induced neuronal injury during development and long-term consequences. J Neurosci. 1998 18: 8382–8393.
- Suchomelova L, Baldwin RA, Kubova H, Thompson KW, Sankar R, Wasterlain CG Treatment of experimental status epilepticus in immature rats: dissociation between anticonvulsant and antiepileptogenic effects. Pediatr Res. 2006 59:237-243.
- Reddy DS, Kuruba R. Experimental models of status epilepticus and neuronal injury for evaluation of therapeutic interventions. Int J Mol Sci 2013 14: 18284-18318.
- Ramanjaneyulu R, Ticku MK. Interactions of pentamethylenetetrazole and tetrazole analogues with the picrotoxinin site of the benzodiazepine-GABA receptor-ionophore complex. Eur J Pharmacol. 1984 98:337-345.
- Huang RQ, Bell-Horner CL, Dibas MI, Covey DF, Drewe JA, Dillon GH. Pentylenetetrazole-induced inhibition of recombinant gamma-aminobutyric acid type A (GABA(A)) receptors: mechanism and site of action. J Pharmacol Exp Ther 2001 298:986-995.
- Jandová K, Riljak V, Pokorný J, Langmeier M. Pentylentetrazol associated changes of hippocampal neurons in immature rats. Prague Med Rep 2007 108: 67-74.
- Lomoio S, Necchi D, Mares V, Scherini E. A single episode of neonatal seizures alters the cerebellum of immature rats. Epilepsy Res 2011 93: 17-24.
- Erdoğan F, Gölgeli A, Küçük A, Arman F, Karaman Y, Ersoy A. Effects of pentylenetetrazole-induced status epilepticus on behavior, emotional memory and learning in immature rats. Epilepsy Behav 2005 6: 537-542.
- Andre V, Pineau N, Motte JE, Marescaux C, Nehlig A. Mapping of neuronal networks underlying generalized seizures induced by increasing doses of pentylenetetrazol in the immature and adult rat: a c-Fos immunohistochemical study. Eur J Neurosci 1998 10: 2094–2106.
- Velisek L, Kubova H, Pohl M, Stankova L, Mareš P, Schickerova R. Pentylenetetrazol-induced seizures in rats: an ontogenetic study. Naunyn-Schmiedebergs Arch Pharmacology 1992 346: 588-591.
- Hussenet F, Boyet S, Nehlig A. Long-term metabolic effects of pentylenetetrazol-induced status epilepticus in the immature rat. Neuroscience 1995 67: 455-461.
- Motte JE, da Silva Fernandes MJ, Marescaux C, Nehlig A. Effects of pentylenetetrazol-induced status epilepticus on c-Fos and HSP72 immunoreactivity in the immature rat brain. Brain Res Mol Brain Res 1997 50: 79-84.
- Pereira de Vasconcelos AP, Boyet S, Koziel V, Nehlig A. Effects of pentylenetetrazol-induced status epilepticus on local cerebral blood flow in the developing rat. J Cereb Blood Flow Metab 1995 15: 270-283.
- Haut SR, Veliškova J, Moshé SL. Susceptibility of immature and adult brains to seizure effects. Lancet Neurol 2004 3: 608-617.
- Erdoğan F, Gölgeli A, Arman F, Ersoy AO. The effects of pentylenetetrazole-induced status epilepticus on behavior, emotional memory, and learning in rats. Epilepsy Behav 2004 5: 388-393.
- Aniol VA, Stepanichev MY, Lazareva, NA, Gulyaeva NV. An early decrease in cell proliferation after pentylenetetrazole-induced seizures. Epilepsy Behav 2011 22: 433-441.
- Le Magueresse C, Monyer H. GABAergic interneurons shape the functional maturation of the cortex. Neuron 2013 77: 388-405.
- Rakhade SN, Jensen FE. Epileptogenesis in the immature brain: emerging mechanisms. Nat Rev Neurol 2009 5: 380-391.
- Haberer LJ, Pollack GM. Central nervous system uptake kinetics of pentylenetetrazol in the developing rat. Biopharm Drug Dispos 1991 12: 59-71.
- Samoriski GM, Piekut DT, Applegate CD. Differential spatial patterns of Fos induction following generalized clonic and generalized tonic seizures. Exp Neurol 1997 143: 255-268.
- Eells JB, Clough RW, Browning RA, Jobe PC. Comparative fos immunoreactivity in the brain after forebrain, brainstem, or combined seizures induced by electroshock, pentylenetetrazol, focally induced and audiogenic seizures in rats. Neuroscience 2004 123: 279-292.
- Goldman H, Berman RF, Hazlett J, Murphy S. Cerebrovascular responses to pentylenetetrazol: time and dose dependent effects. Epilepsy Res 1992 12: 227-242.
| Recibido: 02 de mayo de 2017 | Aceptado: 22 de mayo de 2017 |
Dra. María-Leonor López-Meraz. Centro de Investigaciones Cerebrales, Universidad Veracruzana. Blvrd. Adolfo Ruiz Cortines, U.H. del Bosque, 91010 Xalapa Enríquez, Ver. Tel: + 52 (228) 8418900 Ext. 16305 Correo electrónico: leonorlopez@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
