El papel de la microglía en la señalización neuroinflamatoria y la respuesta neuroinmune
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Quesada-Yamasaki Daniel1,2*, Arce-Soto Edgardo2,3, Ramírez Karol2,4, Fornaguera-Trías Jaime2,5, Mora-Gallegos Andrea2
1Facultad de Microbiología, Universidad de Costa Rica. San José, Costa Rica. 2Centro de Investigación en Neurociencias, Universidad de Costa Rica. San José, Costa Rica 3Facultad de Microbiología, Universidad de Ciencias Médicas. San José, Costa Rica. 4Departamento de Restaurativa, Facultad de Odontología, Universidad de Costa Rica. San José, Costa Rica. 5Departamento de Bioquímica, Facultad de Medicina, Universidad de Costa Rica. San José, Costa Rica.
Abstract/Resumen
Introducción
Métodos
Conclusión
Financiamiento
Referencias
Correspondencia
La neuroinflamación consiste en un estado reactivo del componente inmune en el sistema nervioso, y se encuentra mediada por efectores celulares, como la microglía y los astrocitos, y efectores moleculares solubles como citoquinas proinflamatorias. Recientemente, se ha investigado en el área de la neuroinmunología el papel del estrés crónico en el aumento de la señalización neuroinflamatoria y sus implicaciones en la alteración del funcionamiento normal del Sistema Nervioso Central (SNC) debido a que provocan una alta respuesta proinflamatoria y una inducción de la proliferación microglial en diversas regiones cerebrales. Además, otro factor que se menciona en la literatura es la relación entre el envejecimiento y microglía, ya que el estudio de dicha señalización neuroinflamatoria ha cobrado relevancia debido a la evidencia de su vinculación con estados patológicos del sistema nervioso como algunas enfermedades neurodegenerativas o alteración de procesos de memoria en el envejecimiento. Se llevó a cabo una revisión sobre el tema, cubriendo aspectos como la caracterización de la respuesta inmune en el SNC, el papel de la microglía como células efectoras de la neuroinflamación, el vínculo existente entre el estrés y el aumento de la señalización neuroinflamatoria y, por último, las evidencias de diferencias en los fenómenos neuroinflamatorios según la edad de los individuos. Con la presente investigación se aclaran algunas concepciones sobre la respuesta inmune en el SNC y se derivan algunas posibles áreas de investigación relacionados con los temas abordados.
Palabras clave: Respuesta inmune, Neuroinflamación, Estrés, Microglía, Edad.
Neuroinflammation can be understood as a reactive status of the immune component in the nervous system, which is mediated mainly by microglia and astrocytes, and soluble effectors such as proinflammatory cytokines. Recently in the area of neuroimmunology, research about the role of chronic stress on increasing neuroinflammatory signaling and its implications in altering the normal functioning of the central nervous system (CNS) has been conducted because it can cause an exaggerated proinflammatory response and induce microglial proliferation in various brain regions. In addition, another factor mentioned in literature is the link between aging and microglia, as the study of this neuroinflammatory signaling has gained importance because of the evidence of its connection with pathological states of the nervous system such as certain neurodegenerative diseases or impaired memory in aging. A review on the subject was conducted, covering aspects such as the characterization of the immune response in the CNS, the role of microglia as effector cells of neuroinflammation, the link between stress and increased neuroinflammatory signaling and, finally, evidence of the differences in the neuroinflammatory profile through aging. With this literature review some conceptions on the immune response in the CNS are clarified and some possible research areas derive from the topics discussed.
Keywords: Respuesta inmune, Neuroinflamación, Estrés, Microglía, Edad.
El estudio de la respuesta inmune en el Sistema Nervioso Central (SNC) y, en particular, el papel de la microglía en los fenómenos neuroinflamatorios, constituye una línea de investigación relevante en la actualidad dado su potencial como herramienta para la comprensión de los mecanismos de la neurodegeneración y sus posibles aplicaciones terapéuticas.1
A continuación se presenta una revisión de la literatura destacada sobre el tema con el objetivo de realizar una síntesis de los hallazgos y de las conclusiones más recientes en torno al tema y, a la vez, proponer orientaciones para futuros esfuerzos en la investigación en neuroinmunología. El abordaje del tema inicia con un tratado sobre las generalidades de la respuesta inmune en el SNC, continúa con el proceso neuroinflamatorio mediado por la microglía, seguido por los efectos del estrés en dicho proceso neuroinflamatorio y, por último, se expone un apartado sobre las diferencias que existen en el desarrollo de la neuroinflamación según la edad del individuo.
Se realizó una búsqueda en las bases de datos PubMed y ScienceDirect utilizando las siguientes palabras clave, tanto en inglés como en español: “respuesta inmune en sistema nervioso central”, “sistema nervioso central inmunoprivilegiado”, “neuroinflamación y microglía”, “estrés y neuroinflamación”, y, por último, “diferencias por edad en neuroinflamación”. Posteriormente se llevó a cabo una revisión de los artículos más relevantes mostrados en los resultados de estas búsquedas, publicados entre 1992 y 2016 (con excepción de dos publicaciones a las que se hace referencia por su relevancia histórica) en los idiomas inglés y español. Se incluyeron artículos de investigación original y de revisión de literatura que permitieran la comprensión de los principales mecanismos neuroinflamatorios en los que se encuentra involucrada la microglía a través de un abordaje del tema desde la investigación básica con roedores u observacional en seres humanos. Se excluyeron todas aquellas obras cuyo enfoque tuviese una orientación marcadamente clínica o terapéutica, debido a que no correspondían al enfoque de este trabajo, además se excluyeron los trabajos cuyos resultados presentaran información redundante respecto de la ya incluida en esta revisión con base en artículos previamente publicados.
3. Respuesta inmune en el sistema nervioso central
3.1. El sistema nervioso central como sitio inmuno-privilegiado
En este apartado se define el enfoque que se abordará en este manuscrito sobre el papel que tiene la respuesta inmune en el SNC, ya que desde la década de 1950 se definieron como inmuno-privilegiados sitios como la retina y el cerebro, además de otros sitios en el organismo (por ejemplo, los testículos), con base en la observación de un menor rechazo de trasplantes en estas zonas en comparación con otros sitios del organismo.2,3 Se definió que los sitios inmuno-privilegiados, son aquellos sitios anatómicos que son capaces de tolerar la introducción de antígenos sin iniciar una respuesta inmune inflamatoria.4 Sin embargo, la denominación de “privilegiado” se refiere a una ventaja adicional que tiene una entidad (en este caso una región anatómica) respecto a otras. Es decir, el concepto de privilegio es algo relativo y no absoluto. De esta manera es como debe ser entendida la condición del SNC como sitio inmuno-privilegiado.5
El concepto de “inmuno-privilegio” relativo cobra fuerza al revisar la evidencia: se ha demostrado que células inmunes como linfocitos pueden ingresar al SNC por diferentes vías: por ejemplo, la entrada al líquido cefalorraquídeo a través del plexo coroideo o al parénquima cerebral a través del espacio perivascular.6 Dicha extravasación de células inmunes al SNC es mediada por moléculas de adhesión como las de la familia de las ICAM (Intracellular Adhesion Molecules, por sus siglas en inglés) y VCAM (Vascular Cell Adhesion Molecules, por sus siglas en inglés), las cuales están presentes en el endotelio de la barrera hematoencefálica.7Por lo tanto, es posible afirmar que la condición del SNC como sitio inmuno-privilegiado no debe ser entendida como la ausencia absoluta de una respuesta inmune en dicho sitio, sino como un sistema en el cual se desarrolla una respuesta inmunológica más regulada en comparación con otros sitios del organismo. Desde esta perspectiva es como será abordado el tema de la respuesta inmune en el SNC.
3.2. Inmunidad en el sistema nervioso central
A continuación, se describen las ramas innata y adaptativa de la respuesta inmune en el SNC. En el caso del sistema nervioso, la línea celular es llamada “neuroglía” y comprende un grupo heterogéneo de células, donde están incluidos los astrocitos, microglía y los oligodendrocitos, las cuales dan soporte al tejido nervioso y facilitan diversas funciones en el SNC.8
La microglía es la población de macrófagos residente del SNC donde la infiltración de monocitos y linfocitos periféricos es limitada.9 La microglía deriva del saco vitelino y, posteriormente, de las células madre en la médula ósea, migra al SNC de forma temprana durante el desarrollo y permanece en el SNC como la población residente de macrófagos. Estas células se encuentran inactivas en el SNC, es decir, son incapaces de realizar funciones efectoras y de presentación de antígenos hasta que se activan por una lesión o infección.10 Se ha sugerido que una de las formas por las que ocurre esta activación es la interacción con las neuronas a través del ligando CD200, una glicoproteína de membrana presente en la neurona, con sus receptores presentes en la microglía.11
Una de las funciones más representativas de la microglía es su actividad fagocítica, presentando un rol eficaz en la limpieza de restos celulares.12 Además, la microglía participa en la programación de la apoptosis en células dañadas.12 Entre sus mecanismos para la producción de la apoptosis están la producción de factores que activan la apoptosis neuronal, como lo son el factor de necrosis tumoral alfa (TNFα), fas-ligando (FasL), producción de especies reactivas del oxígeno (ROS, Reactive Oxygen Species), glutamato, óxido nítrico (NO), entre otras.13 Sin embargo, además de su rol en la muerte celular, se ha encontrado nueva evidencia de que la microglía también juega un papel importante participando en la promoción de la supervivencia celular, la proliferación y la diferenciación de células neurales en el desarrollo del SNC adulto.14
Un estudio realizado por Escalante y colaboradores15 evidencia la participación de la microglía durante la reestructuración neuronal después de lesiones axonales motoras periféricas, en donde el número de células microgliales en la médula espinal incrementa dramáticamente en la fase aguda del proceso y las neuronas dañadas son rápidamente rodeadas por microglía activada. En este ambiente inflamatorio, la microglía pasa rápidamente de su estado de reposo con morfología ramificada a un fenotipo ameboide con prolongaciones escasas y es capaz de fagocitar los restos sinápticos.15
Con respecto a la inmunidad adaptativa, se debe recordar que es aquella capaz de reconocer de manera específica antígenos provenientes de microorganismos o células alteradas, para luego montar una respuesta capaz de eliminarlos.16 Las células protagonistas de la respuesta inmune adaptativa son los linfocitos T, que actúan como señalizadores, los linfocitos B, como secretoras de inmunoglobulinas o anticuerpos, y las células presentadoras de antígenos, las cuales activan a los linfocitos T y pueden ser: macrófagos, células dendríticas, linfocitos B y, en el caso del SNC, células de la microglía.16
Continuando con la respuesta inmune adaptativa en el SNC, se ha demostrado la presencia de ARNm para la síntesis de IgG, así como de IgG proteica y de los receptores FcRn y FcγR en neuronas y microglía del sistema nervioso humano.17 Con ello se ha sugerido que las células del sistema nervioso humano también expresan IgG de manera endógena, la cual puede cumplir una función protectora frente a agentes extraños.17 La IgG media la opsonización de patógenos para facilitar la fagocitosis por parte de la microglía, que reconoce los fragmentos Fc de esta inmunoglobulina por medio de FcγR, según se ha reportado.18
4. Mecanismos de señalización neuroinflamatoria mediados por microglía
La inflamación puede ser entendida como un fenómeno de respuesta del tejido a un daño, la cual puede darse de forma aguda o crónica, según el tiempo que tome y el perfil de la respuesta celular.19Aunque en la periferia del organismo la inflamación implica la infiltración de leucocitos en el tejido dañado, en la neuroinflamación esto solamente ocurre si se da una disrupción de la barrera hemato-encefálica (BHE).19
Dicho concepto de neuroinflamación abarca la respuesta o el conjunto de respuestas que se da en el SNC ante algún daño ocurrido en el tejido.19 Aunque este término técnicamente incluye las respuestas agudas como la gliosis reactiva (activación rápida de células gliales), el enfoque de estudio de la neuroinflamación en esta revisión se orienta principalmente a su relación con el desarrollo de procesos patológicos crónicos del sistema nervioso, por lo que se le da al término una connotación de proceso crónico y progresivo.19
Como se mencionó anteriormente, una parte importante de la respuesta neuroinflamatoria está relacionada con las células de la microglía en las cuales se demostró, mediante un estudio en ratones, la expresión de todas las clases descritas de receptores tipo Toll (TLR).20 Los TLR están relacionados con la respuesta inmune innata ya que son capaces de reconocer productos microbianos (PAMPs, Pathogen-Associated Molecular Patterns) y productos de daño celular (DAMPs, Damage-Associated Molecular Patterns).21
Se ha visto que la activación de estos receptores presentes en la microglía, por medio de la inyección de agonistas de TLR, se traduce en una mayor expresión de citoquinas pro-inflamatorias y quimioquinas (por ejemplo, TNFα) además de un aumento en la cantidad de moléculas del MHC-II en membrana, lo cual convierte a la microglía en una eficiente célula presentadora de antígenos.20
Otros estímulos bioquímicos que regulan la actividad de la microglía incluyen: citoquinas proinflamatorias como interleuquina (IL)-2, IL-6, IL-15, interferón gamma (IFNγ>) y TNFα; citoquinas anti-inflamatorias como IL-4, IL-10 e IL-13; y otras señales celulares como nucleótidos (especialmente ATP) y la fractalquina (CX3CL1).22
Ante la exposición a citoquinas proinflamatorias, las células de la microglía se activan y esto se traduce en una serie de procesos: se da la transformación morfológica de un estado ramificado inactivo a uno fagocítico activo,23 además de la proliferación y migración hacia los sitios de lesión por quimiotaxis.24 Dicha activación también provoca una liberación de productos por parte de la microglía que pueden tener efectos neurotóxicos dentro de los que se encuentran citoquinas proinflamatorias como IL-1β, TNFα, IFNγ;22 compuestos oxidantes como ROS y NO;25 y aminoácidos excitatorios como el glutamato.26
La liberación prolongada de mediadores proinflamatorios por parte de la microglía podría contribuir en el desarrollo de procesos neurodegenerativos,27 como los que se dan en la enfermedad de Alzheimer, de Parkinson y de Huntington, los cuales se caracterizan por la pérdida neuronal lenta y progresiva en ciertas áreas del cerebro como el hipocampo, el cuerpo estriado, la substantia nigra pars compacta (SNpc) y la corteza cerebral.28
La relación entre los fenómenos neuroinflamatorios mediados por la microglía con procesos neurodegenerativos se basa en que un estado de activación crónica de la microglía induce una respuesta excesiva a los estímulos en comparación con un estado de activación agudo.29 Se piensa que es por esta respuesta excesiva de la microglía que la neuroinflamación crónica contribuye a la pérdida sináptica y de neuronas característica de las enfermedades neurodegenerativas (Tabla 1).
Tabla 1. Principales enfermedades neurodegenerativas cuyos mecanismos se han visto involucrados con la neuroinflamación.

Muchos de los estudios actuales que investigan sobre la posible cura para las enfermedades neurodegenerativas mencionadas anteriormente, le han prestado atención a la búsqueda de métodos para normalizar este fenómeno de reactividad excesiva en las células de la microglía, sin inhibir sus funciones elementales o provocar una reducción de la microglía total.1 De hecho, entre los enfoques terapéuticos que se han desarrollado recientemente para la enfermedad de Parkinson se encuentran los fármacos inhibidores de la enzima convertidora de angiotensina, ya que la angiotensina es un activador de la microglía, por lo que uno de los fines de estos fármacos es inhibir la actividad proinflamatoria de la microglía.37
Por otro lado, el progreso alcanzado en estudios de asociación genética ha permitido identificar una serie de genes candidatos que funcionarían como blancos terapéuticos: por ejemplo, APOE, IL1RAP, TREM2, en el caso de la enfermedad de Alzheimer.1
Sin embargo, muchos de esos estudios de asociación sólo han podido establecer una secuencia blanco, sin poder determinar, en la mayoría de los casos, la función de las proteínas identificadas e involucradas en los diferentes procesos, por lo que se debe tomar en cuenta esta limitación.38 Tal es el caso de genes como TREM2, cuyo abordaje en caso de ser utilizado como blanco terapéutico no podría reducirse simplemente a una potenciación o a una inhibición de su actividad, sino que se requiere una modulación más específica, lo cual lo vuelve un blanco terapéutico complejo.
5. Estrés y su efecto en el aumento de la señalización neuroinflamatoria
Para efectos del presente texto, se abordará el concepto de estrés desde la perspectiva biológica planteada por Selye en 1950 y retomada por Fink,39 entendiéndolo como “la respuesta inespecífica del organismo ante cualquier demanda”. Esta definición, a pesar de ser muy general, permite comprender el estrés psicológico o cognitivo, y al mismo tiempo facilita el estudio a nivel molecular, genotípico y fenotípico del estrés y de las respuestas al estrés en diferentes especies.40 La respuesta al estrés se desarrolla en una cascada de eventos que involucra al eje hipotálamo-pituitario-adrenal (HPA).39 La respuesta inicia con la liberación de secretagogos de la hormona adenocorticotropa (ACTH, del inglés Adenocorticotropic Hormone) como la hormona liberadora de corticotropina (CRH, del inglés Corticotropin Releasing Hormone) en el núcleo para-ventricular del hipotálamo.40 La CRH viaja por la circulación porta- hipofisaria y actuando sobre las células adenocorticotropas en la hipófisis anterior, promueve la liberación de la ACTH a la circulación sistémica, la cual actuando sobre la corteza suprarrenal favorece la liberación de glucocorticoides (como el cortisol en seres humanos o la corticosterona en roedores).40
El estrés, cualquiera que sea, físico o psicológico, induce alteraciones en la respuesta inmune. A menudo la exposición a un factor estresante puede desencadenar una respuesta pro-inflamatoria en el cerebro. Estas respuestas están mediadas por una variedad de moléculas inflamatorias, que incluyen neuropéptidos, citoquinas y hormonas entre otras.41
La respuesta al estrés afecta a diferentes órganos y sistemas, mayormente al sistema cardiovascular y al SNC. En el SNC de roedores, el estrés crónico causa atrofia reversible de las células del hipocampo en el curso de semanas y además inicia cambios apoptóticos en el área cortical y del hipocampo.41 Además la exposición al estrés crónico puede causar pérdida permanente de neuronas en roedores y potenciar la expresión de genes pro-inflamatorios en la corteza frontal y en el hipocampo, lo cual se cree que está mediado por la alteración en el metabolismo neuronal de a glucosa por parte de los glucocorticoides.41
Diferentes reportes han probado que el estrés también juega un papel importante en la activación de la microglía. Por ejemplo, se ha demostrado la elevación tanto de la proteína de IL-1β como de su ARNm en diferentes regiones cerebrales luego de la exposición de ratas a un agente estresor agudo.42 Posteriormente, se comprobó que dicha respuesta de las citoquinas proinflamatorias ante el estrés era mediada por la microglía.43 Además, se reporta que la repetida exposición al estrés generado por inmovilización44,45 e inmersión en agua45 induce la activación y proliferación de células de microglía en hipocampo, núcleo accumbens, materia gris periacueductal y otras regiones cerebrales en ratas, lo cual se ha relacionado directamente con una elevación de glucocorticoides.46
En contraste con lo anterior, un estudio in vitro con la línea celular de microglía BV2 propone que la corticosterona (principal hormona del estrés en roedores), por medio de la interacción con el receptor de glucocorticoides (Glucocorticoid receptor, GR, por sus siglas en inglés) inhibe la proliferación de dichas células y además tiene un efecto citotóxico.47Este grupo de investigadores plantea que el daño neural producto del estrés se debe entonces al efecto de los corticosteroides en sí mismo y también a la disminución de la función protectora de la microglía, que es inhibida por los corticosteroides.
La discrepancia entre esta última investigación y otras que demuestran el efecto proliferativo de los corticosteroides en la microglía46,48 puede deberse a la utilización de una técnica in vitro con una línea celular específica,47 lo cual presenta la limitación de que no se presentan todas las vías de señalización que podrían activar eventualmente la microglía en el SNC, como la señalización que se da por parte de las neuronas,22 por ejemplo.
El estrés actúa entonces como un inductor del ambiente neuroinflamatorio, principalmente por la vía del eje HPA, cuya respuesta final es un aumento en la concentración de glucocorticoides en sangre. Por lo tanto, la tendencia general es la de concebir el estrés (sobre todo el estrés crónico) como un activador de la microglía con consecuencias como la proliferación de estas células, la elevación de su actividad secretora de productos pro-inflamatorios y el aumento de su capacidad como mediador celular en la presentación de antígenos (Figura 1), lo cual la convierte en un potencial activador de procesos neurodegenerativos.
Figura 1. Papel de la microglía como efector celular en la neuroinflamación. (1) La microglía inactiva recibe estímulos a través de receptores como los tipo Toll (TLRs) y los receptores de citoquinas, que llevan a su activación. (2) Dicha activación puede verse exacerbada por una sensibilización producto de la acción de glucocorticoides, derivados del estrés crónico, los cuales desencadenan una cascada de señalización intracelular a través del receptor de glucocorticoides (GR) que favorece la transcripción de diferentes productos proinflamatorios. (3) Al ser activada, la microglía prolifera, adquiere una morfología ameboide, expresa una mayor cantidad de moléculas del MHC-II en su superficie (lo que la convierte en una célula presentadora de antígenos más apta) y secreta productos como citoquinas proinflamatorias, agentes oxidantes y aminoácidos excitatorios. (4) El mantenimiento crónico de dicho ambiente neuroinflamatorio puede llevar a pérdida sináptica, daño neuronal e incluso apoptosis de neuronas, entre otras consecuencias.
6. Diferencias en el efecto del estrés sobre la señalización neuroinflamatoria según la edad El estudio de las diferencias del ambiente neuroinflamatorio según la edad ha cobrado importancia dada su posible implicación en los fenómenos neurodegenerativos. Por ejemplo, se ha detectado por medio de un ELISA de extracto proteico de cerebelo, de la corteza y del hipocampo de ratones, que la citoquina proinflamatoria IL-6 se encuentra elevada en dichas regiones cerebrales de animales envejecidos, en comparación con ratones jóvenes y adultos.49 Además, en el mismo estudio se evidenció una tendencia a un mayor número de microglía en los cultivos celulares de cerebros de ratones envejecidos, añadiendo que estas células mostraban una morfología con más ramificaciones y una mayor reactividad, ya que secretaban más IL-6 de manera espontánea que las células microgliales de los cerebros de ratones neonatos y adultos.49 En línea con lo anterior, utilizando PCR de tiempo real, se han demostrado mayores niveles de expresión de ARNm de otras citoquinas proinflamatorias (TNFα, IL-1β, IL-12) en el cultivo celular de microglía aislada de cerebros de ratones envejecidos, pero también de citoquinas anti-inflamatorias como TGF-1β e IL-10.50 Se cree que dicha activación basal sostenida en la microglía en edades avanzadas se debe a la acumulación de daño neuronal producto del envejecimiento, con lo cual se genera un ciclo de retroalimentación positiva ya que los niveles elevados de citoquinas proinflamatorias provocan más degeneración del tejido a largo plazo.50 Al comparar el efecto de un estímulo inmunológico periférico como el lipopolisacárido (LPS), se observó que la microglía de ratones envejecidos expresa niveles mayores de IL-1β, IL-10 y TLR en comparación con la microglía de ratones adultos.51 Por lo tanto, se plantea la hipótesis de que existe una sensibilización de la microglía producto de la edad, que puede llevar a una respuesta neuroinflamatoria exagerada. Estos cambios en la microglía de animales envejecidos varían según las regiones cerebrales en estudio. En cerebros de ratones envejecidos, se demostró una mayor cantidad de marcadores fenotípicos de microglía (CD11b, CD11c y CD68) en la sustancia blanca que en la sustancia gris cerebral,52 siendo esto indicativo de una mayor activación de la microglía en la sustancia blanca. Además se ha observado una mayor activación de la microglía en la porción caudal al compararla con la porción rostral del cerebro, lo cual puede deberse a una diferencia en la expresión de señales neuronales reguladoras de la microglía como CD200 y la fractalquina a lo largo del eje rostro-caudal de roedores envejecidos.52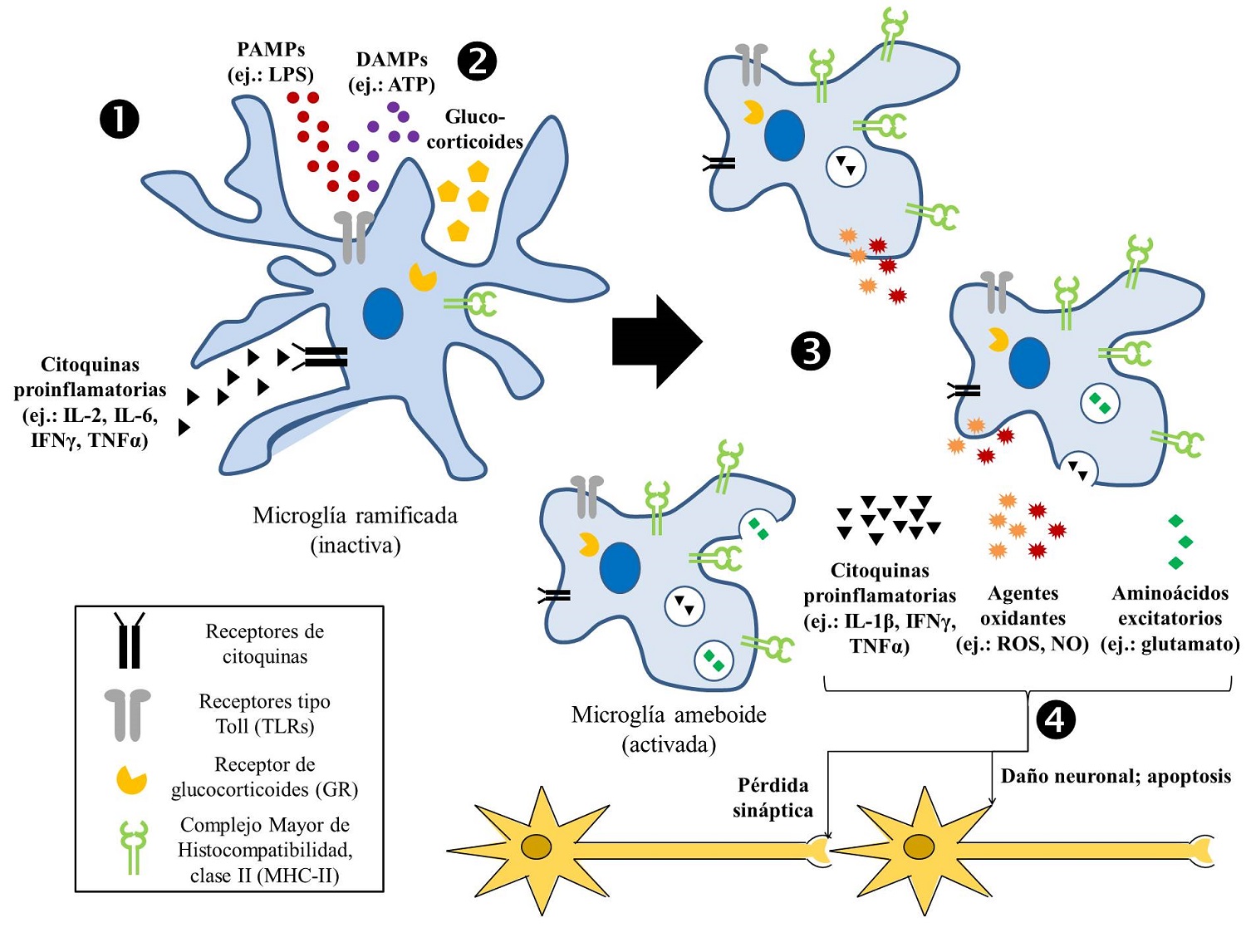
En cuanto a los efectos del estrés en ratas envejecidas, recientemente un grupo de investigadores demostró utilizando microdiálisis, la presencia de niveles mayores de corticosterona en el hipocampo de ratas envejecidas en comparación con ratas jóvenes, esto durante la fase de inactividad (fase de luz en el ciclo luz-oscuridad) de los animales.53 Esta elevación de la corticosterona durante la fase de inactividad fue explicada, en parte, por un incremento en la enzima 11-β hidroxiesteroide deshidrogenasa tipo I (11β-HSD 1), la cual se encarga de convertir el precursor inactivo de la corticosterona en su forma activa.53
Los niveles elevados de corticosterona en el cerebro de ratas envejecidas tienen implicaciones funcionales, ya que esta hormona induce una mayor activación del GR en la microglía. De esta manera, las células de la microglía de cerebros de ratas envejecidas se encuentran sensibilizadas por lo que se da un aumento en la producción de citoquinas proinflamatorias al someterlas a un estímulo inmune, en comparación con la microglía de ratas jóvenes.53
Dicho grupo llega a la conclusión de que el envejecimiento se encuentra asociado con sensibilización de la microglía en el hipocampo (producto de la activación del GR) que, al ser activada como consecuencia de un estímulo inmune, desencadena una respuesta neuroinflamatoria que puede alterar los procesos de memoria.53 Aunque estos autores no profundizan en los posibles mecanismos subyacentes a la alteración de los procesos de memoria, se puede sugerir que esta alteración ocurre debido a procesos como daño sináptico, producción de ROS y disminución en las funciones neurotróficas de la microglía, todos ellos mencionados en la literatura como parte de los factores microgliales involucrados en la neurodegeneración.1
Debido al papel relevante que parece tener la neuroinflamación, en los procesos neurodegenerativos y a sus posibles implicaciones terapéuticas, es importante profundizar en el estudio de las diferencias que existen entre la población microglial de cerebros de animales jóvenes, adultos y envejecidos, abarcando desde la caracterización fenotípica hasta los diferentes perfiles de activación y proliferación en respuesta a condiciones como el estrés agudo o crónico.
Se han analizado someramente diferentes aspectos del fenómeno neuroinflamatorio: desde la importancia de concebir el inmuno-privilegio del SNC como algo relativo, hasta el papel de la respuesta inmune, siendo la microglía el principal efector. El estudio de la microglía ha revelado una participación importante en los procesos neurodegenerativos a través de la inducción de un ambiente inflamatorio, el cual puede ser potenciado por la exposición al estrés crónico.
El estrés se ha considerado un factor esencial en procesos de respuestas inflamatorias en el SNC y se ha visto que puede afectar gravemente ciertas funciones a través del eje HPA y por lo tanto en el aumento de glucocorticoides, lo cual provoca una proliferación de microglía en hipocampo, núcleo accumbens, entre otros. A su vez, el estudio de la microglía ha revelado una participación importante en los procesos neurodegenerativos a través de la inducción de un ambiente proinflamatorio, el cual puede ser potenciado por la exposición al estrés crónico. Estos procesos pueden ser importantes principalmente en edades avanzadas (en procesos de envejecimiento normal), ya que al parecer, el aumento de la microglía, de la corticosterona y de algunas citoquinas proinflamatorias, por ejemplo, pueden tener efectos perjudiciales en la salud del individuo al alterar procesos de memoria o inclusive, llevar al desarrollo de enfermedades neurodegenerativas como el Alzheimer, Parkinson, entre otras. Sin embargo, los procesos relacionados con estas variables han sido poco estudiados, y por lo tanto, poco entendidos.
A partir de lo señalado en este artículo, se desprende la importancia de abordar y entender en futuras investigaciones los mecanismos involucrados en la sensibilización de la microglía como respuesta al estrés y además describir los procesos subyacentes a los cambios que se dan en estas células gliales como producto del envejecimiento, todo lo cual parece estar de una manera o de otra asociado con procesos neuroinflamatorios.
8. Conflicto de intereses
No existen potenciales conflictos de interés para ninguno de los autores en este informe científico.
Los autores no han declarado fuente alguna de financiamiento, aparte de la personal, para este informe científico.
- Wes P, Sayed F, Bard F, Gan L. Targeting microglia for the treatment of Alzheimer’s disease. Glia 2016; 64(6): 1-23.
- Billingham R, Boswell T. Studies on the problem of corneal homografts. P Roy Soc Lond B Bio 1953; 141(904): 392-406.
- Barker C, Billingham R. Immunologically privileged sites. Adv Immunol 1977; 25: 1-54.
- Hong S, Van Kaer L. Immune Privilege: Keeping an Eye on Natural Killer T Cells. J Exp Med 1999; 190(9): 1197–1200.
- Galea I, Bechmann I, Perry H. What is immune privilege (not)? Trends Immunol 2007; 28(1): 12-18.
- Shrestha R, Millington O, Brewer J, Bushell T. Is Central Nervous System an Immune-Privileged site? Kathmandu Univ Med J 2013; 41(1): 102-107.
- Engelhardt B. Molecular mechanisms involved in T cell migration across the blood-brain barrier. J Neural Transm 2006; 113(4): 477-485.
- González J, Toro J. La neuroglia en la respuesta inmune del sistema nervioso central. Acta Neurol Colomb 2007; 23: 25-30.
- Engelhardt, B. The blood-central nervous system barriers actively control immune cell entry into the central nervous system. Curr Pharm Design 2008; 14(16): 1555-1565.
- Shrikant P, Benveniste E. The Central Nervous System as an immunocompetent organ: role of glial cells in antigen presentation. J Immunol 1996; 157: 1819-1822.
- Neumann, H. Control of Glial Immune Function by Neurons. Glia2001; 191-199.
- Marín-Teva L, Cuadros M, Martín-Oliva D, Navascués J. Microglia and neuronal cell death. Neuron Glia Biol 2011; 7(1): 25-40.
- Bessis A, Bechade C, Bernard D, Roumier A. Microglial control of neuronal death and synaptic properties. Glia 2007; 55: 233–238.
- Schafer D, Stevens B. Microglia Function in Central Nervous System Development and Plasticity. Cold Spring Harb Perspect Biol2015; 7(10): 1-18.
- Escalante-Martínez D, Chavarría A, Gutiérrez-Ospina G, Romo-González T. Evaluación cualitativa del estado de activación de la microglía a largo plazo en el cerebro de ratones enucleados al nacer. Rev Med UV 2009; 9(2): 13-18.
- Kindt T, Goldsby R, Osborne B. Inmunología de Kuby. 6a ed. México: McGraw Hill Interamericana, 2007; 8-14.
- Niu N, Zhang J, Guo Y, Zhao Y, Korteweg C, Gu J. Expression and distribution of immunoglobulin G and its receptors in the human nervous system. Int J Biochem Cell B 2011; 43: 556-563.
- Aloisi, F. Immune function of microglia. Glia 2001; 36: 165–179.
- Streit W, Mrak R, Griffin W. Microglia and neuroinflammation: a pathological perspective. J Neuroinflammation 2004; 1(14): 1-4.
- Olson J, Miller S. Microlgia initiate Central Nervous System innate and adaptive immune responses through multiple TLRs. J Immunol 2004; 173: 3916-3924.
- Marinelli C, Di Liddo R, Facci L, Bertalot T, Conconi M, Zusso M, Skaper S, Giusti P. Ligand engagement of Toll-like receptors regulates their expression in cortical microglia and astrocytes. J Neuroinflammation 2015; 12 (244): 1-20.
- Hanisch U. Microglia as a source and target of cytokines. Glia 2002; 40: 140-155.
- Lyman M, Lloyd D, Ji X, Vizcaychipi M, Ma D. Neuroinflammation: The role and consequences. Neurosci Res 2014; 79: 1-12.
- Honda S, Sasaki Y, Ohsawa K, Imai Y, Nakamura Y, Inoue K, Kohsaka S. Extracellular ATP or ADP induce chemotaxis of cultured microglia through Gi/o-coupled P2Y receptors. J Neurosci 2001; 21(6): 1975-1982.
- Boje K, Arora P. Microglial-produced nitric oxide and reactive nitrogen oxides mediate neuronal cell death. Brain Res 1992; 587(2): 250-256.
- Takeuchi H, Jin S, Wang J, Zhang G, Kawanokuchi J, Kuno R, Sonobe Y, Mizuno T, Suzumura A. Tumor necrosis factor-alpha induces neurotoxicity via glutamate release from hemichannels of activated microglia in an autocrine manner. Journal Biol Chem 2006; 281(30): 21362-21368.
- Liu B, Hong J. Role of microglia in inflammation-mediated neurodegenerative diseases: mechanisms and strategies for therapeutic intervention. Journal Pharmacol Exp Ther 2003; 304: 1-7.
- Hong H, Kim BS, Im H. Pathophysiological role of neuroinflammation in neurodegenerative diseases and psychiatric disorders. Int Neurourol J 2016; 20(Suppl 1): S2-7.
- Holtman IR, Raj DD, Miller JA, Schaafsma W, Yin Z, Brouwer N, Wes PD, Moller T, Orre M, Kamphuis W, Hol EM, Boddeke EW, Eggen BJ. Induction of a common microglia gene expression signature by aging and neurodegenerative conditions: A co-expression meta-analysis. Acta Neuropathol Commun 2015; 3:31.
- Frank-Cannon T, Alto L, McAlpine F, Tansey M. Does neuroinflammation fan the flame in neurodegenerative diseases? Mol Neurodegener 2009; 4(47): 1-13.
- Calsolaro V, Edison P. Neuroinflammation in Alzheimer’s disease: Current evidence and future directions. Alzheimers Dement 2016; 12(6): 719-732.
- Hunot S, Hirsch EC. Neuroinflammatory processes in Parkinson's disease. Ann Neurol 2003; 53 (suppl 3):549–60.
- González-Torres L, Armendáriz-Borunda, J. Aspectos inmunológicos en la enfermedad de Parkinson. Arch Neurocien 2005; 10(3): 168-174.
- Martin H, Santoro M, Mustafah S, Riedel G, Forrester J, Teismann P. Evidence for a role of adaptive immune response in the disease pathogenesis of the MPTP mouse model of Parkinson’s disease. Glia 2016; 64:386-396.
- Bjorkqvist M, Wild EJ, Thiele J, Silvestroni A, Andre R, Lahiri N, Raibon E, Lee RV, Benn CL, Soulet D, et al. A novel pathogenic pathway of immune activation detectable before clinical onset in Huntington's disease. J Exp Med 2008; 205(8): 1869-1877.
- Crotti A, Glass C. The choreography of neuroinflammation in Huntington’s disease. Trends Immunol 2015; 36(6): 364-373.
- Zhang H, Tong R, Bai L, Shi J, Ouyang L. Emerging targets and new small molecule therapies in Parkinson’s disease treatment. Bioorg Med Chem 2016; 24: 1419-1430.
- Manolio T. Bringing genome-wide association findings into clinical use. Nat Rev Gen 2013; 14: 549–558.
- Fink G. Stress Science: Neuroendocrinology. San Diego, California: Elsevier, 2010; 5-7.
- Herman J. Neural pathways of stress integration: Relevance to alcohol abuse. Alcohol Res 2012; 34(4): 441-447.
- Munhoz C, García-Bueno B, Madrigal J, Lepsch L, Scavone C, Leza J. Stress-induced neuroinflammation: mechanisms and new pharmacological targets. Braz J Med Biol Res 2008; 41: 1037-1046.
- O’Connor K, Johnson J, Hansen M, Wieseler-Frank J, Maksimova E, Watkins L, Maier S. Peripheral and central proinflammatory cytokine response to a severe acute stressor. Brain Res 2003; 991: 123-132.
- Blandino P, Barnun C, Deak T. The involvement of norepinephrine and microglia in hypothalamic and splenic IL-1B responses to stress. J Neuroimmunol 2006; 173: 87-95.
- Tynan R, Naicker S, Hinwood M, Nalivaiko E, Buller K, Pow D, Day T, Walker F. Chronic stress alters the density and morphology of microglia in a subset of stress-responsive brain regions. Brain Behav Immun 2010; 24: 1058-1068.
- Sugama S, Takenouchi T, Fujita M, Conti B, Hashimoto M. Differential microglial activation between acute stress and lipopolysaccharide treatment. J Neuroimmunol 2009; 207: 24-31.
- Nair A, Bonneau R. Stress-induced elevation of glucocorticoids increases microglia proliferation through NMDA receptor activation. J Neuroimmunol 2006; 171: 72-85.
- Nakatani Y, Amano T, Tsuji M, Takeda H. Corticosterone suppresses the proliferation of BV2 microglia cells via glucocorticoid, but not mineralocorticoid receptor. Life Sci 2012; 91: 761-77.
- Dinkel K, MacPherson A, Sapolsky R. Novel glucococorticoid effects on acute inflammation in the CNS. J Neurochem 2003; 84: 705-716.
- Ye S, Johnson R. Increased interleukin-6 expression by microglia from brain of aged mice. J Neuroimmunol 1999; 93: 139-148.
- Sierra A, Gottfreid-Blackmore A, McEwen B, Bullock C. Microglia derived from aging mice exhibit an altered inflammatory profile. Glia 2007; 55: 412-424.
- Henry C, Huang Y, Wynne A, Godbout J. Peripheral lipopolysaccharide (LPS) challenge promotes microglial hyperactivity in aged mice that is associated with exaggerated induction of both proinflammatory IL-1B and anti-inflammatory IL-10 cytokines. Brain Behav Immun 2009; 23: 309-317.
- Hart A, Wyttenbach A, Perry V, Teeling J. Age related changes in microglial phenotype vary between CNS regions: Grey versus white matter differences. Brain Behav Immun 2012; 26: 754-765.
- Barrientos R, Thompson V, Kitt M, Amat J, Hale M, Frank M, Crysdale N, Stamper C, Hennessey P, Watkins L, Spencer R, Lowry C, Maier S. Greater glucocorticoid receptor activation in hippocampus of aged rats sensitizes microglia. Neurobiol Aging 2015; 36: 1483-1495.
| Recibido: 14 de julio de 2016 | Aceptado: 10 de octubre de 2016 |
Daniel Quesada-Yamasaki. Centro de Investigación en Neurociencias, Universidad de Costa Rica. Sede “Rodrigo Facio Brenes”, Montes de Oca, San José, Costa Rica. C.P. 2060 San José. Teléfono: +506 2511-8256. Correo electrónico: daniel.quesadayamasaki@ucr.ac.cr
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
