Actividad antioxidante de la adrenomedulina en el vermis cerebeloso de la rata hipertensa: efecto de la amlodipina
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Leticia Figueira y Anita Israel
Laboratorio de Neuropéptidos, Facultad de Farmacia, Universidad Central de Venezuela. Caracas, Venezuela.
Resumen/Abstract
Introducción
Material y métodos
Resultados
Discusión
Agradecimientos
Referencias
Correspondencia
La adrenomedulina (AM) es un péptido ubicuo presente en el cerebelo, que participa en la regulación de la presión arterial (PA) y ejerce acciones antioxidantes. El sistema AM-cerebeloso se encuentra alterado durante la hipertensión. Se evaluó el efecto de la reducción de la PA, sobre la acción antioxidante de la AM cerebelosa mediante el uso de amlodipina. Se determinó la producción de sustancias que reaccionan con el ácido tiobarbitúrico (TBARS) y la actividad de las enzimas antioxidantes, superóxido dismutasa (SOD), catalasa (CAT) y glutatión peroxidasa (GPx) durante la hipertensión. Ratas SHR y WKY adultas, recibieron amlodipina (5mg/Kg/día, p.o.) o vehículo, durante once días. Las ratas fueron sacrificadas, se disecó el corazón y el vermis cerebeloso. Se determinó el tamaño del corazón, diámetro de los miocitos y la PA antes y al final del tratamiento. Se estimuló el vermis in vitro con AM. Se homogeneizó, centrifugó el tejido y determinó la concentración de proteínas, la producción de TBARS y la actividad SOD, CAT y GPx. La AM redujo la producción de TBARS y la actividad basal de CAT, GPx y SOD en ratas WKY más no en las SHR. El tratamiento con amlodipina disminuyó el tamaño del corazón, el diámetro de los miocitos, la PA y restituyó la capacidad antioxidante de la AM en ratas SHR. Estos resultados apoyan el papel de la AM cerebelosa como regulador de las enzimas antioxidantes y su alteración en la hipertensión y sugieren un papel de la AM cerebelosa en el control de la PA.
Palabras clave: Adrenomedulina, Hipertensión, Enzimas antioxidantes, Presión arterial.
Adrenomedullin (AM) is a ubiquitous peptide which is present in the cerebellum. There is evidence that cerebellar AM participates in blood pressure (BP) regulation and exerts antioxidant actions. Cerebellar AM-system is altered during hypertension. Therefore, in this study we assessed the effect of blood pressure reduction with amlodipine on the antioxidant action of cerebellar AM. Thiobarbituric acid reactive substances (TBARS) production and antioxidant enzymes activity, superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPx) was assessed during hypertension. Adult SHR and WKY rats were divided into two groups receiving amlodipine (5 mg/kg/day, p.o.) or vehicle, for eleven days. The rats were sacrificed, the heart and cerebellar vermis were dissected, and heart weight, miocyte diameter and BP was determined before and at the end of treatment. Cerebellar vermis was stimulated in vitro with AM. Tissue was homogenized and centrifuged and tissue protein concentration, TBARS production and activity of SOD, CAT and GPx determined. Our results demonstrate that AM reduced TBARS production and basal CAT, GPx and SOD activity in WKY rats but not in SHR. Treatment with amlodipine reduced heart weight, myocyte diameter and BP; and reversed the lack of AM antioxidant activity in SHR rats. These results support the role of AM as a regulator of antioxidant enzymes in rat cerebellum and its dysregulation during hypertension, and suggests a role for cerebellar AM in BP control.
Key words: Adrenomedullin, Hypertension, Antioxidant enzymes, Blood pressure.
La adrenomedulina (AM) es un péptido ubicuo de 52 residuos de aminoácidos en el humano y de 50 residuos de aminoácidos en la rata, al que se le han atribuido importantes funciones en la regulación de la función cardiovascular a través de efectos tanto a nivel periférico como central, pues cumple diversas acciones biológicas, entre las que se incluyen la vasodilatación, inhibición de la secreción de endotelina, diuresis, natriuresis, broncodilatación, regulación del crecimiento y proliferación celular.1,2
Las acciones de la AM son mediadas a través de la unión del péptido a sus receptores, los cuales están constituidos por el receptor similar al receptor de calcitonina (CRLR) y una molécula accesoria, la proteína que modifica la actividad del receptor (RAMP). Los receptores específicos de la AM, AM1 y AM2, están constituidos por el complejo CRLR con RAMP2 o RAMP3, respectivamente. Asimismo, la AM ejerce diversas acciones a través de su unión con el receptor del péptido relacionado con el gen de la calcitonina (CGRP), constituido por el heterodímero CRLR y RAMP1.3,4
La AM y los componentes de sus receptores se encuentran ampliamente expresados en diferentes células, tejidos y órganos como, la glándula suprarrenal, corazón, riñón, pulmón, aorta, páncreas, intestino delgado, hígado, bazo, tiroides, testículo, vasos sanguíneos, células endoteliales y de músculo liso, entre otros.5,6A nivel del sistema nervioso central, se ha demostrado que la AM se encuentra ampliamente distribuida en el cerebro humano y de animales como, ratas, ratones y sapo; evidenciándose igualmente en el cerebelo.7-9
En relación a los receptores de AM, se ha demostrado sitios de unión específicos a la AM en varias regiones del cerebro humano como la corteza cerebral, tálamo, hipotálamo, tallo, bulbo raquídeo y cerebelo.10 De hecho, se encontró que el ARNm de RAMP1 muestra una amplia distribución en el cerebro localizándose en el hipocampo, núcleo accumbens, tubérculo olfatorio, caudado putamen, corteza cerebral, cerebelo y epéndimo ventricular.11 Por su parte, el ARNm de RAMP2 se encuentra en regiones como hipocampo, bulbo olfatorio, plexos coroides de los ventrículos cerebrales y cerebelo. Igualmente, el ARNm del RAMP3 se demostró en la corteza cerebral, tálamo y cerebelo; evidenciándose colocalización del CRLR con RAMP1 en el caudado putamen y núcleo amigdaloide, y con el RAMP2 en los plexos coroides ventricular y en la pared de los vasos sanguíneos.
A nivel del cerebelo, pocos han sido los estudios que se han llevado a cabo con la AM; en este sentido, se ha demostrado la presencia de sitios de unión a la AM e inmunorreactividad a la AM en el cerebelo de ratas normotensas.6,8,10 De igual manera, se ha descrito la expresión de CRLR, RAMP2 y RAMP3 a este nivel.12,13 Igualmente, la inmunorreactividad a la AM se ha evidenciado en los núcleos lateral, interpósito y medial cerebelar; así como en las capas molecular, de las células de Purkinje y en la granular de la corteza cerebelar.7
Existe evidencia de que los receptores de AM cerebelosos están involucrados en la regulación de la presión arterial. En efecto, recientemente hemos demostrado que la expresión de AM y de los componentes de sus receptores en el cerebelo de la rata se encuentra alterada durante la hipertensión.14 Así, se demostró un aumento en la expresión de CRLR, RAMP1 y RAMP3, y una disminución en la expresión de la AM y RAMP2 en el cerebelo de ratas hipertensas con respecto a las normotensas. Aunado a esto, los hallazgos demostraron un papel funcional de la AM cerebelosa, ya que la microinyección in vivo de la AM en el vermis cerebeloso ejerce un efecto hipotensor profundo, dependiente de la dosis, en ratas hipertensas pero no en ratas normotensas.15 Estos hallazgos indican una desregulación del sistema adrenomedulinérgico cerebelar durante la hipertensión y sugieren que la AM cerebelosa juega un papel importante en la regulación de la presión arterial.
La AM ha demostrado tener efecto sobre la producción de radicales libres, pues es capaz de disminuir la producción de especies reactivas de oxígeno (EROs) mediada por la nicotinamida adenina dinucleótido fosfato-oxidasa (NAD(P)H oxidasa), a través de la inhibición de la actividad de dicha enzima.16 De igual manera, se ha demostrado que la AM posee propiedades protectoras contra el daño a órganos producidos por condiciones fisiopatológicas, mediante la inhibición del estrés oxidativo. El mecanismo que subyace a esta acción varía dependiendo de la célula, pues en células mesangiales, la AM suprime la producción de EROs a través de la vía de la adenosina monofosfato cíclico (AMPc)/proteína quinasa A (PKA), mientras que en el ventrículo de la rata, la AM inhibe la NAD(P)H oxidasa a través de la vía del óxido nítrico (NO)/guanosina monosfato cíclico (GMPc). Por otra parte, se ha descrito que la AM inhibe la estimulación de la NAD(P)H oxidasa inducida por angiotensina II (ANG II) en células de músculo liso.17 Efectivamente, la AM ha demostrado tener un papel protector ante el estrés oxidativo, actuando como antioxidante in vivo. In vitro, la AM posee un papel protector como antioxidante en el daño vascular inducido por ANG II, a través de la inhibición de la generación intracelular de EROs inducida por ANG II en células de músculo liso vascular, y mediado por el receptor de AM a través de la vía AMPc/PKA. De igual manera, la AM es capaz de inhibir la expresión de diversos genes sensibles al estado redox, como la proteína-1 quimiotáctica de monocitos (MCP-1) y la NAD(P)H oxidasa, los cuales son inducidos por la ANG II; sugiriendo que la AM es un poderoso antioxidante que juega un papel vasculo-protector en el daño vascular inducido por la ANG II.18 Durante la hipertensión la administración de AM ejerce efectos favorables, ya que su administración subcutánea produce un efecto antioxidante en ratas sensibles a sal (Dahl), pues suprime la producción de anión superóxido e incrementa la síntesis y la biodisponibilidad del NO, mejorando así la función endotelial;19 asimismo, reduce la producción de EROs mediadas por la estimulación de la NAD(P)H oxidasa.20
Hasta el presente, no se ha esclarecido el posible papel de la adrenomedulina cerebelosa como antioxidante, y si dicha actividad se encuentra alterada durante la hipertensión. Si esto fuese así, sería plausible esperar que el tratamiento con un agente antihipertensivo prevenga o revierta dicha desregulación. Por ello, en el presente estudio evaluamos el efecto de la AM cerebelar sobre la producción de TBARS y la actividad de las enzimas antioxidantes en el vermis del cerebelo de ratas Wistar Kioto (WKY) y espontáneamente hipertensas (SHR) de 16 semanas de edad; así como el efecto de la reducción de la presión arterial sobre la posible alteración de la capacidad antioxidante de la AM cerebelosa mediante el uso de un arma farmacológica como lo es la amlodipina, un bloqueante de los canales de calcio.
2.1. Animales de experimentación
Se emplearon ratas macho WKY y SHR de 16 semanas de edad, provenientes del Instituto Venezolano de Investigaciones Científicas (IVIC) (Caracas–Venezuela). Los animales fueron mantenidos en jaulas a temperatura ambiente con ciclos de 12 horas luz/oscuridad. La dieta de los animales consistió en Ratarina® y agua ad libitum. Los experimentos fueron realizados siguiendo las buenas prácticas para el manejo de animales de laboratorio21 y la aprobación del Comité del Bioterio de la Facultad de Farmacia de la Universidad Central de Venezuela (UCV).
Los animales fueron aleatoriamente tratados con amlodipina (5mg/Kg/día, p.o.) o vehículo, durante 11 días. La presión arterial se determinó antes y al final del tratamiento mediante pletismografía no invasiva. Se registró diariamente la presión arterial sistólica (PS) y diastólica (PD) y la frecuencia cardíaca mediante el uso del pletismógrafo digital de cola (Digital Pressure Meter Le 5002 LETICA®, Panlab, S.L. Barcelona-España). Con el fin de minimizar el estrés, las ratas fueron entrenadas diariamente con el pletismógrafo durante la semana previa al experimento. La presión arterial media (PAM) fue calculada mediante la fórmula: PAM=PD+1/3(PS-PD). Después de los 11 días de tratamiento, los animales se sacrificaron por decapitación, los cerebros fueron extraídos y el vermis del cerebelo se disecó mediante microdisección bajo control estereomicroscópico y fueron mantenidos en Buffer Krebs-Ringer (KBR) burbujeado con 95% O2 y 5% CO2. Posteriormente, la muestra fue incubada a 37ºC en presencia o ausencia de AM 2X10-7 M durante 5 min. para el ensayo de la actividad de las enzimas antioxidantes y durante 10 min para el ensayo de producción de TBARS. El vermis cerebeloso fue homogenizado mediante sonicación en buffer fosfato 10 mM pH 7,0 y tritón al 1%, centrifugado a 10.000 rpm durante 30 min. y el sobrenadante recolectado fue utilizado como muestra.
2.2. Preparación y análisis histológico del corazón
Después de los 11 días de tratamiento, los animales fueron sacrificados por decapitación. El corazón fue extraído luego de la toracotomía y se lavó con tampón de perfusión (10mM Tris-HCl, sacarosa 250mM, pH 7,0 a 47°C). El corazón fue pesado, disecando el tercio superior del ventrículo izquierdo para el análisis histológico. Las muestras de tejido extraídas, fueron fijadas en formaldehído al 10% en PBS durante 24 horas, embebidas en parafina y procesadas según la técnica de rutina22 y posteriormente teñidas con hematoxilina-eosina (H-E), para luego ser observados por microscopía óptica. Las secciones fueron examinadas bajo microscopía de luz y analizados cuantitativamente usando un microscopio Zeiss Axiostar plus (Zeiss, Göttingen, Alemania) empleando el software AxionVision release 4.7.1. Se observaron los cortes transversales de los ventrículos, y se determinó el diámetro de los miocitos, considerando la medida de diez células seleccionadas de manera aleatoria para cada muestra.23
2.3. Determinación de la concentración de sustancias que reaccionan con el ácido tiobarbitúrico (TBARS)
La concentración de TBARS fue evaluada por un método colorimétrico.24 Para ello, muestras de homogeneizado de vermis de cerebelo fueron tratadas con ácido tricloroacético al 10% y centrifugadas a 1.600 g durante 15 min a 4ºC. Seguidamente, el sobrenadante fue incubado con ácido tiobarbitúrico 0,67% durante 10 min. a 100ºC. Paralelamente se construyó una curva patrón con malonildialdehído. Se determinó la densidad óptica a 532 nm y la concentración de los productos de peroxidación lipídica fueron calculados y expresados como malonildialdehído formado. Los resultados de los TBARS fueron expresados como nmol/mg de proteínas del tejido.
2.4. Ensayo de la actividad de la catalasa (CAT)
La actividad de la CAT fue determinada empleando una modificación del método de Aebi.25 Para ello, se añadió 25 μL del homogenizado del cerebelo a 725 μL de la mezcla de incubación (10 mM H2O2 en buffer fosfato 10 mM a pH 7), y se monitoreó el cambio de absorbancia a 240 nm a los 0, 60, 120 y 180 segundos, utilizando la constante de reacción de primer orden (k) como la unidad de actividad de la CAT (k = (1/t) (2,3 x log A1/A2), donde t es el intervalo de tiempo medido (seg), A1 y A2 son las absorbancias del H2O2 en los tiempos t1 y t2. Los resultados fueron expresados en actividad específica.
2.5. Ensayo de la actividad de la superóxido dismutasa (SOD)
La actividad de la SOD se determinó por la capacidad de esta enzima de inhibir la reducción del azul de nitrotetrazolio (NBT) a formazán a 595 nm, por los aniones superóxido generados por el sistema de la xantina-xantina oxidasa.26 Para ello, se mezcló 166 μL de la mezcla de incubación (xantina 0,3 mM, EDTA 0,6 mM, NBT 150mM, albúmina 0,1% y NaHCO3 400 mM) con 33 μL del homogeneizado del vermis del cerebelo. La reacción se inició con la adición de 10 μL de la enzima xantina oxidasa. Los tubos se incubaron durante 30 minutos, seguidos de la adición de 66 μL CuCl2 2H2O 0,8 mM que detuvo la reacción y se midió la absorbancia a 595 nm. Los resultados se expresaron como actividad específica. Una unidad de SOD se definió como la cantidad de SOD necesaria para inhibir en un 50% la formación de los cristales de formazán.
2.6. Ensayo de la actividad de la glutatión peroxidasa (GPx)
La actividad de la GPx de las muestras fue determinada de forma indirecta,27 mediante una reacción acoplada con la glutatión reductasa (GSH-Rx). El método se basa en determinar la disminución de la absorbancia a 340 nm debido a la desaparición de NAD(P)H. Los resultados fueron expresados como actividad específica de la enzima en U/mg de proteína, donde 1 U=µmol de NAD(P)H oxidado/min.
2.7. Determinación de las proteínas tisulares
Las proteínas tisulares totales fueron determinadas utilizando albúmina sérica de bovino como patrón.28
2.8. Análisis estadístico
Los resultados fueron expresados como la media ± E.E.M. Se utilizó el análisis de Kruskall–Wallis con análisis post hoc mediante la prueba de U de Mann-Whitney sobre cada par de grupos y el análisis de U de Mann-Whitney para comparar los valores de las variables sujetas a estudio. Un valor de p<0,05 fue considerado significativo. El análisis de los resultados y la elaboración de los gráficos se realizaron empleando el programa Graph Pad Prism versión 5.1.
3.1. Efecto de la administración in vivo de amlodipina sobre la PAM
Se determinaron los valores de PAM en las ratas WKY y SHR adultas y se evaluó el efecto de la administración in vivo de amlodipina sobre dicho parámetro; evidenciándose que las ratas SHR presentaron valores significativamente superiores de PAM cuando se compararon con las WKY (N=9, p<0,05). Por su parte, la administración in vivo de amlodipina (5mg/Kg/día, p.o.) durante 11 días redujo la PAM en las ratas SHR y no alteró la presión en las WKY normotensas (Figura 1).
3.2. Relación peso corazón/peso corporal: Efecto de la amlodipina
Se evaluaron los valores de peso corporal, peso del corazón y su relación en las ratas WKY y SHR adultas como marcador del efecto del incremento de la presión arterial sobre el corazón. Se estudió el efecto de la reducción de la presión arterial mediante la administración de amlodipina sobre estos parámetros cardíacos. En la tabla I se muestra que las ratas SHR presentaron valores significativamente superiores de peso del corazón y relación peso del corazón/peso corporal cuando se comparó con la WKY (N=9, p<0,05).
Asimismo, la administración in vivo de amlodipina (5mg/Kg/día, p.o.) durante 11 días revirtió el incremento de dichos parámetros en las ratas SHR.
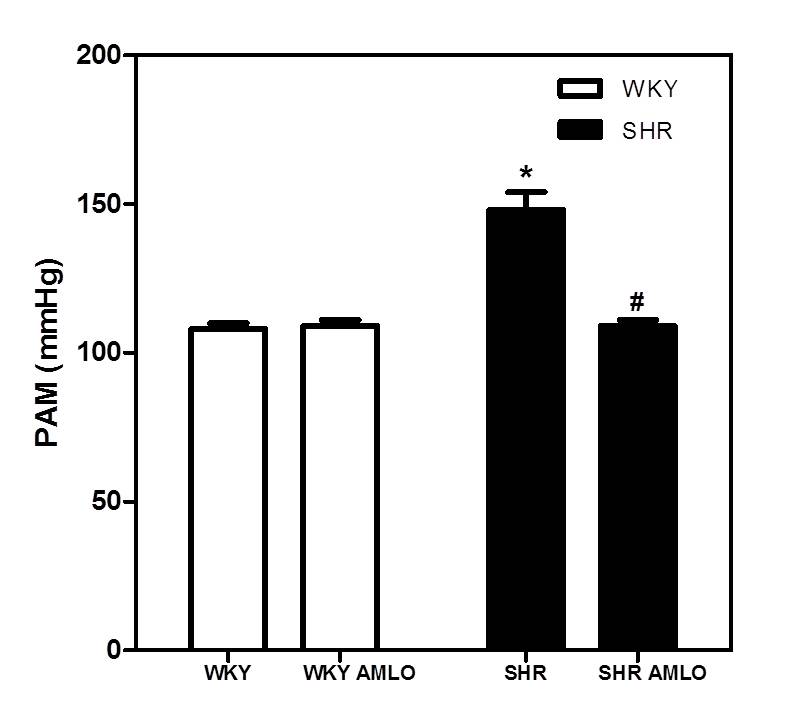
Figura 1. Efecto del tratamiento con amlodipina (AMLO) in vivo, sobre la PAM en ratas WKY y SHR. Ratas WKY y SHR de 16 semanas de edad fueron tratadas durante 11 días con AMLO (5 mg/Kg/día, p.o.), se determinó su PAM. Los resultados fueron expresados como la media ± E.E.M. de la PAM (N=8). *p<0,0001 vs. WKY. #p<0,0001 vs. SHR.
Tabla I. Efecto del tratamiento con amlodipina (AMLO) in vivo, sobre la relación peso corazón/peso corporal en ratas WKY y SHR
GRUPO |
Peso Corporal (Kg) |
Peso Corazón (g) |
Peso Corazón/Peso Corporal |
WKY |
0,374 ± 0,007 |
1,335 ± 0,006 |
3,590 ± 0,09 |
WKY AMLO |
0,384 ± 0,003 |
1,350 ± 0,013 |
3,525 ± 0,062 |
SHR |
0,383 ± 0,004 |
1,833 ± 0,028* |
4,812 ± 0,091* |
SHR AMLO |
0,369 ± 0,082 |
1,357 ± 0,014# |
3,696 ± 0,081# |
Ratas WKY y SHR de 16 semanas de edad fueron tratadas durante 11 días con AMLO (5mg/Kg/día). Se determinó su peso corporal (Kg) y del peso del corazón (g). Los resultados fueron expresados como la media ± error estándar. (N= 8). *p<0,05 vs. WKY. #p<0,05 vs. SHR.
3.3. Determinación del diámetro de los miocitos cardíacos del ventrículo izquierdo: Efecto de la administración in vivo de amlodipina
Se evaluó el diámetro de los miocitos cardíacos del ventrículo izquierdo en ratas SHR y WKY como marcador del efecto del incremento de la presión arterial sobre el corazón y se determinó el efecto que ejerce la reducción de la presión arterial mediante la administración oral in vivo de amlodipina sobre este parámetro cardíaco. En la figura 2 se muestra que las ratas SHR poseen valores significativamente superiores en el diámetro de los miocitos cuando se compararon con los WKY (N=6, p<0,05). Por su parte, la administración in vivo de amlodipina (5mg/Kg/día, p.o.) durante 11 días revirtió el incremento de dicho parámetro en las ratas SHR
3.4. Efecto de la AM sobre la producción de TBARS en el vermis del cerebeloso
Como se observa en la figura 3, la incubación del vermis cerebeloso con AM (2X10-7 M) durante 10 min, disminuyó significativamente la producción de TBARS (4,20 ± 0,55 vs. 2,83 ± 0,15; basal vs. AM) en ratas WKY (p<0,05; N=6). Por el contrario, en las ratas SHR la AM no alteró la producción de TBARS (9,49 ± 0,82 vs. 9,11 ± 1,46; basal vs. AM). Igualmente se observó que los niveles basales de TBARS en ratas SHR fueron 2,5 veces más elevados que los encontrados en las ratas WKY (p<0,05; N=6).
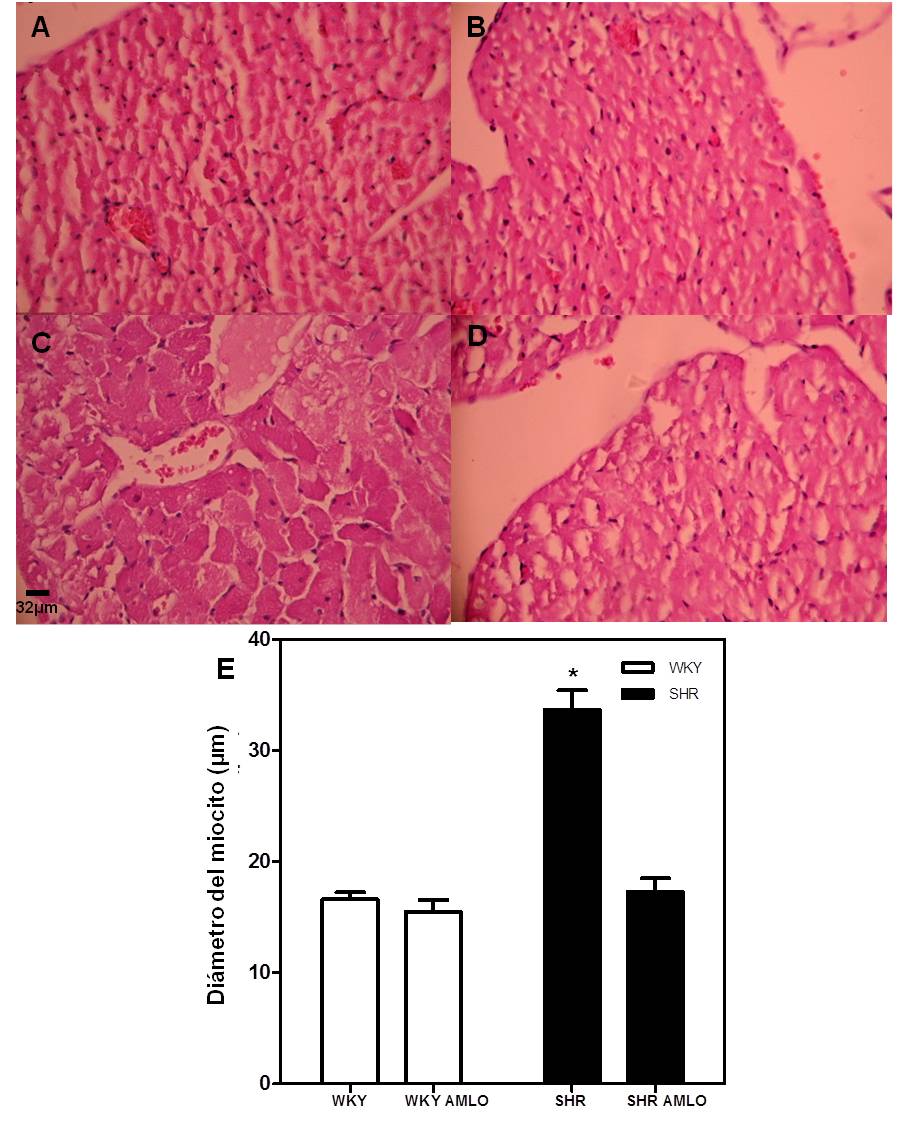
Figura 2. Efecto del tratamiento oral con amlodipina (AMLO) sobre el diámetro de miocitos de ventrículo izquierdo de ratas WKY, WKY AMLO, SHR y SHR AMLO. Cortes histológicos de ventrículo izquierdo de ratas tratadas con amlodipina (AMLO) in vivo. Ventrículo izquierdo de ratas WKY (Panel A), WKY AMLO (Panel B), SHR (Panel C) y SHR AMLO (Panel D). Hematoxilina–Eosina (H-E), 40X. Barra = 32μm. Diámetro de los miocitos del ventrículo de las ratas (Panel E) *p<0,001 vs. WKY (N= 6)
Figura 3. Efecto de la AM sobre la producción de TBARS en el vermis del cerebelo de ratas WKY y SHR tratadas durante 11 días con AMLO (5mg/Kg/día). El vermis cerebelar fue incubado con AM 2X10-7 M durante 10 min. Los resultados fueron expresados como la media ± E.E.M. de la producción de TBARS (nmol/mg proteína). *p<0.05 vs. control (N = 6). #p<0.05 Basal WKY. 3.5. Acción de la AM sobre la actividad de las enzimas antioxidantes in vitro, en el vermis cerebeloso: Efecto de la administración in vivo de amlodipina Se evaluó el efecto de la AM sobre la actividad de las enzimas antioxidantes in vitro, en el vermis cerebeloso de ratas SHR y WKY adultas, así como el efecto de la reducción de la presión arterial con la amlodipina, sobre la desregulación de la actividad antioxidante de la AM en el cerebelo de las ratas SHR. Como se observa en la figura 4, la incubación in vitro del vermis cerebeloso con AM (2x10-7M) durante 5 min, redujo significativamente la actividad basal de las enzimas CAT, SOD y GPx en ratas WKY, pero no la alteró en las SHR. La administración in vivo de amlodipina (5 mg/Kg/día, p.o.) durante 11 días, revirtió la pérdida de la capacidad antioxidante de la AM cerebelosa en las ratas SHR. Efectivamente, la incubación con AM (2X10-7 M) en el vermis cerebeloso de ratas SHR tratadas con amlodipina, disminuyó significativa la actividad basal de las enzimas antioxidantes a valores similares a los obtenidos en las ratas WKY (p<0,001). La amlodipina no afectó la actividad de las enzimas antioxidantes, basal o la inducida por la AM en las ratas WKY.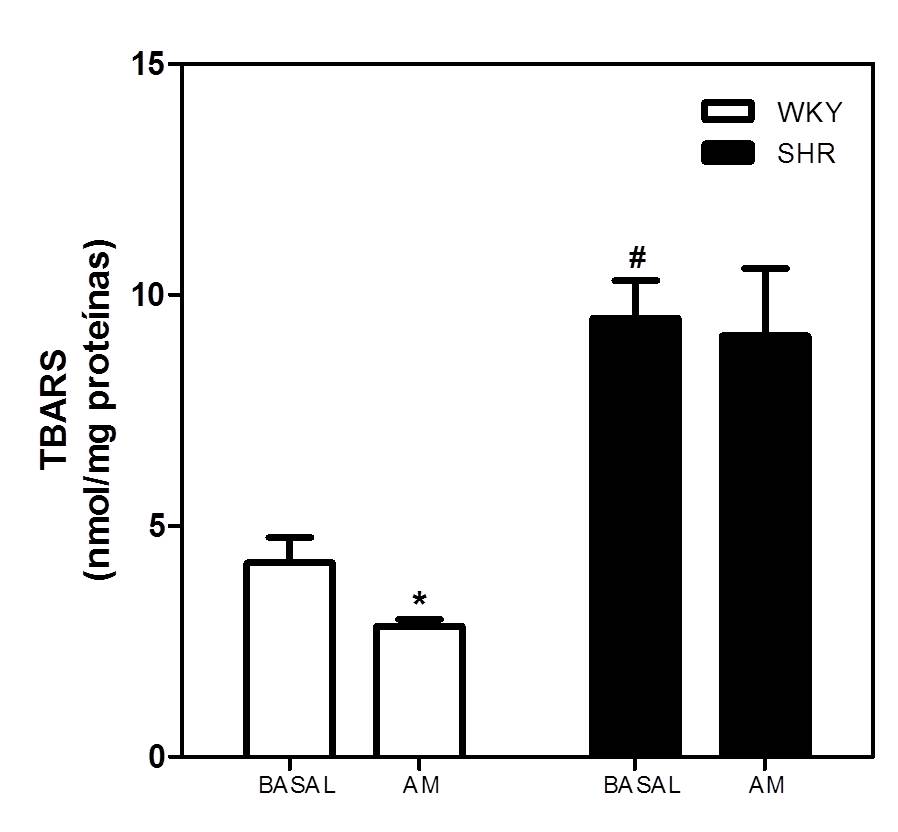
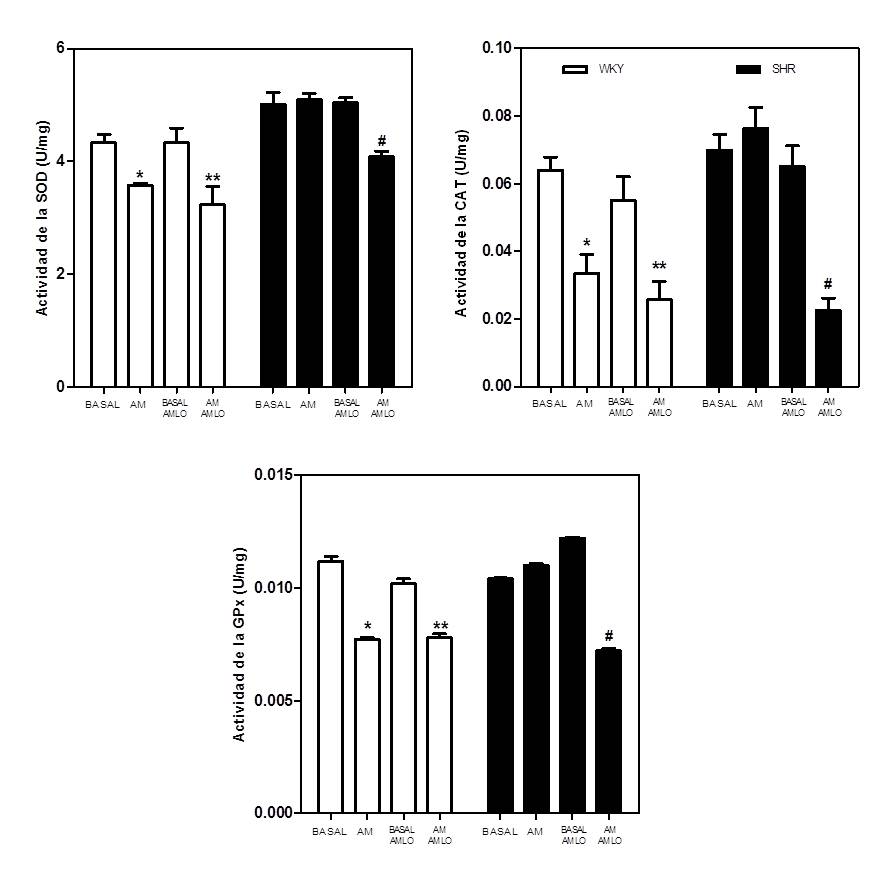
Figura 4. Efecto del tratamiento con amlodipina (AMLO) in vivo, sobre la actividad de las enzimas antioxidantes, SOD, CAT y GPx basal e inducida por la AM en el vermis de cerebelo de ratas WKY y SHR. Ratas WKY y SHR de 16 semanas de edad fueron tratadas durante 11 días con AMLO (5mg/Kg/día), posteriormente, se sacrificaron y el vermis cerebelar fue incubado con AM 2X10-7 M durante 5 min. Los resultados fueron expresados como la media ± E.E.M. de la actividad específica de las enzimas. (N=8). *p<0,0001 vs. Basal WKY. **p<0,0001 vs. Basal AMLO-WKY). #p<0,0001 vs. Basal AMLO-SHR.
Los mecanismos fisiológicos involucrados en las acciones de la AM en el cerebelo aún no han sido esclarecidos y podrían ser múltiples y complejos. Más aún, hay poca información acerca del papel del cerebelo en la regulación cardiovascular. Sin embargo, la evidencia neuroanatómica sugiere que el cerebelo cumple un papel muy importante en la regulación cardiovascular. En efecto, en el cerebelo se han identificado diversos módulos cardiovasculares, como el núcleo fastigio (NF), vermis anterior, vermis posterior, úvula (lóbulo IX), nódulo (lóbulo X); pues la estimulación de estas estructuras conlleva cambios en la presión arterial, frecuencia respiratoria y resistencia vascular. Estos hallazgos constituyen evidencias claras del papel del cerebelo, específicamente el vermis cerebelar en la regulación de la presión arterial.29
Aunque la distribución de los sitios de unión de la AM en el sistema nervioso central ha sido bien documentada, su presencia en el cerebelo así como los mecanismos de señales de transducción de los receptores de este péptido en el mismo no han sido completamente clarificados y se conoce poco los segundos mensajeros intracelulares relacionados con sus acciones biológicas. Al respecto, la AM ha demostrado tener efecto sobre la producción de radicales libres, pues es capaz de disminuir la producción de especies reactivas de oxígeno (EROs) mediada por NAD(P)H oxidasa, a través de la inhibición de la actividad de la enzima.16
Se ha propuesto que las EROs están involucradas en el desarrollo de la hipertensión, pues se ha demostrado un aumento en su producción en diversos modelos animales con hipertensión.30 De hecho, el estrés vascular oxidativo ha sido asociado con un gran número de modelos animales de hipertensión tales como las ratas SHR y las ratas hipertensas Dahl sensibles a sal.31 Y el tratamiento con tempol, un mimético de la SOD, fue capaz de disminuir la presión arterial y la producción de EROs en las ratas SHR.32 Asimismo, se ha demostrado un incremento en la expresión de los componentes de la NAD(P)H oxidasa en aorta de ratas SHR, y se ha asociado la disfunción endotelial con un incremento en la producción de EROs en lugar de una disminución en la producción de NO.
33 Es importante considerar que durante la hipertensión, diferentes estudios han indicado que la AM protege del daño cardiovascular mediante la disminución en la producción de EROs mediada por la NAD(P)H oxidasa.16,18,20,34 De hecho, se ha demostrado que la infusión de AM disminuyó los niveles de TBARS y atenuó la producción de EROs mediada por NAD(P)H oxidasa en ratas hipertensas, mediante la diminución de su actividad y la expresión de p22phox y gp91phox, componentes de la NAD(P)H oxidasa.16,19 De igual manera, la AM también ha demostrado ser un poderoso antioxidante a nivel central, ya que este péptido se puede comportar como un regulador negativo para compensar la sobreproducción de EROs,35 por lo tanto, está claro que la AM es capaz de reducir la producción de radicales libres y EROS mediada por la NAD(P)H oxidasa, a través de la inhibición de la actividad de la enzima.16En relación al sistema nervioso central (SNC), específicamente en el cerebelo, nuestros resultados sugieren un incremento en la producción de EROs basal durante la hipertensión, ya que demuestran un incremento en la producción de marcadores de peroxidación lipídica en el vermis cerebelar de las ratas hipertensas con respecto a los controles normotensas, lo cual apoya el concepto de un incremento del estrés oxidativo durante la hipertensión, no sólo en estructuras periféricas sino específicamente en el cerebelo de la rata.
Se ha sugerido que la AM puede jugar un papel protector contra el estrés oxidativo como un antioxidante endógeno in vivo.20 Así, en ratones heterocigotos para la AM, se ha demostrado la presencia de inflamación perivascular en arterias coronarias y un incremento del estrés oxidativo sistémico y local, el cual es revertido con la suplementación de AM.20 El papel de la AM en el cerebelo sobre la regulación del estrés oxidativo a través de la modulación de la actividad de las enzimas antioxidantes ha sido poco estudiado. Nuestros resultados apoyan la afirmación que la AM constituye una sustancia antioxidante, ya que demostramos que la AM disminuye la actividad de las enzimas antioxidantes, SOD, CAT y GPx en el vermis cerebeloso de ratas WKY en forma similar a la descrita por otros investigadores en órganos como los riñones y el hígado.36,37 Esta disminución de la actividad enzimática sugiere que AM es capaz de reducir la producción de EROs, junto con el hecho que la disminución de la actividad de las enzimas antioxidantes fue acompañada por una disminución en la producción de la peroxidación de lípidos. Efectivamente, se ha demostrado que la AM tiene propiedades antioxidantes, ya que la AM reduce la sobreproducción de EROs38-40 y estos efectos pueden proteger diferentes órganos de los factores estresantes dañinos,41 lo que sugiere que la AM media la acción protectora contra la respuesta vascular frente a la injuria, posiblemente a través de la inhibición de la producción del estrés oxidativo.34
Ahora bien, el efecto antioxidante basal de la AM en el cerebelo podría estar alterado durante la hipertensión. Nuestros hallazgos apoyan esta posibilidad, ya que en las ratas hipertensas SHR, las cuales presentan un incremento del tamaño del corazón y del diámetro de los miocitos determinados como marcadores cardíacos de la hipertensión, la AM no fue capaz de reducir la actividad basal de las enzimas antioxidantes, SOD, CAT y GPx, ni de disminuir la peroxidación lipídica cerebelosa. Por lo tanto, en la hipertensión, parece ocurrir una desregulación de la capacidad antioxidante basal de la AM reflejada sobre el control y la regulación de la actividad de las enzimas antioxidantes.
La ausencia de respuesta a la AM sobre la actividad de las enzimas antioxidantes basal en el vermis cerebelar de las ratas SHR puede explicarse debido al cambio en el patrón de expresión de los componentes de los receptores de AM observados en el vermis cerebelar durante la hipertensión, pues como hemos demostrado,14,15 durante la hipertensión existe un incremento en la expresión del receptor del péptido relacionado al gen de la calcitonina (CGRP) (CRLR+RAMP1) y AM2 (CRLR+RAMP3) y una reducción de la expresión del receptor AM1 (CRLR+RAMP2), lo cual sugiere que los cambios en el patrón de expresión de la AM y los componentes de sus receptores asociados a la hipertensión se traducen en la pérdida de la respuesta antioxidante de la AM en el vermis cerebelar de estas ratas. De igual manera, en un estudio previo demostramos una alteración de la señalización de la vía de GMPc/NO42 y quinasa reguladas por señales extracelulares (ERK1/2)43 inducida por la AM en el vermis cerebeloso de ratas hipertensas, ratificando la hipótesis de la desregulación del sistema adrenomedulinérgico cerebeloso durante la hipertensión.
Es posible que el manejo farmacológico periférico de la presión arterial podría restituir la respuesta antioxidante de la AM. Efectivamente, nuestros resultados apuntan a esa posibilidad ya que demuestran que el tratamiento con amlodipina redujo la presión arterial en ratas hipertensas, revirtió la hipertrofia ventricular izquierda que se manifiesta por la reducción en el tamaño del corazón y del diámetro de los miocitos y restauró la capacidad antioxidante de la AM en el vermis cerebeloso. La restauración de la respuesta antioxidante de la AM en el cerebelo de ratas hipertensas tras el tratamiento con un agente hipotensor como la amlodipina, podría ser debido a una restitución en la expresión de la AM y los componentes de sus receptores. Por lo tanto, el tratamiento con un antihipertensivo como la amlodipina, no sólo redujo la presión arterial sino que fue capaz de restablecer la respuesta antioxidante de la AM posiblemente mediada a través de la expresión óptima del receptor AM2 en el cerebelo, el cual es necesario para la adecuada señalización de la AM.14,15
En conclusión, nuestro estudio apoya la existencia de una desregulación del sistema adrenomedulinérgico cerebeloso durante la hipertensión y demuestra que la reducción de la presión arterial periférica después de la administración oral de amlodipina fue capaz de revertir la pérdida de la actividad antioxidante de la AM en el vermis cerebeloso de ratas hipertensas; lo cual indica que estas alteraciones representan la anormalidad primaria que conduce a la hipertensión. Por lo tanto, la reversión con la administración periférica de un antihipertensivo, podría representar una estrategia para compensar la alteración primaria en el control de la presión arterial y abre la posibilidad de un nuevo mecanismo en la terapia antihipertensiva.
Los autores agradecen al Sr. Banny Caraballo por su ayuda técnica en los experimentos. Este trabajo fue subvencionado por el Ministerio Popular de Ciencia Tecnología e Industrias, Proyecto Misión Ciencia, Sub-proyecto 7, ECCV No. 2007001585.
6. Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
- Cases A, Mora-Macía J. Adrenomedulina: un Nuevo péptido vasoactivo. Nefrología 2001 XXI (1); 16-25.
- Beltowski J, Jamroz A. Adrenomedullin–What do we know 10 years since its discovery? Pol J Pharmacol 2004 56: 5- 27.
- Zimmermann U, Fischer J, Frei K, Fischer A, Reinscheid R, Muff R. Identification of adrenomedullin receptors in cultured rat astrocytes and in neuroblastoma x glioma hybrid cell (NG 108-15). Brain Res 1996 724: 238-5.
- Belloni A, Andreis P, Meneghelli V, Champion H, Kadowitz P, Coy D, et al. Adrenomedullin and calcitonin gene-related peptide (CGRP) interact with a common receptor of the CGRP1 subtype in the human adrenal zona glomerulosa. Endocr Res 1999 25: 29-34.
- Eguchi S, Hirata Y, Kano H, Sato K, Watanabe Y, Watanabe T, et al. Specific receptors for adrenomedullin in cultured rat vascular smooth muscle cells. FEBS Letters 1994 340: 226-30.
- Sakata J, Shimokubo T, Kitamura K, Nishizono M, Iehiki Y, Kangawa K, et al. Distribution and characterization of immunoreactive rat adrenomedullin in tissue and plasma. FEBS Letters 1994 352: 105-8.
- Serrano J, Alonso D, Fernández A, Encinas J, López J, Castro–Blanco S, et al. Adrenomedullin in the central nervous system. Microsc Res Tech 2002 57 (2): 76-9.
- Serrano J, Encinas J, Fernández A, Castro S, Alonso D, Fernández P, et al. Distribution of immunoreactivity for the adrenomedullin binding protein, complement factor H, in the rat brain. Neuroscience 2003 116: 947-62.
- Juaneda C, Dumont Y, Chabot J, Fournier A, Quirion R. Adrenomedullin receptor binding sites in rat brain and peripheral tissues. Eur J Pharmacol 2003 474: 165-74.
- Sone M, Takahashi K, Satoh F, Murakami O, Totsune K, Ohneda M, et al. Specific adrenomedullin binding sites in the human brain. Peptides 1997 18 (8): 1125-9.
- Ueda T, Ugawa S, Saishin Y, Shimada S. Expression of receptor–activity modifying protein (RAMP) mRNAs in the mouse brain. Mol Brain Res 2001 93: 36-45.
- Chakravarty P, Suthar T, Coppock H, Nicholl C, Bloom S, Legon S, et al. CGRP and adrenomedullin binding correlates with transcript levels for calcitonin receptor–like receptor (CRLR) and receptor activity modifying proteins (RAMPs) in rat tissues. Br J Pharmacol 2000 130: 189-95.
- Uezono Y, Nakamura E, Ueda Y, Shibuya I, Ueta Y, Yokoo H, et al. Production of cAMP by adrenomedullin in human oligodendroglial cell line KG1C: Comparison with calcitonin gene–related peptide and amylin. Brain Res Mol Brain Res 2001 97: 59-69.
- Figueira F, Israel A. Role of cerebellar adrenomedullin in blood pressure regulation. Neuropeptides 2015 54: 59-66.
- Figueira L, Israel A. Cerebellar adrenomedullin: New target for blood pressure regulation. The Targets Neurol Diseases 2015 2: e1039.
- Rahman D, Nishiyama A, Guo P, Nagai Y, Xing G, Fujisawa Y, et al. Effects of adrenomedullin on cardiac oxidative stress and collagen accumulation in aldostrone–dependent malignan ypertenive rats. J Phamacol Exp Ther 2006 318: 1323-9.
- Liu J, Shimosawa T, Matsui H, Meng F, Supowit S, DiPette D, et al. Adrenomedullin inhibits angiotensin II- induced oxidative stress via Csk- mediated inhibition of Src activity. Am J Physiol Heart Circ Physiol 2007 292: H1714–21.
- Yoshimoto T, Gochou N, Fukai N, Sugiyama T, Shichiri M, Hirata Y. Adrenomedullin inhibits angiotensin II-induced oxidative stress and gene expression in rat endothelial cells. Hypertens Res2005 28 (2): 165-72.
- Cao Y, Kuwasako K, Kato J, Yanagita T, Tsuruda T, Kawano J, et al. Beyond vasodilation: The antioxidant effect of adrenomedullin in Dahl salt–sensitive rat aorta. Biochem Biophys Res Commun 2005 332: 866-72.
- Shimosawa T, Shibagaki Y, Ishibashi K, Kitamura K, Kangawa K, Kato S, et al. Adrenomedullin, an Endogenous Peptide, Counteracts Cardiovascular Damage. Circulation 2002 105: 106-11.
- NIH Guide for the care and use of animals. Institute of Laboratory Animal Resources. National Research Council. Nacional Academy Press, Washington DC, USA. 1996.
- Luna L. The Histological Staining Manual. Methods of the Armed Forces Institute of Pathology. 1968 Cap 1-4: 11-37. Editions McGraw-Hill. New York. USA.
- Xian J, Li X, Li-Shun W, Jun-Zhi S, Ying Z, Wen-Li C, et al. Differential protein expression in hypertrophic heart with and without hypertension in spontaneously hypertensive rats. Proteomics. 2006 6:1948–56.
- Ohkawa H, Ohishi N, Yagi K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction. Anal Biochem 1979 95: 351-8.
- Aebi H. Catalase in vitro. Methods Enzymol 1984 105: 121-6.
- Oberley L, Spitz D. Assay of superoxide dismutase activity in tumor tissue. Meth Enzymol 1984 105: 457-64.
- Flohé L, Gunzler W. Assays of glutathione peroxidase. Meth Enzymol 1984 77: 398–404.
- Lowry O, Rosebrough N, Farr A, Randall R. Protein measurement with the Folin phenol reagent. J Biol Chem 1951 193: 265-75.
- Nisimaru N. Cardiovascular modules in the cerebelum. Jpn J Physiol 2004 54: 431-448.
- Somers MJ, Mavromatis K, Galis ZS, Harrison DG. Vascular superoxide production and vasomotor function in hypertension induced by deoxycorticosterone acetate-salt. Circulation 2000 101: 1722-8.
- Schnackenberg CG. Physiological and pathophysiological roles of oxygen radicals in the renal microvasculature. Am J Physiol Regul Integr Comp Physiol 2002 282: R335-42.
- Schnackenberg CG, Wilcox CS. Two-week administration of tempol attenuates both hypertension and renal excretion of 8-Iso prostaglandin F2. Hypertension 1999 33: 424-8.
- Zalba G, Beaumont F, San José G, Fortuño A, Fortuño MA, Etayo JC, et al. Vascular NADH/NADPH oxidase is involved in enhanced superoxide production in spontaneously hypertensive rats. Hypertension 2000 35: 1055-61.
- Kawai J, Ando K, Tojo A, Shimosawa T, Takahashi K, Onozato M, et al. Endogenous adrenomedullin protects against vascular response to injury in mice. Circulation 2004 109: 1147-53.
- Fujita M, Kuwaki T, Ando K, Fujita T. Sympatho–inhibitory action of endogenous adrenomedullin through inhibition of oxidative stress in the brain. Hypertension 2005 45: 1165-72.
- Yurekli M, Esrefoglu M, Dogru M, Dogru A, Gul M, Whidden M. Adrenomedullin reduces antioxidant defense system and enhances kidney tissue damage in cadmium and lead exposed rats. Environ Toxicol 2009 24: 279-86.
- Cikcikoglu N, Yurekli M, Yildirim N. Investigation of some antioxidant enzymes activities depending on adrenomedullin treatment and cold stress in rat liver tissue. Turk J Biochem 2010 35 (2): 140-4.
- Ando K, Ito Y, Kumada M, Fujita T. Oxidative stress increases adrenomedullin mRNA levels in cultured rat vascular smooth muscle cells. Hypertens Res 1998 21: 187-91.
- Ando K, Shimosawa T, Fujita T. Adrenomedullin in vascular disease. Curr Hypertens Rep 2004 6 (1): 55-9.
- Chun TH, Itoh H, Saito T, Yamahara K, Doi K, Mori Y, et al. Oxidative stress augments secretion of endothelium-derived relaxing peptides, C-type natriuretic peptide and adrenomedullin. J Hypertens 2000 18: 575-80.
- Dogru M, Kocagun D, Gul M, Esrefoglu M, Yurekli M, Erdogan S, et al. The effect of adrenomedullin on rats exposed to lead. J Appl Toxic 2007 28 (2): 140-6.
- Figueira L, Israel A. Efecto de la adrenomedulina sobre la producción de GMPc/óxido nítrico en el vermis de cerebelo durante la hipertensión. Rev Fac Farm 2015 78 (1-2): 77-83.
- Figueira L, Israel A. Efecto de la adrenomedulina cerebelosa sobre las quinasas reguladas por señales extracelulares en la hipertensión. Rev Fac Farm 2014 77 (1-2): 46-53.
| Recibido: 02 de enero de 2016 | Aceptado: 14 de febrero de 2016 |
Correspondencia: Anita Israel. Facultad de Farmacia; Laboratorio de Neuropéptidos. Universidad Central de Venezuela. Santa Rosa de Lima, Las Mesetas, Calle La Cima, Res. Mara, No. 82. Caracas, Venezuela. Teléfono: +58 212 6052689. E-mail: astern88@gmail.com
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
