Post-accidente vascular cerebral: Hacia una terapia global
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Aranda-Abreu Gonzalo Emiliano*, Hernández-Aguilar María Elena, Rojas-Durán Fausto
Laboratorio de Neuroendocrinología, Centro de Investigaciones Cerebrales, Universidad Veracruzana
Resumen/Abstract
Introducción
Discusión
Agradecimientos
Referencias
Correspondencia
El accidente vascular cerebral es el padecimiento neurológico, más frecuente, que puede llevar a la incapacidad funcional de una persona. El tratamiento primario por lo general no va seguido de una terapia global para inhibir el proceso neuroinflamatorio. Es indispensable que se inhiba el proceso neuroinflamatorio para que la persona pueda si es posible continuar con su vida normal. Inhibir la expresión de la ciclooxigenasa 2 (COX-2) permitirá que el paciente se recupere debidamente. Nosotros proponemos una terapia global a base de medicamentos como la nimesulida y el citalopram y complementos como los ácidos omega-3 y el resveratrol, que hará que el paciente se recupere de manera satisfactoria. Presentamos un caso severo de una persona que sufrió primero un derrame cerebral y después un trauma craneal y que accedió a seguir esta terapia.
Palabras clave: Ciclooxigenasa-2, Neuroinflamación, Terapia, Ictus, Derrame cerebral, Complemento alimenticio, Medicamentos.
The stroke is most common neurological condition, which can lead to functional disability of a person. Primary treatment usually is not followed by a comprehensive therapy to inhibit the neuroinflammatory process. It is essential that the neuroinflammatory process is inhibited so that the person can if you can continue with your normal life. Inhibiting the expression of cyclooxygenase 2 (COX-2) allows the patient to recover properly. We propose a comprehensive therapy with drugs such as nimesulide and citalopram and supplements such as omega-3 fatty acids and resveratrol, which will make the patient, recovers satisfactorily.
We present a severe case of a person who suffered a stroke first and then head trauma and agreed to continue this therapy.
Key words: Cyclooxygenase-2, Neuroinflammation, Therapy, Cranial trauma, Stroke, Food supplements, Medicines.
El accidente vascular cerebral (AVC) es la enfermedad neurológica más frecuente, causando aproximadamente 5 millones de muertes al año alrededor del mundo. Su impacto es aún mayor debido a la alta tasa de incapacidad funcional que produce.1
El AVC es un cuadro neurológico agudo, debido a un proceso patológico de los vasos sanguíneos cerebrales. Esta patología vascular puede ser congénita o adquirida y los ictus pueden ser isquémicos o hemorrágicos.
Las causas del ictus isquémico son la oclusión trombótica de arterias o venas cerebrales, enfermedad embólica a partir de los vasos de gran calibre o del corazón, o bien la oclusión de la pequeñas ramas vasculares penetrantes.2
La causa de la hemorragia puede ser la ruptura de los vasos sanguíneos debido a hipertensión o aneurisma, traumatismo, lesión penetrante, lesión cerebral por fuerzas tangenciales o angulares, fragilidad de los vasos como consecuencia de un infarto.3,4
Siendo el ictus isquémico el más frecuente, aproximadamente del 85-90% de los casos mientras que el AVC hemorrágico constituye del 10-15%.5
La arteria cerebral media es la mayor de las ramas de la arteria carótida interna, suministrando irrigación sanguínea a una gran parte del lóbulo frontal y la superficie lateral de los lóbulos temporales y parietales, en los que se sitúan las áreas motoras primarias y sensitivas de la cara, faringe, manos y brazos y, en el hemisferio dominante, las áreas del lenguaje. En el ictus, la arteria cerebral media es una de las más frecuentemente afectadas.
En términos generales, las manifestaciones clínicas se manifiestan mediante un déficit focal de inicio agudo como debilidad, pérdida de la sensibilidad, ataxia, déficit del habla o pérdida visual. Aunque pueden existir otros síntomas y signos, estos son los más frecuentes.
Actualmente no existe tratamiento para después del evento vascular cerebral, se ha utilizado la inhibición del “mammalian target of rampamycin” (mTOR), como medida para modular la respuesta inmune generada por el AVC.6
Durante la última década, el tratamiento de elección para el ictus es la trombólisis con alteplasa, el cual ha resultado efectivo durante la fase aguda del padecimiento, sin embargo una gran cantidad de pacientes no son atendidos durante este periódo, por lo que resulta importante desarrollar un tratamiento que se pueda aplicar durante las fases posteriores al AVC, y la inducción de la neurogénesis es una propuesta que resulta interesante para el tratamiento durante la fase posterior al AVC, para mejorar la calidad de vida de los pacientes expuestos a este tipo de lesiones. Esto gracias a que la regeneración del cerebro se produce días o incluso semanas después del AVC, lo que proporciona un segundo periódo para su tratamiento.1,5,7
La terapia con células madre neurales se puede clasificar en dos estrategias: la primera es el trasplante de células exógenas en la zona de lesión cerebral para reemplazar a las células perdidas, la segunda es aumentar la proliferación, diferenciación y migración de células madre endógenas.5
Sin embargo después del tratamiento primario, que puede involucrar cirugía, no existe una terapia que se aplique post-AVC,6 lo que nos lleva a la neuroinflamación, neurodegeneración y depresión.8
La neuroinflamación (Figura 1) es un proceso central de la respuesta inmune a varias enfermedades agudas y crónicas.9 Dentro de las patologías se encuentran la enfermedad de Alzheimer,10 la obesidad,11 daño cerebral traumático,12 la enfermedad de Parkinson,13 la esclerosis lateral amiotrófica (ALS)14 el envejecimiento, que aunque no es una patología por si misma se ha demostrado que causa inflamación.15-17 La barrera hematoencefálica (BBB) está involucrada en el proceso de inflamación, ya que permite que moléculas como el factor de crecimiento tumoral (TNF) y citocinas ingresen al cerebro. El TNF-, la IL-6, IL-1β y otras citocinas son capaces de hacer más permeable la membrana de la BBB y permitir la entrada de leucocitos al cerebro.9,18 Las citocinas poseen la habilidad de activar la transcripción de diferentes genes en células de la BBB incluyendo miembros del factor nuclear kb (NF-kb) y ciclooxigenasa-2 (COX-2), enzima que participa en la formación de prostaglandinas.19
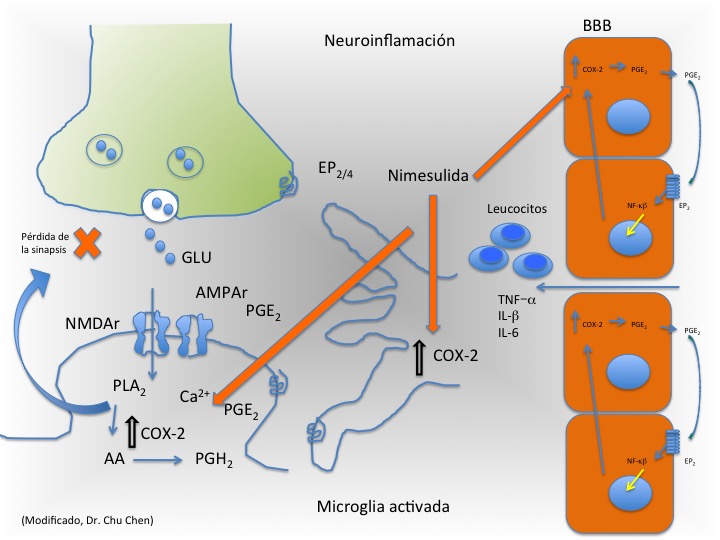
Figura 1. Neuroinflamación. La barrera hematoencefálica (BBB) permite el paso de interleucinas (IL´s) y leucocitos al cerebro, activando a la microglia, esto permitirá que la ciclo-oxigenasa 2 (COX-2) aumente su expresión, generando un proceso inflamatorio, donde habrá un incremento de calcio en la neurona post-sináptica y un incremento en la liberación de glutamato. La nimesulida actúa inhibiendo a la COX-2, permitiendo una mejor sinápsis en neuronas que se encuentran funcionando adecuadamente. PLA2 (fosfolipasa A2), AA (acido araquidónico) PGH2 (prostaglandina H2), PGE2 (prostaglandina E2), NMDAr (recepetor NMDA), AMPAr (receptor AMPA), GLU(glutamato), EP2 (receptor a prostaglandina). Modificado Dr. Chu Chen.
La ciclooxigenasa, está involucrada en la síntesis de prostanoides, una gran familia de metabolitos del ácido araquidónico que comprende a las prostaglandinas, prostaciclinas y tromboxanos. COX-2 se induce en respuesta a factores de crecimiento, citocinas y moléculas pro-inflamatorias, pudiendo generar enfermedades neurodegenerativas.20
En condiciones normales, estas enzimas se involucran en la función sináptica, regulación del flujo sanguíneo, apoptosis, angiogénesis y expresión génica. En circunstancias patológicas tales como el accidente vascular cerebral, Alzheimer, Parkinson, ALS y Creutzfeldt-Jacob producen neuroinflamación involucrando vasodilatación y vasoconstricción, agregación de plaquetas, migración de leucocitos y liberación de citocinas, además de stress oxidativo.21
La pregunta es ¿cómo revertir el proceso neuroinflamatorio después de un accidente vascular? y ¿cuál sería lo más efectivo?, para el paciente.
2. Infarto cerebral y neuroinflamación
Un infarto cerebral ocurre cuando el flujo de sangre es interrumpido, resultando en la deprivación de nutrientes y el oxígeno necesario para mantener los requerimentos metabólicos del cerebro,22 durante el proceso del infarto cerebral se genera la infiltración de células inflamatorias periféricas como los leucocitos, lo que generaría un proceso neuroinflamatorio.23
Sin embargo el término neuroinflamación corresponde exclusivamente a la actividad de la microglia y astrocitos, donde se ha demostrado moléculas involucradas en el proceso tales como citosinas, prostaglandinas y especies reactivas de oxígeno.24
Estudios han demostrado que en la activación de la microglía están involucrados neurotransmisores, ya que éstas células expresan receptores a ATP, adenosina, glutamato, GABA, acetilcolina, dopamina y adrenalina.25
La liberación de citosinas como la IL-1b y el TNF-a, regulan la transcripción de un cuantioso número de genes en el cerebro incluyendo la de las enzimas encargadas de metabolizar el ácido araquidónico como es el caso de la enzima ciclooxigenasa-2 (COX-2), cuyos metabolitos contribuyen a la pérdida de la sinápsis.26
La enzima COX-2, es la responsable de convertir el ácido araquidónico a prostaglandinas y juega un papel importante en la neuroinflamación, además de haber sido implicada en la patogénesis de enfermedades neurodegenerativas, tales como la esclerosis múltiple, Parkinson y la enfermedad de Alzheimer, así como daño por isquemia y epileptogénesis. Se ha determinado que la elevación o inhibición de COX-2 pueden aumentar o suprimir la neurotransmisión glutamaérgica.27
COX-2 en su forma inducible se asocia a procesos inflamatorios20 así como también produce disfunción de la memoria y daño oxidativo.28
Se han utilizados diversos fármacos como terapia que incluyen esteroides y anti-inflamatorios29 no esteroideos,30 también se ha utilizado el bevacizumab para contrarrestar la hemorragia en el sistema nervioso central,31 la glibenclamide, para reducir el edema hemorrágico.32
Se ha determinado que el tratamiento incluye la administración de medicamentos anti-hipertensivos, anti-inflamatorios no esteroideos y barbitúricos.33
Los efectos benéficos de los esteroides en dosis altas reducen la inflamación de manera rápida y duradera,34 sin embargo estudios sobre esteroides han demostrado que pueden dañar el hipocampo en roedores y primates.35
3. ¿Cómo inhibir la neuroinflamación?
Después un derrame cerebral, se puede tratar con intervención quirúrgica o tratamiento. Las células cerebrales mueren rápidamente después de un derrame, es por eso que el tratamiento debe de ser rápido y efectivo, se ha implementado tratamiento antihipertensivo, terapia trombolítica,36 así como uso de esteroides.37-39 Sin embargo después que se ha tratado el derrame cerebral utilizando cirugía, esteroides, el cerebro queda aún inflamado y puede ser por largo tiempo si no es tratado, lo que podría llevar a otra hemorragia.
La cirugía y los tratamientos implicados no son suficientes, ya que el cerebro continúa aún bajo un proceso inflamatorio. Entonces, ¿qué hacer? para inhibir la neuroinflamación.
Una forma eficaz de reducir la neuroinflamación es utilizando anti-inflamatorios no esteroideos, que disminuyan los niveles de expresión de COX-2. Los más utilizados han sido el celecoxib y la nimesulida. En estudios de ensayos clínicos el celecoxib no ha disminuido los niveles de COX-2 en forma adecuada24 sin embargo la nimesulida ha funcionado de manera eficaz,40,41 reduciendo los niveles de prostaglandinas y la COX-2.
Después de la cirugía si se trata de un derrame cerebral o si se tratase de un evento vascular isquémico, es necesario disminuir la neuroinflamación y efectuar una terapia que incluya: a) nimesulida, b) citalopram, c) omega-3 y d) resveratrol.7
Las neuronas deberían de ser capaces de efectuar nuevas conexiones para re-establecer el proceso cognitivo. Antidepresivos como la fluoxetina42 y el citalopram43 que inhiben la recaptura de la serotonina contribuyen a éste proceso. La serotonina regula la morfología neuronal y su recaptura esta involucrada en la formación de nuevas sinapsis, las cuales podrían reconectar neuronas restauradas. Además se ha determinado que los inhibidores de la recaptura de serotonina, aumentan la capacidad cognitiva después de un AVC.44
Los ácidos omega-3, tal como el acido docosahexaenoic (DHA), está involucrado en el desarrollo y remodelado de los “rafts” de la membrana plasmática. El omega-3 podría estar involucrado en reparar los rafts de la membrana y así evitar que los receptores no esten anclados correctamente.45
El resveratrol es incluido en la terapia con el propósito de mantener la integridad neuronal. El resveratrol pertenece a un grupo de moléculas conocidas como fitofenoles, los cuales capturan radicales libres. El resveratrol es encontrado en los extractos de la uva y se utiliza como antioxidante.46 También estudios han demostrado que es capaz de inactivar la microglia en un proceso inflamatorio.47
4. Aplicación de esta terapia.
Hombre de 77 años con dos derrames cerebrales, uno ocurrido a los 72 años y el segundo como consecuencia de una caída, se le practicó una resonacia para visualizar el estado del cerebro. Se llevó a cabo una intervención quirúrgica para drenar el coágulo. El primer derrame cerebral lo tuvo 5 años (no se cuenta con los resultados de la resonacia) antes del segundo (Figura 2), donde se aprecia lesiones intensas en la región subdural izquierda (hace 5 años) y hemisferio derecho, aparentemente desaparición de circunvoluciones y desplazamiento de la línea media (segundo derrame).
El paciente se fue recuperando del proceso quirúrgico, al darlo de alta los médicos continuaron con el tratamiento de antibióticos y paracetamol para el dolor.
El paciente mostró signos de agresividad y desorientación al salir del hospital, al llegar a su casa no conocía a las personas, no hablaba y la agresividad continuaba.
Este paciente se sometió a la terapia para inhibir la neuroinflamación, ésta se le aplicó de igual forma cuando tuvo el primer derrame.
En un período de 10 días ésta persona empezó a dormir mejor, los signos de agresividad desaparecieron completamente, también desapareció el intenso dolor de cabeza. Los familiares del paciente refieren que su forma de actuar es normal, los signos cognitivos están normales, y que es capaz de ejecutar las actividades normales de una persona promedio de su edad.
La terapia consistió:
Medicamento/Complemento |
Dosis |
Tiempo |
Nimesulida |
100 mg |
1 mes |
Citalopram |
20 mg |
Por la mañana/diario. |
Acidos Omega 3 |
1000 mg |
Por la mañana/diario. |
Resveratrol |
500 mg |
Por la mañana/diario. |
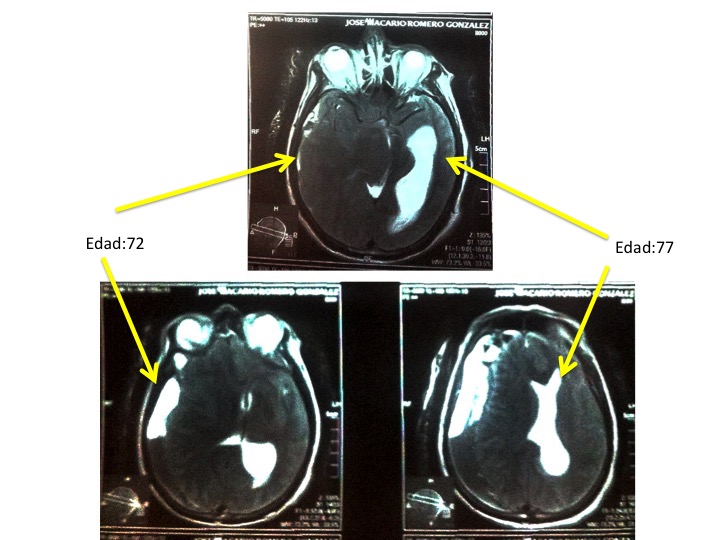
Figura 2. IRM de un hombre de 77 años, después de una caída. Se aprecia un hematoma, del lado derecho como consecuencia de un trauma craneal. Del lado izquierdo se nota un hematoma subdural como consecuencia de un derrame cerebral ocurrido a los 72 años de edad.
La pregunta es ¿debo utilizar la nimesulida, para tratar la neuroinflamación después de un AVC?, la respuesta es sí.
Es verdad que la nimesulida está prohibida en su consumo en muchos países, no es el caso de México, debido a sus efectos hepatotóxicos.48-50 Sin embargo el paracetamol, muy utilizado en la práctica médica también tiene efectos adversos en el hígado resultando éste hepatotóxico.51,52
Ha sido determinado que la nimesulida inhibe mejor la inflamación comparado con otras drogas no esteroideas, se han estado realizando estudios de ensayos clínicos en USA donde se ha demostrado que el celecoxib estando en fase III no ha sido benéfico, sin embargo la nimesulida continua en ensayos clínicos.24
Es necesario que se efectúe una terapia post-AVC, el proceso neuroinflamatorio puede durar mucho tiempo y debido a eso se puede generar otro accidente vascular.
Utilizar la nimesulida por al menos 1 mes mientras el paciente va mejorando cognitivamente y en sus movimientos corporales, le ayudará a tener una mejor calidad de vida.
Al comparar varios anti-inflamatorios como el ácido acetilsalisílico, ibuprofen, nebumetona y nimesulida, el que mejor inhibe a la COX-2 sigue siendo la nimesulida.53 Estudios han demostrado, que después de un ictus el uso de la nimesulida, puede contribuir al aprendizaje y la memoria,54 así como mejorar la capacidad cognitiva, tal y como ha sido observado en roedores, después de un trauma cerebral.55 La terapia post-AVC no solo utiliza nimesulida, también se administra citalopram, omega-3 y resveratrol.
Es necesario que estas dos drogas más los dos complementos sean parte de la terapia. El citalopram es un inhibidor de la recaptura de serotonina, sin embargo tiene la capacidad de crear nuevas conexiones en el cerebro56-58 y aumenta la regeneración vascular.59
Ha sido determinado que los ácidos omega-3 aumentan la angiogénesis y ayudan a la potenciación a largo plazo después de un AVC60 así como neuroprotección.61-63 Experimentos in vitro, han demostrado que el uso del resveratrol atenua la disfunción mitocodrial64 y aumenta la neuroproteción cuando se co-administra con ácido lipoico en modelos de roedores con stroke,65 así como también protegiendo el endotelio vascular.66
Es importante, que después de un evento vascular cerebral que pueda ser isquémico o hemorrágico, se siga con una terapia que le ayude al paciente a tener una mejor calidad de vida y que se recupere de manera satisfactoria.
La terapia que proponemos es novedosa y ha funcionado en pacientes con ictus isquémico o hemorrágico, infortunadamente solo tenemos referencia acerca de ellos por lo que sus familiares nos han expresado de forma verbal, ya que la mayoría no cuenta con los recursos económicos para hacer los estudios que se requieren, el caso que presentamos es solo uno de ellos y que pudimos seguir, éste caso tiene la característica que fué un doble derrame cerebral con una distancia de 5 años, lo que lo hace bastante severo y traumático para el cerebro. Este artículo es una propuesta que nosotros planteamos para que se ejecute después de un evento vascular. Creemos que es importante que el neurocirujano, así como el neurólogo pueda seguir está terapia que nosotros proponemos y que le ayudaría a su paciente a tener una mejor calidad de vida.
Cabe señalar que se requieren de hacer más estudios, donde se pueda hacer un seguimiento a los pacientes. Sin embargo sugerimos que se practique la terapia, que esta pensada únicamente para mejorar al paciente.
A la familia Romero, que muy amablemente nos proporcinó las imágenes de la resonancia de su familiar.
Los autores delaran que no existen conflicto de intereses.
- Scholzke MN, Schwaninger M. Transcriptional regulation of neurogenesis: potential mechanisms in cerebral ischemia. J Mol Med (Berl). 2007;85:577-588.
- Maldonado NJ, Kazmi SO, Suarez JI. Update in the Management of Acute Ischemic Stroke. Crit Care Clin. 2014;30(4):673-697.
- Chen S, Zeng L, Hu Z. Progressing haemorrhagic stroke: categories, causes, mechanisms and managements. J Neurol. 2014.
- Elijovich L, Patel PV, Hemphill JC. Intracerebral hemorrhage. Semin Neurol. 2008;28:657-667.
- Luo Y. Cell-based therapy for stroke. J Neural Transm. 2011;118:61-74.
- Lu Q, Gao L, Huang L et al. Inhibition of mammalian target of rapamycin improves neurobehavioral deficit and modulates immune response after intracerebral hemorrhage in rat. J Neuroinflammation. 2014;11:44.
- Herrera-Rivero M, Aranda- Abreu G. Therapeutics of Alzheimer´s Disease. In: Intech, editor. advanced understanding of neurodegenerative diseases. Ucrania: Ucrania; 2011. p. 193-212.
- Hurley LL, Tizabi Y. Neuroinflammation, neurodegeneration, and depression. Neurotox Res. 2013;23:131-144.
- Lyman M, Lloyd DG, Ji X, Vizcaychipi MP, Ma D. Neuroinflammation: the role and consequences. Neurosci Res. 2014;79:1-12.
- McGeer PL, McGeer EG. Inflammation, autotoxicity and Alzheimer disease. Neurobiol Aging. 2001;22:799-809.
- Miller AA, Spencer SJ. Obesity and neuroinflammation: A pathway to cognitive impairment. Brain Behav Immun. 2014.
- Morganti-Kossmann MC, Rancan M, Otto VI, Stahel PF, Kossmann T. Role of cerebral inflammation after traumatic brain injury: a revisited concept. Shock. 2001;16:165-177.
- Hunot S, Hirsch EC. Neuroinflammatory processes in Parkinson’s disease. Ann Neurol. 2003;53 Suppl 3:S49-58.
- McGeer PL, McGeer EG. Inflammatory processes in amyotrophic lateral sclerosis. Muscle Nerve. 2002;26:459-470.
- Conde JR, Streit WJ. Microglia in the aging brain. J Neuropathol Exp Neurol. 2006;65:199-203.
- Sparkman NL, Johnson RW. Neuroinflammation associated with aging sensitizes the brain to the effects of infection or stress. Neuroimmunomodulat. 2008;15:323-330.
- Godbout JP, Johnson RW. Age and neuroinflammation: a lifetime of psychoneuroimmune consequences. Immunol Allergy Clin North Am. 2009;29:321-337.
- De Vries HE, Blom-Roosemalen MC, van Oosten M et al. The influence of cytokines on the integrity of the blood-brain barrier in vitro. J Neuroimmunol. 1996;64:37-43.
- Laflamme N, Lacroix S, Rivest S. An essential role of interleukin-1beta in mediating NF-kappaB activity and COX-2 transcription in cells of the blood-brain barrier in response to a systemic and localized inflammation but not during endotoxemia. J Neurosci. 1999;19:10923-10930.
- Minghetti L. Cyclooxygenase-2 (COX-2) in inflammatory and degenerative brain diseases. J Neuropathol Exp Neurol. 2004;63:901-910.
- Phillis JW, Horrocks LA, Farooqui AA. Cyclooxygenases, lipoxygenases, and epoxygenases in CNS: their role and involvement in neurological disorders. Brain Res Rev. 2006;52:201-243.
- Ahmad M, Graham SH. Inflammation after stroke: mechanisms and therapeutic approaches. Transl Stroke Res. 2010;1:74-84.
- Khansari PS, Sperlagh B. Inflammation in neurological and psychiatric diseases. Inflammopharmacology. 2012;20:103-107.
- Glass CK, Saijo K, Winner B, Marchetto MC, Gage FH. Mechanisms underlying inflammation in neurodegeneration. Cell. 2010;140:918-934.
- Lee M. Neurotransmitters and microglial-mediated neuroinflammation. Curr Protein Pept Sc. 2013;14:21-32.
- Rao JS, Kellom M, Kim HW, Rapoport SI, Reese EA. Neuroinflammation and synaptic loss. Neurochem Res. 2012;37:903-910.
- Yang H, Chen C. Cyclooxygenase-2 in synaptic signaling. Curr Pharm Des. 2008;14:1443-1451.
- Gaur V, Kumar A. Effect of nonselective and selective COX-2 inhibitors on memory dysfunction, glutathione system, and tumor necrosis factor alpha level against cerebral ischemia reperfusion injury. Drug Chem Toxicol. 2012;35:218-224.
- Peng M, Wang YL, Wang FF, Chen C, Wang CY. The cyclooxygenase-2 inhibitor parecoxib inhibits surgery-induced proinflammatory cytokine expression in the hippocampus in aged rats. J Surg Res. 2012;178:e1-e8.
- Nimmo AJ, Vink R. Recent patents in CNS drug discovery: the management of inflammation in the central nervous system. Recent Pat CNS Drug Discov. 2009;4:86-95.
- Letarte N, Bressler LR, Villano JL. Bevacizumab and central nervous system (CNS) hemorrhage. Cancer Chemother Pharmacol. 2013;71:1561-1565.
- Khanna A, Walcott BP, Kahle KT, Simard JM. Effect of glibenclamide on the prevention of secondary brain injury following ischemic stroke in humans. Neurosurg Focus. 2014;36:E11.
- Adukauskiene D, Bivainyte A, Radaviciute E. Cerebral edema and its treatment. Medicina (Kaunas). 2007;43:170-176.
- De los Reyes RA, Ausman JI, Diaz FG. Agents for cerebral edema. Clin Neurosurg. 1981;28:98-107.
- Hoschl C, Hajek T. Hippocampal damage mediated by corticosteroids--a neuropsychiatric research challenge. Eur Arch Psychiatry Clin Neurosci. 2001;251 Suppl 2:II81-II88.
- Audebert HJ, Saver JL, Starkman S, Lees KR, Endres M. Prehospital stroke care: new prospects for treatment and clinical research. Neurology. 2013;81:501-508.
- Qizilbash N, Lewington SL, Lopez-Arrieta JM. Corticosteroids for acute ischaemic stroke. Cochrane Database Syst Rev. 2000CD000064.
- Albizzati MG, Candelise L, Capitani E, Colombo A, Spinnler H. Association of glycerol to dexamethasone in treatment of stroke patients. Acta Neurol Scand. 1979;60:77-84.
- Freeman J, Tappin J, Karat AB, Meecham J. Dexamethasone in acute stroke. Br Med J. 1978;2:1500.
- Candelario-Jalil E, Mhadu NH, Gonzalez-Falcon A et al. Effects of the cyclooxygenase-2 inhibitor nimesulide on cerebral infarction and neurological deficits induced by permanent middle cerebral artery occlusion in the rat. J Neuroinflamm. 2005;2:3.
- Candelario-Jalil E. Nimesulide as a promising neuroprotectant in brain ischemia: new experimental evidences. Pharmacol Res. 2008;57:266-273.
- Wang JW, David DJ, Monckton JE, Battaglia F, Hen R. Chronic fluoxetine stimulates maturation and synaptic plasticity of adult-born hippocampal granule cells. J Neurosci. 2008;28:1374-1384.
- Alboni S, Benatti C, Capone G et al. Time-dependent effects of escitalopram on brain derived neurotrophic factor (BDNF) and neuroplasticity related targets in the central nervous system of rats. Eur J Pharmacol. 2010;643:180-187.
- Jorge RE, Acion L, Moser D, Adams HPJ, Robinson RG. Escitalopram and enhancement of cognitive recovery following stroke. Arch Gen Psychiatry. 2010;67:187-196.
- Calder PC. Marine omega-3 fatty acids and inflammatory processes: Effects, mechanisms and clinical relevance. Biochim Biophys Acta. 2014.
- Renaud J, Martinoli MG. Resveratrol as a Protective Molecule for Neuroinflammation: a Review of Mechanisms. Curr Pharm Biotechnol. 2014.
- Zhang F, Liu J, Shi JS. Anti-inflammatory activities of resveratrol in the brain: role of resveratrol in microglial activation. Eur J Pharmacol. 2010;636:1-7.
- Lacroix I, Lapeyre-Mestre M, Bagheri H, Pathak A, Montastruc JL. Nonsteroidal anti-inflammatory drug-induced liver injury: a case-control study in primary care. Fundam Clin Pharmacol. 2004;18:201-206.
- Mahajan A, Sharma R. COX-2 selective nonsteroidal anti-inflammatory drugs: current status. J Assoc Physicians India. 2005;53:200-204.
- Aithal GP, Day CP. Nonsteroidal anti-inflammatory drug-induced hepatotoxicity. Clin Liver Dis. 2007;11:563-75.
- Marques PE, Oliveira AG, Pereira RV et al. Hepatic DNA deposition drives drug-induced liver injury and inflammation in mice. Hepatology. 2014.
- Connolly MK, Ayo D, Malhotra A et al. Dendritic cell depletion exacerbates acetaminophen hepatotoxicity. Hepatology. 2011;54:959-968.
- Kerola M, Vuolteenaho K, Kosonen O, Kankaanranta H, Sarna S, Moilanen E. Effects of nimesulide, acetylsalicylic acid, ibuprofen and nabumetone on cyclooxygenase-1- and cyclooxygenase-2-mediated prostanoid production in healthy volunteers ex vivo. Basic Clin Pharmacol Toxicol. 2009;104:17-21.
- Zhang T, Zhang YX. [The effect of nimesulide on learning and memory function after serve traumatic brain injury in rats]. Sichuan Da Xue Xue Bao Yi Xue Ban. 2011;42:498-502.
- Cernak I, O’Connor C, Vink R. Activation of cyclo-oxygenase-2 contributes to motor and cognitive dysfunction following diffuse traumatic brain injury in rats. Clin Exp Pharmacol Physiol. 2001;28:922-925.
- Seo MK, Lee CH, Cho HY et al. Effects of antidepressant drugs on synaptic protein levels and dendritic outgrowth in hippocampal neuronal cultures. Neuropharmacology. 2014;79:222-233.
- Wuwongse S, Cheng SS, Wong GT et al. Effects of corticosterone and amyloid-beta on proteins essential for synaptic function: implications for depression and Alzheimer’s disease. Biochim Biophys Acta. 2013;1832:2245-2256.
- Dhami KS, Churchward MA, Baker GB, Todd KG. Fluoxetine and citalopram decrease microglial release of glutamate and D-serine to promote cortical neuronal viability following ischemic insult. Mol Cell Neurosci. 2013;56:365-374.
- Espinera AR, Ogle ME, Gu X, Wei L. Citalopram enhances neurovascular regeneration and sensorimotor functional recovery after ischemic stroke in mice. Neuroscience. 2013;247:1-11.
- Wang J, Shi Y, Zhang L et al. Omega-3 polyunsaturated fatty acids enhance cerebral angiogenesis and provide long-term protection after stroke. Neurobiol Dis. 2014;68:91-103.
- Hong SH, Belayev L, Khoutorova L, Obenaus A, Bazan NG. Docosahexaenoic acid confers enduring neuroprotection in experimental stroke. J Neurol Sci. 2014;338:135-141.
- Eady TN, Khoutorova L, Obenaus A, Mohd-Yusof A, Bazan NG, Belayev L. Docosahexaenoic acid complexed to albumin provides neuroprotection after experimental stroke in aged rats. Neurobiol Dis. 2014;62:1-7.
- Hu X, Zhang F, Leak RK et al. Transgenic overproduction of omega-3 polyunsaturated fatty acids provides neuroprotection and enhances endogenous neurogenesis after stroke. Curr Mol Med. 2013;13:1465-1473.
- Panickar KS, Qin B, Anderson RA. Ischemia-induced endothelial cell swelling and mitochondrial dysfunction are attenuated by cinnamtannin D1, green tea extract, and resveratrol in vitro. Nutr Neurosci. 2014.
- Saleh MC, Connell BJ, Rajagopal D et al. Co-administration of resveratrol and lipoic acid, or their synthetic combination, enhances neuroprotection in a rat model of ischemia/reperfusion. PLoS One. 2014;9:e87865.
- Clark D, Tuor UI, Thompson R et al. Protection against recurrent stroke with resveratrol: endothelial protection. PLoS One. 2012;7:e47792.
| Recibido: 10 de marzo de 2015 | Aceptado: 30 de agosto de 2015 |
Correspondencia: Laboratorio de Neuroendocrinología. Centro de Investigaciones Cerebrales. Universidad Veracruzana. Av. Luis Castelazo Ayala s/n, carr. Xalapa-Veracruz, km 3.5, C.P. 91190, Col. Industrial Ánimas. Xalapa, Veracruz, México. Teléfono: +52-228-8418900 Ext. 13616. E-mail: garanda@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
