La Enfermedad de Alzheimer y la Diabetes Mellitus
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Sonia Lilia Mestizo-Gutiérrez1, María Elena Hernández-Aguilar2, Fausto Rojas-Durán2, Jorge Manzo-Denes2,3, Gonzalo Emiliano Aranda Abreu2
1Doctorado en Investigaciones Cerebrales, Universidad Veracruzana, 2Cuerpo Académico de Neuroquímica, Centro de Investigaciones Cerebrales, Universidad Veracruzana, 3Cuerpo Académico de Neurociencias, Centro de Investigaciones Cerebrales, Universidad Veracruzana.
Resumen/Abstract
Introducción
Conclusiones
Agradecimientos
Referencias
Correspondencia
Este trabajo hace una revisión de diferentes estudios que han reportado la relación de la diabetes mellitus (DM) con la Enfermedad de Alzheimer (EA) y viceversa. En la última década, se ha incrementado el número de trabajos centrados en encontrar nuevas evidencias que muestren la relación entre la DM y la EA. La DM y la EA comparten muchas características clínicas y bioquímicas: elevación del estrés oxidativo, inflamación, disfunción vascular, metabolismo de lípidos alterado, hipercolesterolemia, aumento de la formación de productos finales de glicación avanzada, patología mitocondrial y la alteración del metabolismo de la glucosa (sensibilidad a la insulina y el factor de crecimiento insulínico) que sugieren mecanismos patogénicos comunes. Recientemente se ha establecido que la inflamación del sistema nervioso central y periférico es la liga de la DM con la EA. Asimismo, se corroboró que la señalización defectuosa de insulina y la disfunción mitocondrial son características comunes en la EA y la DM. A pesar de los importantes hallazgos, se necesita la comprensión total de ambos procesos patológicos para determinar si estas enfermedades comparten las mismas dianas terapeúticas para tratamientos más efectivos e incluso detener el avance de la EA.
Palabras clave: Enfermedad de Alzheimer, Diabetes mellitus, Resistencia a la insulina, Neuroinflamación, Inflamación.
This paper reviews various studies have reported the relationship of diabetes mellitus (DM) with Alzheimer's disease (AD). In the past decade has increased the number of studies on finding new evidence of the relationship between DM and AD. The DM and AD share many clinical and biochemical characteristics: elevation of oxidative stress, inflammation, vascular dysfunction, altered lipid metabolism, hypercholesterolemia, increased formation of advanced glycation end products, mitochondrial pathology and altered glucose metabolism (sensitivity to insulin and insulin-like growth factor) suggesting common pathogenic mechanisms. Recently it has been established that inflammation in the central nervous and peripheral system is the link between DM with EA. It was also confirmed that the defective insulin signaling and mitochondrial dysfunction are common features in AD and DM. Despite the important findings, full understanding of both disease processes are needed to determine whether these conditions share the same therapeutic targets for more effective treatments and even halt the progression of AD
Key words: Alzheimer's disease, Diabetes mellitus, Insulin resistance, Neuroinflammation, Inflammation.
La enfermedad de Alzheimer (EA) es una enfermedad de evolución lenta que se caracteriza por la pérdida progresiva de la memoria, la orientación, el juicio y el lenguaje. El principal factor de riesgo es la edad avanzada. Actualmente, no existe cura para esta enfermedad, por lo que se ha hecho importante el esfuerzo por descubrir métodos de diagnóstico más tempranos y de fácil acceso, y tratamientos más efectivos.1
En la EA existe pérdida neuronal y la presencia de dos alteraciones típicas: la placas neurítica o placa senil producida principalmente por el beta amiloide (Aβ) y la degeneración u ovillo neurofibrilar cuyo principal componente es la proteína tau. Las placas neuríticas son estructuras esféricas que se ubican entre las neuronas, y el ovillo neurofibrilar es una lesión intracelular que afecta principalmente a las neuronas piramidales. Actualmente está tomando relevancia un hallazgo donde se sugiere que los oligómeros de Aβ (AβOs) o ligandos difusibles derivados del Aβ (ADDL) pueden ser la causa de la pérdida de memoria, sobre todo en etapas tempranas de la enfermedad y tienen participación en la disfunción sináptica.2,3
La certeza del diagnóstico de la EA es de aproximadamente el 85% y sólo se confirma por el examen post mortem. A pesar de los intensos esfuerzos de investigación en las últimas décadas no existe cura para esta enfermedad. La patogénesis de la EA sigue siendo poco conocida y aún no se comprenden totalmente los mecanismos moleculares subyacentes.
En el año 2013 se diagnosticaron más de 35 millones de casos de EA a nivel mundial y se estima que el número de casos llegue a 115 millones para el año 2050.4 Según el Instituto Nacional de Geriatría, en México hay 700 mil casos detectados y se estima que 7% de mayores de 60 años padece algún tipo de demencia. Cada cinco años la prevalencia se duplica.
La Diabetes Mellitus (DM) es una enfermedad crónica que se genera cuando el cuerpo no puede producir suficiente insulina o utilizarla de manera eficaz. La insulina es una hormona producida por las células beta del páncreas que permite la entrada de la glucosa de los alimentos a las células del cuerpo y se convierte en la energía necesaria para que funcionen los músculos y los tejidos. Una persona con diabetes no absorbe adecuadamente la glucosa por lo que sigue circulando por la sangre. Con el paso del tiempo daña los tejidos del cuerpo. Los tres tipos de diabetes son: diabetes mellitus tipo1 (DM1), diabetes gestacional (DMG) y la más común, la diabetes mellitus tipo 2 (DM2). La DM1 es causada por una reacción autoinmune donde el sistema de defensa del cuerpo ataca a las células beta que producen insulina en el páncreas y el cuerpo no es capaz de producir la insulina que necesita. Generalmente la padecen niños y jóvenes. La DMG se presenta en la mujer durante el embarazo alrededor de la semana 24 y normalmente desaparece después del nacimiento. En la DM2, el cuerpo produce su propia insulina pero no puede responder a sus efectos, dando lugar a la acumulación de glucosa en la sangre. Usualmente la padecen adultos y es uno de los problemas de salud más importantes.5
La Federación Internacional de Diabetes en el 2013 refiere que en México existen 8.7 millones de pacientes con diabetes. A nivel mundial existen 382 millones de diabéticos y se estima que para el año 2025 se incremente a 592 millones. El número de personas con DM2 está aumentando en todos los países.5
Recientes estudios han mostrado mecanismos patogénicos comunes entre la EA y trastornos metabólicos como la obesidad y la DM2. La inflamación del sistema nervioso central (SNC) y del sistema nervioso periférico establece el vínculo de la EA con la DM2.6,7 Uno de los factores de riesgo de la DM2 es la obesidad. Se cree que la obesidad es causada por la respuesta alterada de la hormona leptina derivada del tejido adiposo, cuya función consiste en reducir la ingesta de alimentos y promover el gasto de energía. Se ha demostrado que la insulina y la leptina regulan funciones neuronales y sinápticas del hipocampo, la corteza y el cerebelo para proteger a las neuronas de la neurodegeneración y la muerte celular, por lo que afecta la cognición y el comportamiento. Además, la insulina y la leptina regulan los niveles de Aβ a través de enzimas como la degradadora de insulina.2
En el inicio de la década de los 90’s, el estudio de Rotterdam estableció la relación inicial entre la EA y la DM. Dicho estudio basado en 6,330 participantes con edades comprendidas entre 55 y 99 años, demostró que de los 265 pacientes con demencia, 59 de ellos tenían DM. El análisis de regresión múltiple reveló una asociación positiva entre la DM y la demencia. Las asociaciones fuertes fueron entre la demencia y la diabetes tratada con insulina. La relación fue más fuerte con la demencia vascular, pero también se observó una asociación con la EA.8,9
Recientemente se publicó un trabajo derivado del estudio de Rotterdam basado en el metabolismo de la insulina y el riesgo de EA. El estudio se basó en un cohorte de base poblacional de 3,139 individuos sin demencia, sin antecedentes de diabetes. Al inicio del estudio se cuantificaron los niveles de glucosa y de insulina en ayunas. Durante el seguimiento, 211 participantes desarrollaron EA, 71 de ellos dentro de 3 años a partir del inicio del estudio. La glucosa no se asoció con un mayor riesgo de EA y tampoco encontraron una interacción del alelo APOE ε4 con el metabolismo de la insulina en el riesgo de EA.10
Diversos estudios11-22proponen que la EA puede deberse a una señalización defectuosa de insulina en el cerebro. Incluso algunos autores, la han denominado “diabetes tipo 3”.11-13, 20, 21,23
La EA es de naturaleza multifactorial y un gran factor de riesgo es la edad avanzada, sin embargo otros factores de riesgo pueden ser la obesidad y la DM. En un meta análisis se revisó la masa corporal, DM, síndrome metabólico, los niveles de glucosa y de insulina como factores de riesgo de la EA. Los resultados reportaron que la obesidad y la DM aumentan el riesgo de padecer la EA. Aunque el nivel de riesgo es menor que con el alelo APOE ε4, la alta prevalencia de estos trastornos puede dar lugar a aumentos sustanciales en la incidencia futura de la EA. Los cambios fisiológicos comunes en la obesidad y la diabetes pueden promover el desarrollo de la EA.24
Se ha incrementado la evidencia de que la EA es una enfermedad metabólica con alteraciones sustanciales y progresivas del uso de glucosa en el cerebro, la sensibilidad a la insulina y del factor de crecimiento insulínico (IGF).17
La EA y la DM están asociadas con la liberación y/o señalización defectuosa de insulina, deterioro de la absorción de glucosa, amiloidosis, incremento del estrés oxidativo, la estimulación de la ruta apoptótica, angiopatía, peroxidación de lípidos anormal, envejecimiento en la DM2, atrofia cerebral, aumento de la formación de productos finales de glicación avanzada, la fosforilación de tau, metabolismo de lípidos alterado y patología mitocondrial.25
Estudios epidemiológicos encontraron evidencia de asociaciones transversales y prospectivas entre DM2 y moderado deterioro cognitivo en la memoria y funciones ejecutivas. También existe evidencia de la existencia de riesgo elevado de demencia vascular y la EA en pacientes con DM2 , aunque con una fuerte interacción de otros factores como la hipertensión, la dislipidemia y el genotipo APOE. El aumento del riesgo de EA también puede estar mediado por la exacerbación de la neurotoxicidad de Aβ por glicosilación avanzada identificada en la matriz de los ovillos neurofibrilares y placas amiloides en cerebros con EA o asociaciones con funciones de insulina.26 Un trabajo de análisis de expresión de genes reportó que la expresión alterada de genes relacionados con la DM en cerebros con EA daba como resultado la patología de la EA, que de ese modo se puede exacerbar por la resistencia periférica a la insulina o la DM.27 Otro trabajo investigó la contribución de los biomarcadores de la homeostasis de la glucosa (adiponectina, glucosa, albúmina glucosilada y los niveles de insulina) y la inflamación (proteína C reactiva de alta sensibilidad y fosfolipasa asociada a niveles de lipoproteína A2) como factores de riesgo para desarrollar la EA y todas las causas de demencia. Los resultados encontraron que en las mujeres el aumento de los niveles de adiponectina en plasma es un factor de riesgo para el desarrollo de la EA y las causas de la demencia. La adiponectina es una hormona derivada de la grasa visceral que sensibiliza el cuerpo a la insulina, tiene propiedades anti-inflamatorias y desempeña un papel en el metabolismo de la glucosa y los lípidos.28
Un reciente trabajo muestra que la amilina, polipéptido amiloide de los islotes secretada por células beta pancreáticas y la proteína beta amiloide (Aβ) depositada en los cerebros de enfermos de Alzheimer, comparten muchas propiedades biofísicas y fisiológicas. Tanto la amilina como el Aβ activan directamente a los receptores acoplados a proteínas G y activan múltiples vías de transducción de señales intracelulares comunes que pueden culminar en muerte celular apoptótica. Los antagonistas del receptor de la amilina pueden bloquear tanto los efectos biológicos y neurotóxicos de la amilina y del Aβ. Por lo que los receptores de la amilina parecen estar implicados en la fisiopatología de la EA y la diabetes y podrían servir como un enlace molecular entre ambos padecimientos.29 Debido a que no existe cura para la EA y los tratamientos actuales aminoran los síntomas pero no detienen el avance de esta enfermedad, la posible relación de la DM con la EA abre las puertas al desarrollo de nuevos fármacos para modular la resistencia a la insulina, disminuir la acumulación del Aβ en el cerebro y el deterioro cognitivo que está asociado con la EA. Las estrategias terapéuticas que se dirigen a la relación entre la resistencia a la insulina y EA podrían beneficiar el desarrollo de futuros fármacos para la EA. 2. Enfermedad de Alzheimer y diabetes mellitus: estudios experimentales Varios estudios experimentales también han reportado la relación entre la EA y la DM. Se ha estudiado en un modelo de ratón transgénico la posible relación de la DM con la patología de la proteína tau implicada en el desarrollo de los ovillos neurofibrilares. En este trabajo se examinaron los efectos de la DM experimental sobre la patología tau preexistente en la cepa de ratón transgénico pR5. La DM experimental fue inducida mediante la administración de estreptozotocina, que causa la deficiencia de insulina. Se determinó la fosforilación de tau, mediante la inmunohistoquímica y Western Blot. Los resultados demostraron que la disminución de la insulina después de la inyección de estreptozotocina y el consecuente aumento de los niveles de glucosa en sangre causa hiperfosforilación de tau, una proteína asociada con la EA.30 Otro estudio determinó que la insulina participa en el mantenimiento de las funciones del SNC. Se identificaron varios cambios de expresión en los genes del cerebro, relacionados con la secreción de insulina pancreática, por lo que estos genes podrían mediar la producción de insulina y la exocitosis en el cerebro. Los resultados presentaron la primera caracterización de la expresión de todo el genoma que presentó cambios en regiones específicas del cerebro en un modelo de diabetes y mostraron el papel de la señalización de la insulina en las funciones cerebrales ofreciendo una prueba experimental que apoya la teoría de la diabetes tipo 3.31 En un estudio se investigó el efecto de Aβ en la sensibilidad a la insulina in vivo mediante la inyección de Aβ42 en ratones wild-type y el suministro de anticuerpos Aβ neutralizantes o adenovirus. Los resultados demuestran que Aβ induce resistencia a la insulina hepática in vivo a través de JAK2, lo que sugiere que la inhibición de la señalización de Aβ es una nueva estrategia para tratar la resistencia a la insulina y la DM2.32 También se elaboró un estudio para determinar cómo la diabetes contribuye a la disfunción cognitiva y al envejecimiento. Se utilizó estreptozotocina para inducir la DM1 en ratones con senescencia acelerada (SAMP8 senescence accelerated prone 8) y ratones de senescencia resistente (SAMR1) para desarrollar procesos de envejecimiento normales. La DM1 aumentó dramáticamente el Aβ y la inmunoreactividad de la proteína ácida fibrilar glial (GFAP) en el hipocampo de los ratones SAMP8 y en menor medida en ratones SAMR1 de la misma edad. Además reveló agregados Aβ dentro de los procesos astrocíticos que rodean los vasos. El análisis de Western blot de ratones SAMP8 con DM1 mostró un elevado procesamiento de la APP y la glicación de proteínas, junto con el aumento de la inflamación. La DM1 elevó la fosforilación de tau en los ratones SAMR1 pero no aumentó más en los ratones SAMP8. Estos datos sugieren que el metabolismo aberrante de la glucosa potencia el fenotipo de envejecimiento en ratones viejos y contribuye al desarrollo de la etapa temprana de la EA en los animales más jóvenes.33 Recientes estudios de alteraciones en la vía de señalización de la insulina han revelado nuevas perspectivas sobre los vínculos entre la EA y la DM1 centradas en el glucógeno sintasa cinasa-3 (GSK3). En este estudio se desarrolló un modelo de ratón que combina la DM1 y la EA. Los ratones que combinan la sobreexpresión de APP (proteína precursora amiloide) con la diabetes mostraron una disminución de la actividad del receptor de la insulina y un aumento de la actividad GSK3. Al mismo tiempo, se incrementó la fosforilación de tau y el número de placas de Aβ en el cerebro de ratones transgénicos diabéticos-APP. Los resultados indican que las características patológicas de la EA están exageradas en el cerebro de los ratones transgénicos que sobreexpresan APP y que tienen concurrentemente DM1, poniendo de manifiesto un posible mecanismo de la disfunción cerebral común entre la EA y la diabetes.34 3. Resistencia a la insulina en la EA La resistencia a la insulina se caracteriza por elevaciones crónicas de la insulina periférica, la reducción central de los niveles de insulina y la anormalidad de la actividad de la insulina. La insulina no sólo modula el metabolismo de la glucosa periférica, sino también la función normal del cerebro y las condiciones relacionadas con la desregulación de la insulina, tales como la obesidad y la DM que pueden tener efectos nocivos en la función cerebral. Los posibles mecanismos que vinculan la resistencia a la insulina con la EA son la alteración en el procesamiento de APP, los defectos en la transducción de señales relacionados con la función neuronal y toxicidad celular como el estrés oxidativo y la inflamación.22 La resistencia a la insulina produce inflamación del cerebro, estrés oxidativo, alteraciones en los niveles de Aβ y muerte celular. La EA se ha llegado a considerar como parte de un trastorno neuroendócrino. Las funciones de la insulina consisten en el control de los procesos de liberación de neurotransmisores en la sinapsis y la activación de vías de señalización asociadas con el aprendizaje y la memoria a largo plazo. Estudios del cerebro post mortem muestran que la expresión de insulina es inversamente proporcional a la etapa de Braak utilizada para medir el nivel de progresión de la EA. La DM y la EA comparten el aumento de estrés oxidativo, incluyendo los productos finales de glicación avanzada (AGEs), en comparación con individuos normales. Los pacientes diabéticos parecen tener un mayor riesgo de padecer la EA porque los AGEs se acumulan en los ovillos neurofibrilares y placas amiloides de los cerebros con EA.13 La resistencia a la insulina y la deficiencia de insulina funcionan como mediadores del deterioro cognitivo y de la neurodegeración, particularmente de la EA. La insulina y factor de crecimiento insulínico (IGF) regulan la supervivencia neuronal, el metabolismo de la energía y la plasticidad requeridos en el aprendizaje y la memoria. Deficiencias endógenas de insulina del cerebro y el IGF participan en la mayoría de las anormalidades asociadas a la EA. Estudios experimentales y epidemiológicos han revelado que la neurodegeneración está asociada con la resistencia periférica a la insulina que probablemente se lleve a cabo en el eje cerebro hígado donde los lípidos tóxicos, incluyendo a las ceramidas, cruzan la barrera hematoencefálica y causan resistencia a la insulina en el cerebro, estrés oxidativo, neuroinflamación y muerte celular. Esencialmente existe un mecanismo dual de la resistencia a la insulina que conduce a un tipo de neurodegeración: uno mediado por factores endógenos al sistema nervioso central y el otro relacionado con la resistencia periférica a la insulina que produce exceso de ceramidas citotóxicas.14 En el estudio de Hisayama se examinó la asociación entre los factores relacionados con la DM y la EA para evaluar cómo afecta la diabetes al proceso patogénico de la EA. Este estudio incluyó muestras de 135 autopsias (74 hombres y 61 mujeres) de los residentes de la ciudad de Hisayama realizado entre 1998 y 2003, que se sometieron a una prueba de tolerancia a la glucosa oral en los exámenes clínicos en 1988. Se midieron los factores relacionados con la diabetes, incluyendo la glucosa en ayunas, glucosa postprandial de 2 horas, la insulina en ayunas y la evaluación del modelo de homeostasis de la resistencia a la insulina (HOMA-IR). Las asociaciones entre cada factor con la EA se examinaron mediante análisis de covarianza y análisis de regresión logística. Los niveles más altos de glucosa postprandial de 2 horas, la insulina en ayunas y la resistencia a la insulina se asociaron con mayor riesgo de placas neuríticas. Sin embargo, no hubo relaciones entre los factores relacionados con la diabetes y los ovillos neurofibrilares. En lo referente a los efectos del genotipo APOE sobre el riesgo de la patología de la EA, la coexistencia de la hiperglucemia y el alelo APOE ε4 aumentó el riesgo de formación de placas neuríticas. Un aumento similar se observó para la hiperinsulinemia y la resistencia a la insulina. Los resultados de este estudio sugieren que la hiperinsulinemia y la hiperglucemia causada por resistencia a la insulina acelera la formación de placas neuríticas en combinación con los efectos del alelo APOE ε4.15 Diversas evidencias muestran que los trastornos metabólicos, el estrés oxidativo, la neuroinflamación, la insulina, la resistencia a IGF y la deficiencia de la relación insulina/IGF participan en la EA. Las alteraciones en la señalización de insulina cerebral/IGF conducen a una mayor expresión del precursor de la proteína Aβ (AβPP) y la acumulación de AβPP-Aβ. Además, promueven el estrés oxidativo y los déficits en el metabolismo de la energía, que conduce a la activación pro AβPP-Aβ que median las cascadas de neurodegeneración.17 El mecanismo común más importante entre la DM2 y la EA es la afectación de la señalización de insulina; una forma de amiloide tóxico puede dañar los receptores de insulina neuronales y afectar a la señalización de insulina y la supervivencia celular. También se ha identificado un papel importante de la enzima en la degradación de insulina así como la degradación del péptido Aβ.21 La EA y la DM2 comparten elementos comunes en la forma de resistencia a la insulina. La falta de insulina en el cerebro deja a las neuronas indefensas contra el estrés oxidativo, la toxicidad de Aβ y la apoptosis. El Aβ es especialmente peligroso para las neuronas, ya que reduce aún más la señalización de la insulina y puede alterar los niveles de enzimas protectoras que participan en su degradación.35 4. Inflamación y resistencia a la insulina en la EA y la DM Diversos estudios convergen en la implicación de la inflamación como un factor clave en la relación de la DM con la EA.3,6,7,14,17,22,28,33,36,37 La inflamación del SNC junto con la alteración de la señalización de la insulina neuronal y la disfunción neuronal en la EA pueden ser el resultado de procesos inflamatorios sistémicos que ocurren durante toda la vida.7 La inflamación a nivel periférico intensifica la disfunción neuronal de la EA y podría conducir al desarrollo de nuevos tratamientos. Los principales factores comunes entre la EA y la DM son la inflamación, la resistencia a la insulina y la disfunción mitocondrial. La hiperglucemia de la prediabetes puede estar acompañada de inflamación periférica en niveles muy bajos que podría impactar directamente en la señalización de insulina del cerebro.37 Se ha demostrado que el prolongado estrés metabólico y la activación de las vías proinflamatorias conducen a una atenuada señalización de la insulina y a la disminución de la respuesta celular a la insulina. La EA está asociada con neuroinflamación crónica y niveles elevados de citoquinas. En la periferia, el tejido en degeneración y la deposición de materiales anormales altamente insolubles son estimulantes de la inflamación. Del mismo modo, en las neuronas del cerebro con EA, los depósitos de péptido Aβ y los ovillos neurofibrilares brindan estímulos para la inflamación. Debido a que estos estímulos son discretos, microlocalizados y están presentes desde la etapa temprana hasta la etapa terminal de la EA, el incremento de citoquinas y otros mediadores de la inflamación también es discreto, microlocalizado y crónico.38 La inflamación que se produce en la EA activa la microglía agrupada alrededor del Aβ de las placas neuríticas que induce la alteración de la transcripción de genes incluyendo la activación de citoquinas proinflamatorias y quimiocinas que contribuyen al proceso neurodegenerativo.39 En los pacientes con EA existe aumento de las concentraciones en sangre de varios mediadores inflamatorios incluyendo a TNF-α, IL6, e IL-1β, TGF-β, IL-12 y IL-18.40 El TNF-α es secretado en el cerebro principalmente por la microglía en respuesta a un trauma e infección mientras que los niveles elevados de TNF-α causan resistencia a la insulina a nivel periférico. Se ha demostrado que TNF-α es muy importante en los trastornos metabólicos. En el tejido adiposo existe una sobreproducción de los niveles del TNF-α y los niveles elevados de adipocinas también podrían ligar la inflamación a nivel periférico con la inflamación del SNC. La asociación entre la DM2 y la EA se basa en la hipótesis de que las moléculas proinflamatorias producidas a nivel periférico (TNF-α, IL-1β, IL6) atraviesan la barrera hematoencefálica y activan la microglía del SNC disparando la inflamación a nivel cerebral.7 La placas neuríticas de la EA se caracterizan por la presencia del péptido Aβ, sin embargo recientes estudios sugieren que los principales efectos neuropatológicos pueden atribuirse a toxinas denominadas oligómeros de Aβ (AβOs) o ligandos difusibles derivados del Aβ (ADDL) que se acumulan en la EA produciendo disfunción sináptica y pérdida de la memoria. Una hipótesis más reciente considera que la disfunción neuronal y pérdida de la sinapsis de la EA son el resultado de la acumulación de los AβOs.41 Recientemente se han ligado los mecanismos neuropatogénicos producidos por los AβOs con mecanismos involucrados en la resistencia a la insulina periférica de la DM. Los AβOs reducen la plasticidad y potencian la pérdida de la sinapsis, contribuyen al daño oxidativo y causan la hiperfosforilación de tau. Los AβOs también están implicados en la activación aberrante y desregularización del receptor NMDA del glutamato que conduce a la excesiva producción de especies reactivas al oxígeno (ROS) como consecuencia del incremento del influjo de Ca2+ (relacionado con la disfunción mitocondrial). Se ha propuesto que en la EA la disfunción mitocondrial junto con niveles elevados de ROS afectan la señalización de insulina. Los efectos tóxicos de los AβOs pueden interrumpir la señalización de la insulina del cerebro mediante mecanismos proinflamatorios similares a los que ocurren en la DM a nivel periférico. La señalización proinflamatoria principalmente de TNF-α y de las interleucinas (IL-1β, IL-6) provocan la activación de las cinasas del estrés: JNK (c-Jun N terminal cinasa), IKK (IκBα cinasa) y
PKR cinasa desencadenando la inhibición del receptor de insulina substrato 1 (RI1) que bloquea las acciones intracelulares de la insulina produciendo la disfunción sináptica de la EA y el consecuente deterioro de la memoria en el hipocampo. En la Figura 1 se explica a detalle la relación de la DM2 con la EA caracterizada por el deterioro de la señalización de la insulina como resultado de procesos inflamatorios.3,7,37
Figura 1. La inflamación a nivel periférico provocada por la edad avanzada, la resistencia a la insulina y la DM2, así como por infecciones causadas por patógenos o trastornos inflamatorios sistémicos contribuye a la neuroinflamación y señalización defectuosa de la insulina que conllevan a la disfunción sináptica y daño en la memoria de la EA. La inflamación periférica es un proceso crónico que produce un exceso de citoquinas pro-inflamatorias como el factor de necrosis tumoral (TNF-α) e interleucinas (IL-1β, IL-6) quienes atraviesan la barrera hematoencefálica y junto con la activación de la microglía producida por los oligómeros de Aβ conducen al incremento del TNF-α. El receptor del TNF-α produce la activación aberrante de las cinasas del estrés (JNK, IKK y PKR) que fosforilan al receptor de insulina substrato 1 (RI1) produciendo fosfoserina (pSer) que causa la inhibición de RI1 y el consecuente bloqueo del receptor de insulina (RI). La activación aberrante del receptor NMDA del glutamato ocasionada por los oligómeros de Aβ produce un influjo excesivo de Ca2+, estrés oxidativo, señalización aberrante de expresión de genes y señalización defectuosa de insulina que desencadenan en el deterioro de la memoria. Modificado de De Felice3 y Ferreira7. 5. Implicaciones terapéuticas Actualmente existe una necesidad urgente de encontrar nuevas formas de tratamiento de la EA. Las terapias actuales son moderadamente eficaces en el tratamiento de los síntomas y no alteran significativamente el curso de la enfermedad. A través de los años, una serie de estudios epidemiológicos y experimentales han demostrado interacciones entre la DM y la EA. Dado que ambas enfermedades son las principales causas de morbilidad y mortalidad en personas de edad avanzada, se ha planteado la posibilidad de que el tratamiento de la DM podría ser eficaz para frenar la EA.21 Es posible modificar el riesgo de desarrollar deterioro cognitivo leve o EA mediante el suministro de tratamientos que responden a la resistencia y deficiencia de insulina e IGF, (insulina intranasal, incretinas y agentes sensibilizadores de la insulina). Sin embargo, se requiere la aplicación de terapéuticas multimodales en lugar de estrategias diagnósticas y terapéuticas unimodales para el tratamiento de la EA.17 La hiperglucemia y la hipoglucemia en el SNC son el resultado de la desregulación de múltiples cascadas de señalización extracelulares e intracelulares, que a su vez podrían conducir a una disminución en la función neuronal y sináptica que conduce a la pérdida neuronal. Los AβOs son toxinas que desempeñan un importante papel en la interrupción de la señalización de la insulina del cerebro mediante mecanismos proinflamatorios similares a los que ocurren en la DM a nivel periférico. La disfunción sináptica podría contrarrestarse con la estimulación de la señalización de la insulina. Se puede utilizar el suministro de insulina o antidiabéticos, tales como los agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1), dado que activan vías comunes de señalización y facilitan la plasticidad sináptica del hipocampo.36 En algunos análisis post mortem se ha encontrado evidencia de resistencia a la insulina en cerebros afectados por la EA. El interés en la insulina como una terapia potencial para la EA se debe a la existencia de una serie de estudios clínicos que indican que las personas con DM2 tienen un elevado riesgo de deterioro cognitivo leve y de padecer la EA. Los principales métodos para el tratamiento con insulina son la infusión intravenosa, la administración intranasal y el uso de sensibilizadores. Estos métodos han provocado resultados variables en relación a la mejora de la función cognitiva. Los estudios que utilizan la insulina intravenosa proporcionan una base para la comprensión de los efectos cognitivos de ésta, pero no es un método viable de tratamiento en el futuro, debido a los efectos secundarios potenciales, como la hipoglucemia. Los sensibilizadores de insulina también han demostrado tener éxito sólo en estudios pequeños. La insulina intranasal parece ser el método más promisorio debido a los resultados positivos de varios estudios clínicos y a la facilidad de uso. Sin embargo, se deben realizar estudios adicionales para demostrar aún más los efectos de la insulina intranasal antes de que pueda ser consideradao como una terapia efectiva para la EA.2 Varios ensayos clínicos han demostrado que la insulina intranasal mejora el rendimiento de la memoria y la integridad metabólica del cerebro en pacientes que sufren de EA. Estos resultados, junto con el hallazgo de que la insulina mitiga la vulnerabilidad de la sinapsis del hipocampo al Aβ, brindan una sólida justificación para el uso de estrategias farmacológicas que refuercen la señalización de la insulina en el cerebro, por lo que la administración intranasal de insulina podría tener un potencial para el tratamiento y la prevención de la EA.43 La DM es considerada un factor de riesgo para la EA, sin embargo aún no se comprenden en su totalidad los mecanismos moleculares subyacentes a dicha relación. Se ha incrementado el número de estudios donde se muestra la hipótesis de que la EA es una enfermedad de naturaleza metabólica similar a la de la DM por lo que algunos autores la denominan diabetes mellitus tipo 3. La alteración de la insulina y la señalización de IGF están asociados a la pérdida neuronal de la EA, la desconexión sináptica, hiperfosforilación de tau y la acumulación de Aβ, así como al deterioro del metabolismo de la energía. Estudios más recientes muestran el vínculo de la EA con la DM2 mediante la inflamación, resistencia a la insulina y disfunción mitocondrial. La disfunción neuronal de la EA parece ser el resultado de procesos inflamatorios sistémicos que ocurren a lo largo de la vida. La inflamación a nivel periférico y la resistencia a la insulina pueden estar ligados con el surgimiento de la EA. Los malos hábitos alimenticios aunados a la falta de ejercicio predisponen a la población a padecer trastornos metabólicos como la obesidad y DM2 así como al posible desarrollo de la EA por lo que un estilo de vida saludable junto con el control de los niveles de glucosa podrían prevenir el desarrollo de la EA. La posibilidad de que los pacientes con DM2 podrían estar en mayor riesgo de desarrollar EA tiene implicaciones sociales graves, debido al incremento de la incidencia de la DM a nivel mundial y a los altos costos que genera el tratamiento de ambas enfermedades.
Centro de Investigaciones Cerebrales, Universidad Veracruzana. Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada. 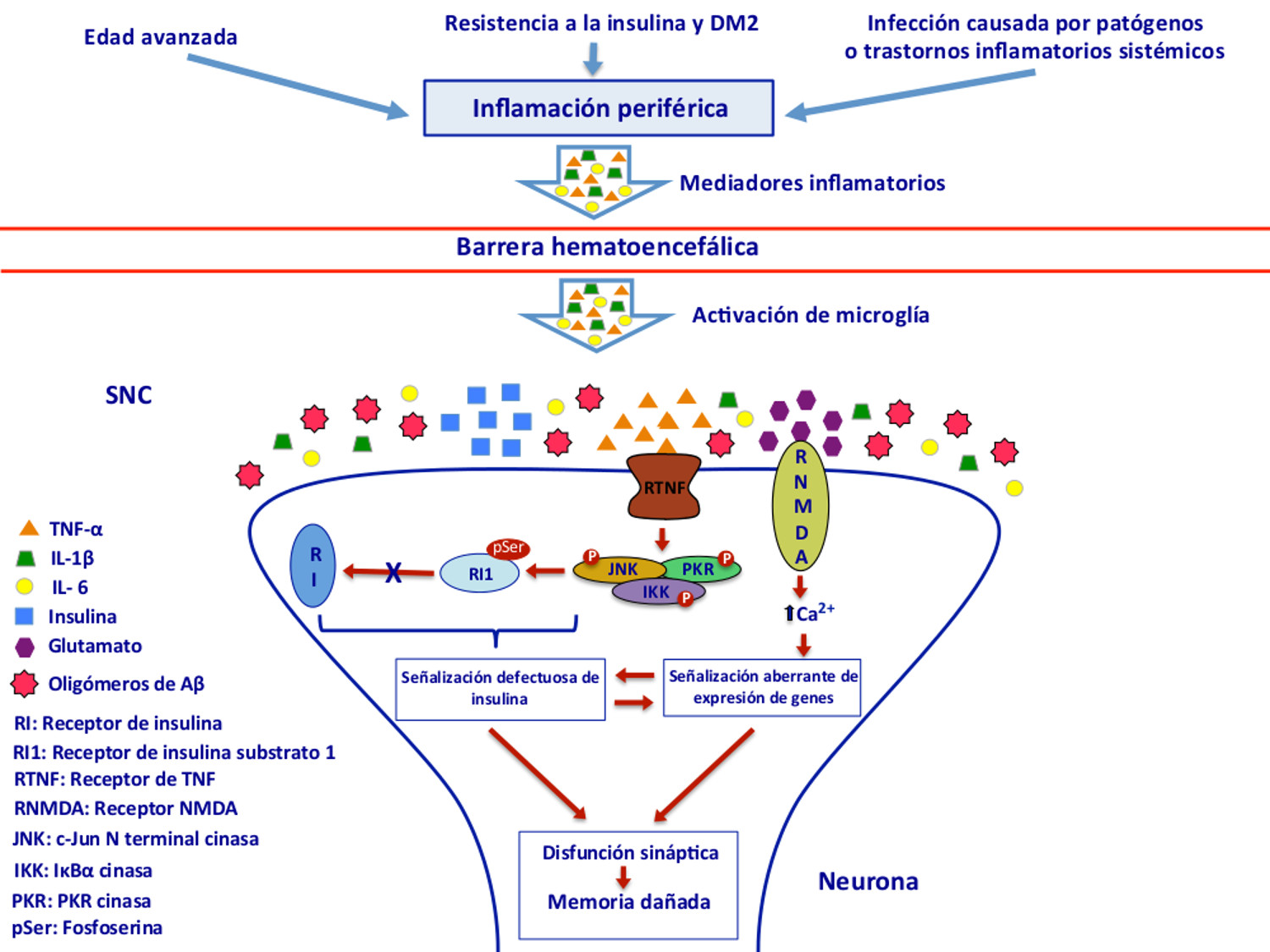
Es de gran importancia detectar la EA en una etapa temprana para poder efectuar un monitoreo y tratamiento efectivo. Una detección temprana podría incluir análisis clínicos, de neuroimagen y bioquímicos así como biomarcadores moleculares. La relación entre la EA y la DM está dando pie al desarrollo de nuevas dianas terapéuticas en el tratamiento de la EA que podrían resultar promisorias para detener el avance de la enfermedad.
Recibido: 28 de enero de 2014
Aceptado: 07 de septiembre de 2014
Centro de Investigaciones Cerebrales, Universidad Veracruzana, Av. Luis Castelazo Ayala, Col. Industrial Animas, Xalapa, Ver. C.P. 91190 email: garanda@uv.mx
