Desarrollo de la discriminación a los sabores
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Artículo de Revisión
Lorena Rubio-Navarro*, Carmen Torrero, Mirelta Regalado y Manuel Salas
Departamento de Neurobiología del Desarrollo y Neurofisiología. Instituto de Neurobiología, Universidad Nacional Autónoma de México, UNAM Campus Juriquilla, Querétaro, Qro.
Resumen/Abstract
Introducción
Conclusiones
Agradecimientos
Referencias
Correspondencia
Los estilos de vida actuales se caracterizan por poca actividad física y mala alimentación crónica la cual programa, el síndrome metabólico y sus consecuencias a largo plazo (hipertensión, diabetes y enfermedades neurodegenerativas). La tendencia actual para su tratamiento involucra entre otros el conocimiento cada vez más amplio sobre la fisiología de los sistemas sensoriales implicados y los hábitos alimentarios. En este trabajo se abordan aspectos generales de la participación del sistema gustativo, la percepción gustativa temprana y cómo influyen sobre las conductas alimentarias y sus repercusiones sobre el estilo de vida en la salud del ser humano.
Palabras clave: Sistema gustativo, Percepción gustativa, Desarrollo cerebral.
The current life-styles program the metabolic syndrome, and a number of diseases such as high blow pressure, diabetes, dyslipidemia or neurodegenerative disorders; the recent trend for treatment involves knowledge about the underlying sensory systems, habits and genetic patterns among others. The present paper discusses the general aspects of the gustatory system, and the fetal uterine experience, subserving taste perception and how they may affect later in life eating behavior and their long-term consequences upon human health.
Key words: Gustatory system, Taste perception, Brain development.
Este trabajo intenta difundir conceptos e información reciente que ayude a reconocer algunos mecanismos de la discriminación gustativa a los sabores desde etapas tempranas del desarrollo, el concepto de aprendizaje temprano a los sabores y su repercusión sobre los hábitos para la nutrición que propician un estado de salud favorable. Por otra parte, entender como la deficiencia crónica de alimento pudiera programar el síndrome metabólico, que se ha convertido en una entidad de alto impacto en la población mundial, ya que éste predispone al desarrollo de enfermedades tipo diabetes, hipertensión, dislipidemia, y desencadenar la enfermedad cardiovascular catastrófica e incapacitante. Por ello, resulta importante rescatar información que nos ayude sobre todo a prevenir el daño a nuestra salud. Sin duda los programas de enseñanza dirigidos a pacientes con factores de riesgo alimentario serán fundamentales para el control de estas enfermedades.
2. Experiencia gustativa en útero
La selección de la ingesta de alimentos depende de varios factores, entre ellos, variaciones fisiológicas, la experiencia, las conductas de ingesta aprendidas, por los efectos que obtiene luego de ingerir los alimentos, e incluso los antecedentes genéticos. Una persona decide si va a comer algo en función de lo que representa para ella el sabor de un alimento, de agrado o desagrado. El sabor es una percepción individual que se genera por la participación del sistema olfativo, el sistema gustativo y el sistema somatosensorial.1
La experiencia gustativa se va acumulando desde que estamos en el vientre materno. Trout y Wetzel-Effinger en 2012 mostraron cómo el olor y el sabor de los componentes de los alimentos que ingiere la madre están presentes en el líquido amniótico. Para comprobarlo tomaron muestras del líquido amniótico de mujeres embarazadas en el segundo trimestre de gestación durante una amniocentesis de rutina. A un grupo se le dio a ingerir cápsulas de ajo, y a otro grupo una cápsula sin olor; evaluadores independientes que desconocían las condiciones experimentales del estudio pudieron identificar el olor de ajo en hisopos que contenían líquido amniótico de las madres que habían ingerido cápsulas de este material, lo que sugiere que lo que ingiere la madre pasa al liquido amniótico.2
Pero ¿Cuándo un feto puede comenzar a percibir olores y sabores? Hay evidencia reciente que muestra que los botones gustativos del feto humano están presentes en el útero alrededor de la semana 13 a 16 de gestación, y las células receptoras olfativas alrededor de la semana 11. Aunado a esto, hay evidencia de que las células receptoras olfativas y gustativas son estimuladas por los componentes químicos que contiene el líquido amniótico entre las semana 26 -28 de gestación.3,4
Otros estudios demuestran que la experiencia adquirida por la asociación a sabores comienza desde etapas tempranas del desarrollo prenatal, tal como lo demostró un estudio realizado con 46 mujeres embarazadas que planeaban lactar a sus hijos, a los cuales a un grupo se les dio a tomar 300 ml de jugo de zanahoria o agua 4 días a la semana por tres semanas consecutivas en el último trimestre de la gestación; otro grupo estuvo formado por madres que durante la gestación no tomaron el jugo de zanahoria, solo durante el periodo de lactancia ingirieron la misma cantidad con la misma frecuencia durante los primeros dos meses de lactancia, y un grupo adicional al que se le dio agua en ambos periodos con la misma frecuencia. Después de cuatro semanas de que las madres comenzaron a introducir alimentos sólidos a sus hijos, se grabaron en video a los infantes mientras comían cereal mezclado con agua o con jugo de zanahoria. Los hijos cuyas madres habían ingerido el jugo de zanahoria durante las últimas etapas de gestación y sin experiencia postnatal previa de la zanahoria, luego de haber comido su cereal de uso común con jugo de zanahoria mostraban mayor aceptación observada a través de su expresión facial (apertura rítmica de la boca y lengüeteos) y cantidad de ingesta, comparado con el grupo de infantes que sólo tomaron agua. Estos últimos, mostraban mayor cantidad de gesticulaciones asociadas a respuestas de rechazo tales como las arrugas en la nariz, fruncimiento de la piel de la frente y giro de la cabeza. El grupo de niños cuyas madres tomaron el jugo de zanahoria durante la lactancia tuvieron resultados similares a los que lo ingirieron durante la gestación.5
Los estudios descritos anteriormente junto a otros han permitido acuñar el concepto de aprendizaje prenatal a los sabores, lo que significa que el sabor de los alimentos de la dieta materna pasa al líquido amniótico que es deglutido por el feto en los últimos días de gestación. Con lo cual éste desarrolla su preferencia hacia aquellos sabores que se ha demostrado persisten en la infancia, y éstos pueden permanecer y fortalecerse hasta la edad adulta. De esta manera la experiencia prenatal puede tener una influencia directa sobre las elecciones de ingesta de alimentos de los adultos. En otras palabras, el bebé puede desarrollar una preferencia por lo que su madre ingiere durante la gestación.
Muchas investigaciones han demostrado que hay diversos factores que contribuyen a la obesidad infantil, entre ellos la poca actividad física, disminución en la ingesta de frutas y verduras así como las grandes porciones de otros alimentos que se ingieren. Sin embargo, los estudios mencionados anteriormente dan pauta para decir que: “la exposición temprana a frutas y vegetales o alimentos altos en energía, azúcar o grasa han sido relacionados con la preferencia de los infantes al consumo de ellos”. Por lo que es importante difundir estos conceptos a la población en general.6
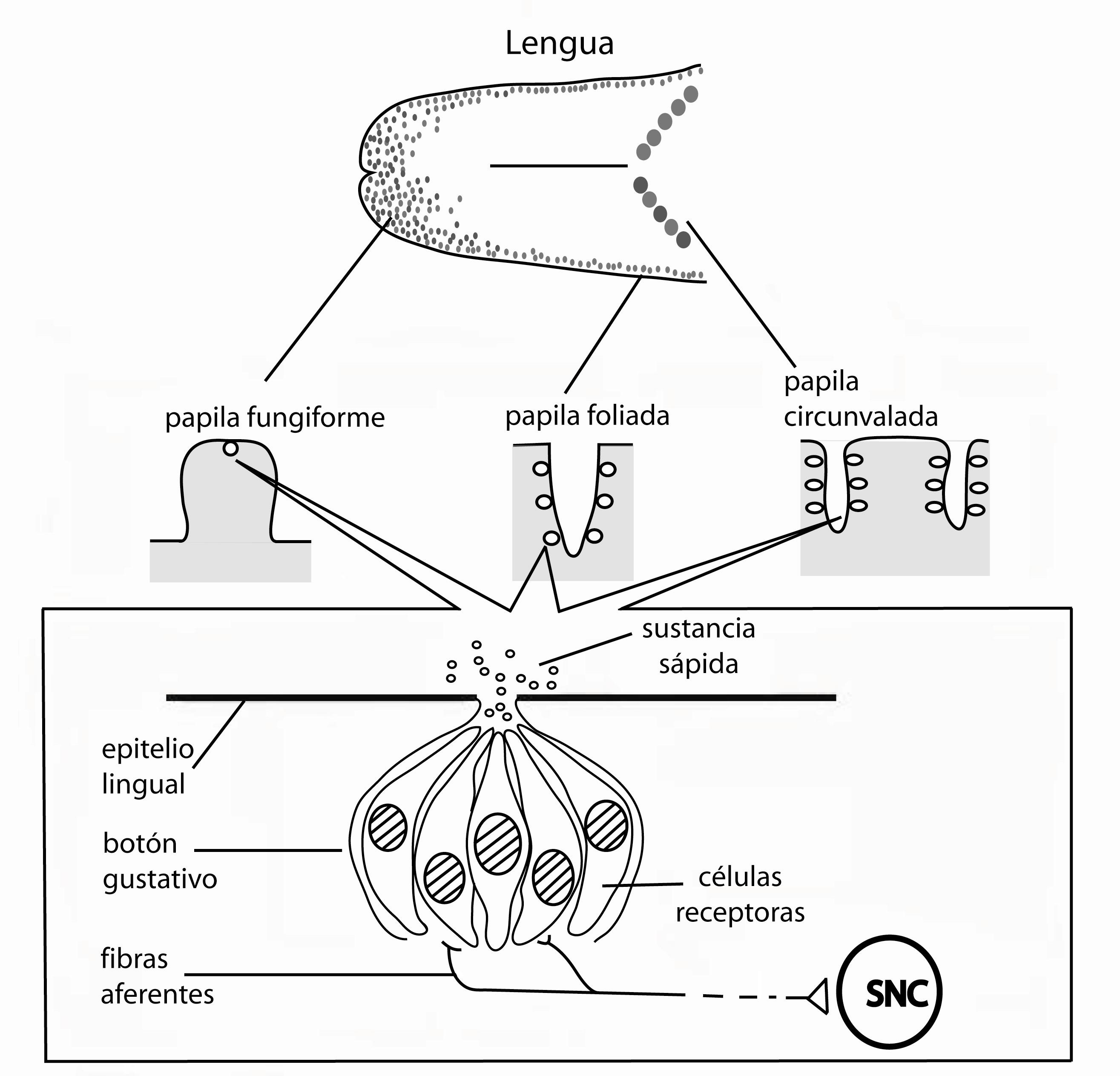
Figura 1. Lengua de un ser humano donde se observa la ubicación de los distintos tipos de papilas, su inervación y cómo están organizados los botones gustativos en ellas.
3. Participación del sistema gustativo en la percepción de los sabores
La percepción de un alimento comienza desde el contacto de éste con receptores gustativos, que están ubicados en la parte superior de las células gustativas, las cuales se hallan agrupadas en racimos de alrededor de 50-100 células formando una estructura conocida como botón gustativo. Los botones gustativos están dispersos en distinta proporción en estructuras visibles a simple vista llamadas papilas gustativas, ubicadas en superficies del epitelio de la lengua, paladar, faringe, laringe y esófago superior. Al observar nuestra lengua al espejo notamos unas pequeñas prominencias en forma de hongo, estas estructuras se llaman papilas fungiformes (fungi: hongo) que contienen un solo botón gustativo estando distribuidas principalmente en la parte anterior de la lengua. Enseguida, encontramos en la parte posterior a las papilas caliciformes o circunvaladas (cáliz: copa) que forman lo que conocemos como “V” lingual. Estas papilas contienen cientos de botones gustativos cada una. En las partes postero-laterales de nuestra lengua encontramos a las papilas foliadas que deben su nombre a la forma de hoja que tienen (folia: hoja) y contienen cientos de botones gustativos en su conjunto (Figura 1).7,8
Cuando las sustancias químicas transportadas con ayuda de la saliva hacen contacto con los receptores gustativos, se desencadena una serie de señales intracelulares que tiene como finalidad segregar sustancias químicas, llamadas neurotransmisores que van a ser reconocidos por las neuronas pertenecientes al nervio facial, glosofaríngeo y vago, que inervan a los botones gustativos y codifican la información que transmiten al cerebro.7
La información gustativa se codifica y se trasmite como patrones de actividad eléctrica organizados en el espacio y en el tiempo, toma varias rutas antes de llegar a la corteza cerebral, zona donde se integra la información de lo que ocurre en nuestra boca, en el sistema olfativo, en el sistema somatosensorial, nuestra memoria gustativa y el estado interno de nuestro organismo. El primer centro de procesamiento de la información, es el núcleo del tracto solitario, ubicado en la parte del tallo cerebral y segregado en la parte posterior e inferior del cerebro. Este centro recibe la información de los botones gustativos de una forma ordenada pero sumamente compleja, la información proveniente de los alimentos que nos gustan o que nos disgustan, llega a este primer núcleo en su porción lateral si son agradables o en la zona medial si son desagradables. De ahí toma diversos caminos, uno de ellos es al mismo nivel del tallo cerebral, a los centros salivatorios para continuar secretando saliva y favoreciendo el contacto de las sustancias químicas contenidas en los alimentos con los receptores gustativos. También viaja a los núcleos motores que controlan los movimientos de la lengua y que permiten el batido, amasamiento y formación del bolo alimenticio, a núcleos motores que controlan los movimientos de los músculos de la cara que permiten las expresiones faciales características de cuando ingerimos algo agradable o desagradable.9,10,11,12,13
En su ruta central ascendente la información gustativa llega al núcleo parabraquial en la parte dorsal del puente. En esta zona del cerebro se integra la información visceral y en sus proyecciones ascendentes al cerebro anterior hay dos principales vías, una llamada vía tálamo cortical donde el núcleo parabraquial envía axones al núcleo ventroposteromedial del tálamo y estas proyectan a la corteza insular o gustativa. Richard y cols. 200514 y Nakashima y cols. 200015 sugieren que esta contribuye al procesamiento cognitivo de discriminación de las distintas características físicas de nuestro alimento, como es el olor, la textura, la forma, la temperatura y el sabor.5,6 La siguiente ruta es la vía ventral al cerebro anterior la cual incluye proyecciones a un vasto número de regiones subcorticales relacionadas con el gusto como el núcleo central de la amígdala, el núcleo de la estría terminalis, el hipotálamo lateral y la sustancia innominada. Esta vía está más involucrada con la evaluación motivacional hedónica del gusto; en particular la amígdala y el hipotálamo codifican información relacionada con el aspecto hedónico de la alimentación (Figura 2).16-18.
Figura 2. Vía gustativa en el cerebro de un ser humano, que ilustra cómo las señales gustativas de la lengua acceden por diferentes nervios a las zonas del tallo cerebral y su ruta hacia la corteza gustativa.
Se ha establecido que los alimentos placenteros elevan los niveles de dopamina estos mecanismos son cruciales para las preferencias de alimentos y el control en la ingesta de los mismos. De acuerdo con la teoría de Berridge19 la recompensa de la comida consta de dos componentes: el “liking” y el “wanting”; el liking se refiere al placer derivado de comer determinado alimento mientras que el wanting se refiere a la motivación apetitiva. Estos compontes tienen correlatos neuronales separados; actualmente se considera importante evaluar el apetito y la palatabilidad de un alimento que genera recompensa, mediados por dopamina. Estos circuitos comienzan a formarse desde la gestación y desde ese momento la exposición a los alimentos altos en calorías, desencadenan la respuesta de recompensa que se establece en la memoria gustativa de los infantes, y que en edades posteriores, motivarán de forma intrínseca la elección de alimentos que pueden desencadenar obesidad o diabetes tipo II en etapas adultas.20 De estudios recientes se sabe que los circuitos cerebrales que participan en el liking se ubican en zonas limitadas que incluyen a la cubierta (shell) del núcleo accumbens, el NPB, la amígdala y el pálido ventral; mientras que los circuitos del wanting ocupan áreas cerebrales más extensas que incluyen al core o núcleo del accumbens, la amígdala, el estriado y la corteza orbitofrontal (Figura 2).19
4. Participación de posibles efectos programados en la percepción gustativa
Hoy día sabemos que no todos percibimos de la misma forma los sabores, ello depende de la densidad de papilas, las diferencias genéticas, la sensibilidad de los receptores gustativos y los componentes de la saliva.21 La gran cantidad de sabores que podemos percibir depende fundamentalmente de la combinación de cinco modalidades básicas de ellos: dulce, amargo, ácido, salado y umami. Teóricamente la percepción del sabor amargo ayuda a prevenir el consumo de toxinas de plantas, alimentos en descomposición y fármacos, produciendo consistentemente respuestas de rechazo o aversión. No obstante, hay alimentos con sabores amargos, que forman parte de nuestra la dieta, como las espinacas, vegetales crucíferos como brócoli, col rizada, coliflor, berros, y arugula entre otros productos de soya que tienen ciertas sustancias químicas con sabor amargo.22
Los vegetales crucíferos contienen compuestos fitoquímicos como isotiocinatos que provienen de glucosinolatos en las verduras crucíferas, así como polifenoles, metilxantinas, isoflavonas y sulfamidas que tienen sabor amargo, y que curiosamente todos estos fitoquímicos nos protegen de ciertas enfermedades.23 El punto a considerar es que hay individuos que perciben estos componentes amargos con mayor agudeza. Hay un receptor gustativo denominado TAS2R38 que es el responsable de percibir el sabor amargo de los siguientes componentes químicos: feniltiocarbamida, propiltiouracilo (PROP) y a tiocianatos, compuestos amargos encontrados en vegetales como la col de Bruselas y el brócoli. Alrededor del 75% de los seres humanos describen al PROP como amargo y se clasifican como “tasters” (palabra que podríamos traducir como: catadores). El resto de la población no describe sabor alguno cuando se aplica PROP y por ello se consideran como “nontasters” (no catadores). Lo anterior muestra que hay diferencias en la percepción de los sabores. La explicación que se da es que las personas que tienen incremento en la percepción a los sabores amargos puedan tener una agudeza general del sentido del gusto. Varios estudios han establecido una correlación entre el incremento de la sensibilidad por los sabores amargos, y el aumento de la respuesta a los sabores dulces, estímulos salados y una sensibilidad incrementada a las señales olfativas; y lo más interesante a sustancias viscosas y espesas como las grasas.24-26 Otros trabajos han mostrado claramente, que los individuos que poseen una percepción aumentada por el sabor amargo tienden a evitar ciertos alimentos entre ellos frutas y vegetales.27
Actualmente aumentan los estudios que sugieren que la grasa es una modalidad gustativa distinta, que media sus efectos a través de un trasportador de ácidos grasos denominado CD36, el cual funciona como un posible receptor gustativo para el sabor de las grasa, en otros reportes se ha propuesto que el CD36 es un sensor oral para los lípidos.27,28,10 Este receptor CD36 es una proteína integral de membrana que tiene alta afinidad por ácidos grasos de cadena larga insaturados, que facilita su trasporte a través de las membranas celulares.28,29 Desde una perspectiva evolutiva aun controversial, se ha propuesto que la percepción del sabor de las grasas pudiera estar relacionada con la detección de alimentos con alto contenido energético, de vitaminas solubles en grasas y de ácidos grasos esenciales.3 Los estudios que proponen la existencia y función de esta nueva modalidad gustativa provienen de experimentos que indican que los ratones knockout con supresión del gen CD36, versus los sujetos silvestres pierden la habilidad para distinguir los ácidos grasos.30 Esta capacidad parece ser específica para las grasas, ya que los animales mantienen sus preferencias por el sabor dulce y la aversión por lo amargo. Incluso considerando que la percepción de las grasa está fuertemente determinada por su textura, en el ratón CD36 sin experiencia a las grasas, comparados con ratones silvestres que eligen soluciones de ácidos grasos sobre un vehículo con goma, indicando que CD36 se requiere para distinguir estas textura. El papel de CD36 sobre el sabor de las grasas en seres humanos aun se desconoce, si hay variación en CD36 esto puede afectar la habilidad para percibir el sabor de las grasas, lo que puede resultar en otra variación en la preferencia por alimentos grasos.
5. Efectos de la desnutrición sobre la percepción gustativa
Los modelos animales han sido de una gran utilidad para demostrar los efectos nocivos de factores epigenéticos como la desnutrición, en estructuras que forman parte de la vía gustativa del sistema nervioso central (SNC) involucradas en la integración de la información gustativa. La rata es un buen modelo para el estudio del sistema gustativo, ya que depende de éste para elegir lo que debe ingerir para mantener su supervivencia ambiental de lo que le es tóxico. Adicionalmente, la rata recién nacida sin experiencia previa tiene reflejos gustofaciales que son fácilmente inducibles e identificados, las vías que subyacen la integración gustativa son relativamente equivalentes, así como los receptores gustativos.
Estudios previos muestran que estímulos gustativos como la sacarosa y la quinina inducen la activación de neuronas, en particular, en la porción rostral del núcleo del tracto solitario (NTS) en ratas de 5, 15 y 25 días de edad. El estudio sugiere que en la etapa de transición entre la alimentación líquida (leche) y sólida (pellets), específicamente la edad de 15 días muestra una zona de actividad neuronal en el NTS, que se reduce en la edad de 25 días mostrando un patrón similar al del adulto. La sacarosa induce mayor expresión en zonas laterales del núcleo mientras que la quinina lo hace en zonas mediales del mismo. Estos resultados nos dan detalle del desarrollo en etapas tempranas del substrato neuroanatómico que subyace a la conducta de ingesta de alimentos.10
La desnutrición perinatal (DNP) tiene efectos negativos en la integración de la información aferente de estructuras que participan en la transmisión de señales gustativas hacia la corteza cerebral. Así en crías con DPN que descienden de madres gestantes alimentadas con 50% de la dieta del día de gestación; 6 al 12, y con 60% del día 13 al 21; y que después del parto, continúan con la desnutrición utilizando un par de madres lactantes, una de ellas ligada de sus conductos galactóforos e intercambiadas cada 12 h, se ha observado un efecto de hipoplasia neuronal (técnica de Golgi-Cox) en el NTS, en núcleo motor de facial y la corteza insular. Recordemos que el sistema gustativo en las crías de especies altriciales es vital, ya que son muy inmaduras al nacer, pese a su inmadurez el substrato neuronal y la capacidad para discriminar entre un sabor amargo y un sabor dulce, así como la inducción de los reflejos gustofaciales por estos estímulos están operando desde el nacimiento. El NTS es el primer relevo de la vía gustativa que está formado por neuronas de tipo bipolar, multipolar y ovoide (pequeñas y grandes). La DNP reduce el número y extensión de las dendritas distales particularmente en neuronas pequeñas, que se sugiere son interneuronas (neuronas locales que no proyectan al siguiente relevo de la vía). Los datos indican que la DPN interfiere con la organización de los árboles dendríticos de las neuronas multipolares y ovoides pequeñas, posiblemente modificando el proceso de integración de los códigos sensoriales para la discriminación de los sabores.10
El núcleo facial (NF) regula la contracción de músculos durante el reflejo de succión, al nacer, y durante el desarrollo madura y favorece la expresión de otras funciones como beber, succionar y deglutir alimento. El NF está formado por neuronas bipolares, triangulares, estrelladas y multipolares que se generan entre los días de gestación 12 a 15. La DNP causa hipoplasia dendrítica, tanto es su arborización como en la extensión, con poco efecto sobre el tamaño del soma. Estas alteraciones morfológicas están asociadas con deficiencias en el reflejo de succión lo cual interfiere con la conducta de alimentación del recién nacido. Así mismo, estas alteraciones pueden estar asociadas con cambios en la integración de señales aferentes (fibras que llevan la información hacia núcleos del SNC), y modificar el patrón de descarga de las motoneuronas del NF que modulan parcialmente la contracción de músculos bucolabiales durante los movimientos de succión y la expresión facial en respuesta a señales gustativas.11,31,32
Estudios recientes muestran que el reflejo gustofacial también se altera por la desnutrición, cuando aplicamos una gota de sacarosa o quinina sobre el dorso de la lengua se inducen los reflejos gustofaciales en la rata recién nacida. En ratas con DNP se observa que la aplicación de quinina provoca un incremento en la frecuencia de apertura de boca y la reducción de lamidos de labios, mientras que la aplicación de sacarosa produce un incremento tanto en la apertura de boca como en el lamido de labios, lo que nos indica que la DNP afecta de forma muy clara la expresión de estos reflejos, probablemente porque interfiere con los componentes neuronales básicos, el NTSr y el NF que son relevos en la vía gustativa y motora respectivamente necesarios para producir los reflejos gustofaciales, lo cual en términos generales influye no sólo en la respuesta refleja sino también en el aprendizaje temprano a los sabores y la formación de circuitos de aspectos hedónicos de las señales gustativas.13
Ya mencionábamos que en la percepción del sabor de un alimento participa en gran medida el sistema olfativo. La DNP también tiene efectos nocivos sobre estas estructuras que detectan las señales químicas volátiles de los alimentos, además de que participan al establecer vínculos maternales a través de las feromonas que desprende la madre alrededor del área de los pezones para que la cría se pueda guiar y encontrar fácilmente la fuente de alimento. Los efectos que se han descrito en esta área son reducción en el área del bulbo olfatorio y en el glomérulo olfatorio, la DNP reduce el área del bulbo olfatorio y las capas del glomérulo olfativo, las células mitrales también disminuyen su número y extensión dendrítica. A pesar de que las macroneuronas que forman parte de esta estructura, la DNP tiene efectos a largo plazo que interfieren con la madurez funcional del bulbo olfatorio, esto puede tener consecuencias relevantes para la discriminación temprana a los olores, y por lo tanto afectar de forma indirecta los mecanismos que permiten discriminar señales olfatorias que faciliten el acceso a la fuente de alimento y la discriminación entre los sabores, aunque es una propuesta que deberá de probarse.33-35
Los efectos de la DNP no se restringen solo a áreas de tallo cerebral o del bulbo olfatorio, incluso en áreas corticales, como la corteza insular, que en la rata es el área principal de convergencia e integración de la información olfativa y gustativa, estudios recientes muestran que incluso en este nivel cortical la arborización y extensión dendrítica de las neuronas que forman esta área también se encuentra disminuida. Estos hallazgos sugieren un posible mecanismo de perturbación en procesos complejos de la percepción gustativa así como de la respuesta hedónica a los sabores.
Desde una perspectiva de desarrollo, hemos visto que las variaciones fenotípicas de las neuronas de la vía gustativa interactúan estrechamente con aspectos ambientales para producir cierta predisposición por preferencias a los alimentos; esta predisposición incluye la agudeza individual a ciertos sabores, a la textura y la viscosidad de algunos alimentos; así como reacciones reflejas a sabores básicos como la aceptación a lo dulce y rechazo por sabores agrios o amargos. Otras predisposiciones incluyen el aprendizaje temprano a los sabores que se establece desde el útero a través del líquido amniótico, y continúa con el periodo de la lactancia a través de la leche. No obstante que el ambiente y los hábitos de alimentación sana que le brindamos a nuestra familia sean los más satisfactorios para el desarrollo de las capacidades intelectuales, sin embargo, estos lamentablemente concurren con un contexto social desfavorable de pobreza que obliga a la población Mexicana al consumo de chatarra, y a malos hábitos de alimentación que podrán hacer perennes el sobrepeso y la obesidad.
Hace miles de años en la historia de la humanidad cuando los alimentos, especialmente los alimentos altos en densidad energética eran relativamente escasos, el ser humano tenía como ventaja esta función adaptativa de magra alimentación ya que favorecía su supervivencia. Sin embargo, en la actualidad los alimentos altamente energéticos, ricos en azúcar, grasa y sal están a libre disponibilidad, son muy económicos y la población con bajos salarios tiene acceso frecuente, inmediato y fácil a ellos. Este análisis permite sugerir que, dado que las preferencias por los alimentos son aprendidas y modificables fundamentalmente en las etapas tempranas del desarrollo, es también la oportunidad de fomentar patrones de preferencia consistentes con dietas saludables. La sugerencia basada en los argumentos anteriores, sobre la predisposición del ser humano desnutrido en etapas tempranas de la vida a la programación de enfermedades metabólicas y neurodegenerativas, tiene la intención de proporcionar información que permita prevenir y establecer ambientes para la alimentación, que fomenten hábitos saludables.
La preparación de este artículo fue parcialmente apoyada por la Dirección General de Asuntos del Personal Académico de la UNAM (DGAPA), proyecto IN207310-3.
- Miranda-Saucedo MI. "El sabor de los recuerdos: formación de la memoria gustativa" Revista Digital Universitaria 2011 12:3.
- Trout KK, Wetzel-Effinger L. Flavor learning in utero and its implications for future obesity and diabetes. Curr Diabetes Rep 2012 12: 60-66.
- Blackburn ST. Maternal, Fetal and Neonatal Physiology: A Clinical Perspective. 3th ed. Missouri 2007 pp 768.
- Briefel RR, Reidy K, Karwe V, Jankowski L, Hendricks K. Toddlers´ transition to table foods: Impact on nutrient intakes and food patterns. J Am Diet Assoc 2004 104: 38-44.
- Mennella JA, JAgnow CP, Beauchamp GK. Prenatal and postural flavor learning by human infants. Pediatrics 2001 107: 88.
- akashima M, Uemura M, Yasui K, Ozaki HS, Tabata S, Taen A. An anterograde and retrograde tract-tracing study on the projections from the thalamic gustatory area in the rat: distribution of neurons projecting to the insular cortex and amygdaloid complex. Neurosci Res 2000 36: 297–309.
- Carleton A, Accolla R, Simon SA. Coding in the mammalian gustatory system. Trends Neurosci 2010 33: 326-334.
- Chandrashekar J, Hoon MA, Ryba NJ, Zuker CS. The receptors and cells for mammalian taste. Nature 2006 444: 288-294.
- Fontanini A, Grossman SE, Figueroa JA, Katz DB. Distinct subtypes of basolateral amygdale taste neurons reflect palatability and reward. J Neurosci 2009 29: 2486-2495.
- Rubio L, Torrero C, Regalado M, Salas M. Alterations in the solitary tract nucleus of the rat following perinatal food restriction and subsequent nutritional rehabilitation. Nutr Neurosci 2004 7: 291-300.
- Torrero C, Regalado M, Rubio L, Ruiz-Marcos A, Salas M. Neonatal food restriction induces hypoplasia in developing facial motor neurons of rats. Nutr Neurosci 2003 6: 317-324.
- Salas M, Torrero C, Regalado M, Rubio L. Development of the gusto facial reflex in perinatally undernourished rats. J Behav Brain Sci 2012 2: 308-314.
- Frias C, Torrero C, Regalado M, Salas M. Development of mitral cells and olfactory bulb layers in neonatally undernourished rats. Nutr Neurosci 2009 12: 96-104.
- Richard S, Engblom D, Paues J, Mackerlova L, Blomqvist A. Activation of the parabrachio-amygdaloid pathway by immune challenge or spinal nociceptive input: a quantitative study in the rat using Fos immunohistochemistry and retrograde tract tracing. J Comp Neurol 2005 481: 210–219.
- Nakashima M, Uemura M, Yasui K, Ozaki HS, Tabata S, Taen A. An anterograde and retrograde tract-tracing study on the projections from the thalamic gustatory area in the rat: distribution of neurons projecting to the insular cortex and amygdaloid complex. Neurosci Res 2000 36: 297–309.
- Karimnamazi H, Travers JB. Differential projections from gustatory responsive regions of the parabrachial nucleus to the medulla and forebrain. Brain Res 1998 813: 283–302.
- Fontanini A, Grossman SE, Figueroa JA, Katz DB. Distinct subtypes of basolateral amygdale taste neurons reflect palatability and reward. J Neurosci 2009 29: 2486-2495.
- Garcia-Bailo B, Toguri C, Eny MK, El-Sohemy A. Genetic variation in taste and its influence on food selection. OMICS 2009 13: 69-80.
- Berridge KC. ‘Liking’ and ‘wanting’ food rewards: Brain substrates and roles in eating disorders. Physiol Behav 2009 97: 537-550.
- Grimm RE, Steinle N. Genetic of eating behavior: established and emerging concepts. Nutr Rev 2011 69: 52-60.
- Duffy CV, Bartoshuk LM. Food acceptance and genetic variation in taste. J Am Diet Assoc 2000 100: 647-655.
- El-Sohemy A, Stewart L, Khataan N, Fontaine-Bisson B, Kwong P, Ozsungur S, Cornelis MC. Nutrigenomics of taste-impact on food preference and food production. Forum Nutr 2007 60: 176-182.
- Pickering GJ, Haverstock G, DiBattista D. Evidence that sensitivity to 6-n-propuylthiouracil (PROP) affects perception of retro-nasal aroma intensity. J Food Agric Environ 2006 4: 15-22.
- Kim UK, Jorgenson E, Coon H, Leppert M, Rish N, Drayna D. Positional cloning of the human quantitative trait locus underlying taste sensitivity to phenylthiocarbamide. Science 2003 299: 1221-1225.
- Drewnowski A, Henderson SA, Shore AB, Barratt-Fornell A. Nontaster, tasters, and supertasters of 6-n-propylthiouracil (PROP) and hedonic response to sweet. Physiol Behav 1997 62: 649-655.
- Laugerette F, Passilly-Degrace P, Patris B, Niot I, Febbraio M, Montmayeur JP, Besnard P. CD36 involvement in orosensory detection of dietary lipids, spontaneous fat preference, and digestive secretions. J Clin Invest 2005 115: 3177-3184.
- Harmon CM, Abumrad NA. Binding of sulfosuccinimidyl fatty acids to adipocyte membrane proteins: isolations an amino-terminal sequence of and 88-kD protein implicated in transport of long–chain fatty acids. J Membrane Biol 1993 133: 43-49.
- Hajnal A, Nogren R, Kovacs P. Parabrachial coding of sapid sucrose: relevance to reward and obesity. Ann N Y Acad Sci 2009 1170: 347-364.
- Laugrette F, Gaillard D, Passilly-Degrace P, Niot I, Besnard P. Do we taste fat?. Biochimie 2007 89: 265-269.
- Baillie AG, Coburn CT, Abumrad NA. Reversible binding of long-chain fatty acids to purified FAT, the adipose CD36 homolog. J Membrane Biol 1996 153: 75-81.
- Perez-Torrero E, Torrero C, Salas M. Effects of perinatal undernourishment on neuronal development of the facial motor nucleus in the rat. Brain Res 2001 905: 54-62.
- Pérez-Torrero E, Torrero C, Salas M. Neonatal nutritional rehabilitation of morphological features in facial motoneurons altered by prenatally food deprivation in the rat. Nutr Neurosci 2002 5: 263-268.
- Frias C, Torrero C, Regalado M, Salas M. Organization of olfactory glomeruli in neonatally undernourished rats. Nutr Neurosci 2006 9: 49-55.
- Carreon MG, Torrero C, Regalado M, Rubio L, Salas M. Olfactory discrimination in adult male rats undernourished during the pre- and neonatal period. J Behav Brain Sci 2012 2: 283-290.
- Salas M, Torrero C, Rubio L, Regalado M. Effects of perinatal undernutrition on the development of neurons of the insular cortex. Nutr Neurosci 2012 15: 20-25.
| Recibido: 18 de septiembre de 2012 | Aceptado: 28 de junio de 2013 |
Correspondencia:
Correspondencia: Departamento de Neurobiología del Desarrollo y Neurofisiología. Instituto de Neurobiología, Universidad Nacional Autónoma de México, UNAM Campus Juriquilla, Querétaro, Qro.Boulevard Juriquilla 3001, Querétaro, 76230, Tel 4422381059, lrubio_navarro@hotmail.com
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
