El Trastorno Bipolar: ¿Un trastorno de la regulación circadiana?
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Artículo de Revisión
Bipolar Disorder: A disorder of circadian regulation?
E. Tarragón y M. Miquel
Área de Psicobiología. Universidad Jaume I. Castellón. España.
Resumen/Abstract
Introducción
Discusión y Conclusiones
Referencias
Correspondencia
Dentro de los llamados trastornos del estado de ánimo, el trastorno bipolar ha sido poco estudiado, a pesar de su prevalencia y el grado de incapacidad que produce en la población. Para comprender adecuadamente los factores causales de un trastorno es necesaria la investigación básica. Sin embargo, la falta de un modelo animal satisfactorio en el caso del trastorno bipolar dificulta el progreso en el conocimiento de sus bases neurobiológicas. Esta revisión pretende aunar las recientes aportaciones realizadas en referencia al trastorno bipolar, y aportar así una visión de conjunto que ayude a esclarecer la línea causal, partiendo del nivel más básico: el componente genético subyacente. En concreto, este trabajo presenta evidencia sobre los avances obtenidos gracias a modelos animales de ratones mutantes de genes implicados en la regulación de los ritmos circadianos, foco actual de la hipótesis etiopatogénica del trastorno bipolar.
Palabras clave: Trastorno bipolar, Neurobiología, Ritmos biológicos, Modelos animales.
Despite its prevalence and degree of disability, bipolar disorder has not received the attention it deserves within the so-called mood disorders. To properly understand the factors associated with its origin, basic research is needed. However, the lack of a satisfactory animal model hinders progress in understanding the neurobiological basis that gains importance in explaining this condition. This review, therefore, aims to combine the recent contributions about bipolar disorder, and thus provide an overview to help clarify the causal line, starting from the most basic level: the underlying genetic component. Specifically, this paper presents evidence on the progress achieved with animal models of mutant mice of genes involved in regulating circadian rhythms, current focus of etiopathogenic hypothesis of bipolar disorder.
Key words: Bipolar disorder, Neurobiology, Biological rhythms, Animal models.
Hace diez años de la última actualización del Manual de Diagnóstico de los Trastornos Mentales.1 A la espera de la nueva versión, su utilización sigue siendo de carácter general entre la mayoría de los clínicos. Sin embargo, el avance en la investigación clínica y neurobiológica acerca de los orígenes y características de las enfermedades mentales pone de manifiesto las dificultades del enfoque categorial que sustenta esta herramienta.2 Esta revisión, atendiendo a la información, datos e interpretaciones más actuales acerca de las bases neurobiológicas del trastorno bipolar, intentará aportar claridad sobre varios aspectos que pudieran servir como guía a la hora de adentrarse en el origen de este trastorno.
El Trastorno bipolar es un trastorno incluido en el grupo de trastornos del estado de ánimo, caracterizado por un patrón de alteración recidivante en el que se alternan fases de manía y depresión. Actualmente, siguiendo los criterios descritos en el DSM-IV-TR, su diagnóstico distingue dos variantes principales. Se considera Trastorno bipolar tipo I cuando, habiendo presentado un episodio depresivo previo, el sujeto se encuentra en un estado de manía; o bien, cuando la persona con historia de episodio maníaco se encuentra en una fase depresiva. Por su parte, el Trastorno bipolar tipo II se aplica únicamente cuando se ha presentado previamente un episodio depresivo o hipomaníaco, pero no de manía.1
Típicamente, la aparición del primer episodio suele darse al final de la adolescencia, afectando el tipo II más a mujeres y el tipo I igual a ambos sexos.1 Ambos tipos de perfil suman conjuntamente una prevalencia en la población general de un 2,7%, similar a la observada en la esquizofrenia. La diferencia entre ambas psicosis, no obstante, es que el acuerdo acerca del origen de la esquizofrenia es mucho mayor que el que existe para el trastorno bipolar. Mientras que para la esquizofrenia existen hoy modelos neuropsicobiológicos de etiopatogenia bien establecidos y aceptados globalmente, la explicación para el trastorno bipolar sigue siendo difusa.3-8
Durante los últimos cincuenta años, la hipótesis predominante sobre la causa de los trastornos del ánimo ha sido el desequilibrio neuroquímico, particularmente de los sistemas monoaminérgicos. Lo que en un principio fuera adoptado con escepticismo, se ha convertido en evidencia aceptada por científicos y población general. Sin embargo, con el paso de los años, se ha redirigido el foco de atención hacia receptores, vías intracelulares y modificaciones genéticas y epigenéticas que ofrecen una visión mucho más compleja de las alteraciones moleculares subyacentes a los trastornos del ánimo. El mapa de dichas alteraciones sitúa a estos trastornos como trastornos de los mecanismos de neuroplasticidad y sugiere que se requieren nuevos modelos explicativos para poder entender las causas de la depresión unipolar y del trastorno bipolar. Una de las hipótesis actuales más recurridas al respecto es la hipótesis de las redes neuronales.10 Esta propuesta sugiere para la etiopatogenia de los trastornos afectivos perturbaciones en la configuración de las redes neuronales que controlan y regulan los procesos afectivos. De este modo, las funciones cerebrales de las que dichas redes se encargan se ven alteradas. No obstante, dado que su remodelación está sometida a las interacciones con el ambiente mediante procesos de neuroplasticidad, pueden ser reconfiguradas en alguna medida por las terapias conductuales y farmacológicas.
Otra aproximación novedosa y más específica a la etiopatogenia bipolar es la propuesta por Berns y Nemerof.9 Estos autores realizan un símil entre la sintomatología bipolar y ciertos elementos adoptados de las teorías de la complejidad. Uno de los conceptos introducidos por estas teorías es el de atractor (Lorenz, 1976, 1996). Según la ciencia del caos y la dinámica de sistemas, un atractor es un conjunto de estados al que otros estados cercanos se aproximan de forma asimétrica durante el curso de una evolución dinámica, considerando los puntos desde los que parte y los puntos que cada uno de estos estados puede alcanzar. Teniendo esto en cuenta, se puede establecer una analogía y definir como atractores a los estados depresivo y maníaco que se observan en un trastorno bipolar. En este sentido, los pacientes con trastorno bipolar alternan de manera frecuente la depresión y la manía durante largos periodos de tiempo, sin pasar por un estado eutímico (ánimo normal). Más adelante se expondrá cómo el salto de un estado a otro parece estar relacionado con la actividad de ciertos genes y sistemas subyacentes a la regulación cíclica del organismo.
2. Alteraciones estructurales y funcionales en el Trastorno Bipolar.
Dos de los primeros autores en relacionar el trastorno bipolar con una causa biológica fueron Cummings y Mendez,11 quienes observaron que ciertas lesiones cerebrales producidas por tumores, embolias o traumatismo craneal derivaban en comportamientos de tipo maníaco. Se ha observado que lesiones que resultan en este tipo de comportamientos se producen principalmente en las áreas frontal y temporal de la corteza, así como debido a cierto daño subcortical que afecta al tálamo y la cabeza del núcleo caudado.12
Estudios de volumetría han aportado resultados interesantes sobre el trastorno bipolar. Como recientemente revisaron Strakowski y colaboradores,13,14 tanto la depresión unipolar como bipolar son asociadas con un volumen inferior del lóbulo prefrontal, al que se esperaría en un sujeto normal. Por contra, tanto los ganglios basales como el tálamo se ven aumentados en los pacientes bipolares.13,15 También existe evidencia acerca de un aumento en el volumen del hipocampo y la amígdala.16,17 No obstante, los resultados de estudios morfológicos no parecen delimitar una línea clara entre ambos trastornos,14,18 ya que los datos de pacientes bipolares son muy similares a los presentados en los estudios de pacientes con depresión.18 Sin embargo, los estudios de metabolismo cortical prefrontal apoyan la idea de diferencias funcionales con las depresiones unipolares. Se ha observado que en comparación con sujetos con trastorno unipolar, los pacientes con trastorno bipolar muestran un metabolismo cortical significativamente menor.19-21
3. Mecanismos moleculares implicados en el Trastorno Bipolar.
Resultados obtenidos por estudios postmortem muestran un incremento de la expresión de los elementos transcriptores del ARNm para la subunidad de transcripción gluR1 de los receptores AMPA en el estriado de pacientes bipolares, así como en el elemento de unión [3H]AMPA.22 Del mismo modo, se han detectado numerosas anormalidades bioquímicas durante la medición de los metabolitos de ciertos neurotransmisores y hormonas.23-25 Sin embargo, a pesar de lo extendido de la idea de que la depresión está principalmente causada por una relativa deficiencia en la actividad de determinados sistemas monoaminérgicos (p. Ej: serotonina, dopamina, norepinefrina), ninguno ha sido claramente implicado en la fisiopatología del trastorno bipolar.26 Muchos antidepresivos que incrementan la actividad de uno o varios de estos sistemas, pueden, de hecho, precipitar la aparición de los episodios maníacos.27,28
De entre las vías de activación intracelular, la referente a la GSK3 ha recibido bastante atención en relación al trastorno bipolar.25 Esta proteinquinasa es la principal encargada de la fosforilación de la ß-catenina, uno de los compuestos responsables de la señal de stop durante la división celular. La fosforilación de esta proteína por parte de GSK3, la marca para su posterior degradación. La inhibición de GSK3 permite que la ß-catenina se mude al núcleo, donde participa en multitud de funciones, entre las que destacan la génesis axónica. Se ha demostrado que el litio, estabilizador del estado de ánimo, inhibe directamente la GSK3 mediante su competición con el ión de Magnesio (Mg2+).29 Además, se ha visto que el tratamiento crónico con litio activa la familia de proteínas Akt/PKB (Proteinquinasas B), la cual actúa igualmente inhibiendo GSK3. Se ha sugerido que la actividad de esta proteína puede verse regulada a la baja por factores de crecimiento.30 El litio es uno de los principales compuestos utilizados en la clínica del trastorno. Es un metal, aunque a nivel clínico se prescribe como una sal (carbonato de litio); su utilidad en el tratamiento y prevención del trastorno bipolar ha sido ampliamente demostrada, y es el fármaco de primera elección desde hace más de diez años.31-33
En la neuroquímica del trastorno bipolar, otro de los elementos estudiados ha sido la vía de transducción de la AMPc/PKA (adenosilmonofosfato cíclico/proteinquinasa A). Se ha observado que el litio ejerce marcados efectos sobre la adenilatociclasa,34 proteína efectora asociada a la activación de esta vía, provocando cambios en la cascada intracelular AMPc/PKA.35 Coherente con esta idea, estudios post mórtem de pacientes bipolares describen un incremento de concentración de la proteína Gα asociada a cAMP en el sistema nervioso central (SNC).36 La convergencia de las vías de señalización de PKA y PKB sobre la GSK3 indica que, según el contexto en que se estimule, la regulación de la actividad de esta sintasa puede darse, bien por factores de crecimiento a través de la cascada de PKB o mediante estimulación hormonal de receptores acoplados a la proteína G, relacionados con cambios en el nivel intracelular de AMPc.30 Igualmente, se ha observado que un sustrato de la PKA, la Rap1, muestra un incremento de la fosforilación en las plaquetas de pacientes bipolares.37 Esta proteína también está implicada en multitud de eventos intracelulares, como la movilización de calcio y la regulación de las señales de cascada asociadas a factores neurotróficos.38
También hay datos que demuestran que las exposiciones agudas a litio parecen facilitar numerosos efectos dependientes de la PKC, por ejemplo, relacionados con la vía de señalización de los grupos fosfoinositido (IP), especialmente sobre el inositol trifosfato (IP3).39,40 Sin embargo, exposiciones crónicas resultan en disminuciones de algunos isoenzimas de esta quinasa, como es el caso del sustrato miristoilado rico en alanina (MARCKS), en el hipocampo.41,42
Más que provocar cambios significativos en la actividad basal celular, parece que el litio atenúa la respuesta de otros neurotransmisores, lo que resultaría coherente con el hecho de que la mayoría de estudios que analizan los niveles de varios de estos sistemas en pacientes bipolares no son concluyentes.
Muchas de las cascadas intracelulares expuestas anteriormente regulan los procesos de neuroplasticidad. De este modo, los estabilizadores del ánimo y algunos fármacos antidepresivos, no limitan su efectividad a la paliación de los síntomas, sino que pueden jugar un papel relevante como agentes neuroprotectores y restauradores de las redes neuronales afectadas.10,41,42 No obstante, aunque la descripción de los efectos del litio en diferentes cascadas intracelulares ha permitido avanzar en el conocimiento de los mecanismos moleculares alterados en el trastorno bipolar, sigue siendo un conocimiento disperso que hasta ahora no ha permitido generar buenos modelos causales del trastorno.
4. Trastorno Bipolar y ritmos circadianos.
En los seres vivos, muchas variables biológicas presentan oscilaciones a intervalos de tiempo regulares de 24 horas, formando los llamados ritmos circadianos. Uno de los ciclos que se encuentra bajo el control de los ritmos biológicos es el del sueño-vigilia, el cual parece verse afectado en el trastorno bipolar. Es más, las alteraciones en la estructura del sueño y otras manifestaciones circadianas son componentes centrales en los trastornos del ánimo, viéndose empeoradas en los días precedentes a la aparición del episodio.43,44 En este sentido, se ha visto que el estado maniaco y otros síntomas que muestran recurrencia (euforia, falta de atención, hiperactividad), están estrechamente relacionados con una reducción de la necesidad de dormir.7
Se sabe que la región cerebral encargada del funcionamiento de este mecanismo cíclico en los mamíferos es el núcleo supraquiasmático (NSQ), un estimulador circadiano primario situado en el hipotálamo anterior que actúa como el sincronizador endógeno del cuerpo.7 El NSQ es el principal regulador de los ritmos endógenos del organismo45 y está relacionado con la regulación de los procesos fisiológicos y las funciones cerebrales.
Se ha observado que este sistema de regulación cíclica funciona gracias a un desfase temporal en la transcripción/traslación génica, el cual genera un bucle de feedback positivo/negativo en la expresión de los genes implicados.46 En mamíferos, los genes de este complejo actúan como reguladores de su propia expresión, así como de la de otros genes. La formación del dímero CLOCK-BMAL1 estimula este sistema (feedback positivo), gracias a la interacción que mantienen con los elementos impulsores de la región promotora E-box.47 Por otro lado, la activación de Per1, Per2, Cry1, Cry2, y REV-ERBα aportan el feedback negativo, inhibiendo su actividad.48
Otro de los aspectos en que esta combinación se ve implicada es la regulación génica.49 Una enzima, SIRT1, se acopla a CLOCK-BMAL1 y actúa también como mecanismo regulador, inhibiendo su activación mediante mecanismos de deacetilación, según han sugerido algunos autores50 (Fig. 1).
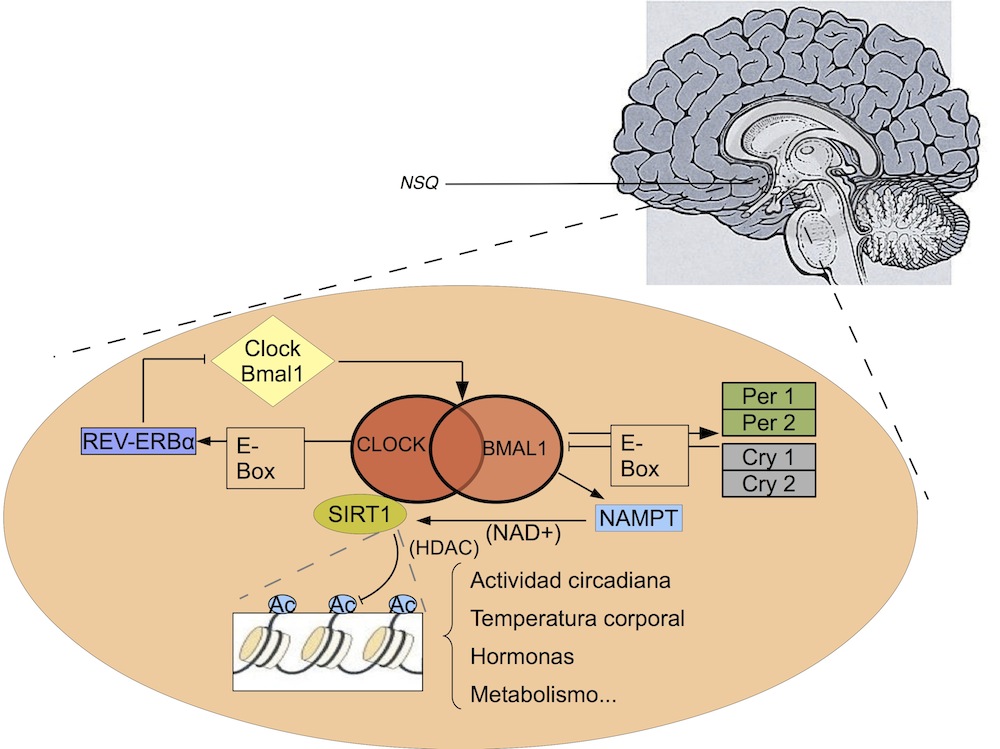
Figura 1. El heterodímero CLOCK-BMAL1 activa la transcripción de determinados genes a través de la región promotora E-box. Así, CLOCK-BMAL1 inducen la transcripción Per, Cry, y el Rev-erb, además de otros, facilitando la regulación del sistema por feedback negativo. Además, el dímero participa en funciones de regulación génica a través de la activación de la enzima NAMPT (Nicotinamida fosforribosiltransferasa), la cuál sintetiza NAD+, reguladora de SIRT1, la cual es capaz de actuar por deacetilación de histonas. La activación de este conjunto funciona como mecanismo de feedback negativo, necesario para la regulación del sistema (Adaptado de Nakahata et al., 2007).
En este sentido, existe, además, evidencia acerca de cambios epigenéticos que regulan la expresión de estos genes. Estudios recientes muestran que la acetilación de la histona 3 (H3) es esencial para la función circadiana; concretamente, se ha visto que la fosforilación de esta histona está implicada en la respuesta de transcripción que inicia la luz en el SNC.49,51 Como parte del sistema de regulación del complejo CLOCK-BMAL1, la no expresión de Per1 puede afectar al modo en que este sistema regula la ritmicidad circadiana. Además, se ha demostrado que la hipermetilación de la isla CpG puede bloquear la expresión de BMAL1, componente central en el sistema Clock.52 La desactivación epigenética de BMAL1 impide el patrón de expresión característico del reloj circadiano. Es más, la ausencia de BMAL1 asociada a hipermetilación también previene la captación de su dímero, CLOCK, para con sus dianas comunes.52
Entre todas las sustancias relacionadas con esta estructura, una merece especial mención: la melatonina. La melatonina es liberada desde la glándula pineal, siendo la neurohormona que mayor impacto tiene sobre la actividad del núcleo. La producción de esta hormona también sigue un ritmo circadiano, con un nivel bajo durante la fase de luz (NSQ más activado) y un nivel mayor durante la noche (NSQ más inhibido). El NSQ inhibe el disparo de neuronas del núcleo paraventricular del hipotálamo, creando un feedback negativo que regula la biosíntesis de melatonina a partir del triptófano en la glándula pineal. Se ha observado que la concentración de melatonina en sangre en individuos con trastorno bipolar es significativamente más baja, y su baja producción se ha considerado un marcador biológico del mismo.45 A su vez, existe evidencia de que sujetos con trastorno bipolar muestran una mayor sensibilidad a la luz, en tanto que necesitan un menor nivel de luminancia (<500 lux) para reprimir la producción de melatonina, independientemente de la fase del trastorno en que se encuentren, maníaca, depresiva o eutímica.53 Por este motivo, al no ser dependiente del estado, esta hipersensibilidad se ha sugerido también como marcador endofenotípico del trastorno.53 En la línea de estos resultados se encuentran otros que muestran cómo algunos antidepresivos, administrados de forma crónica, incrementan los niveles de secreción de esta hormona.54,55 Otros fármacos, como el litio o el valproato, reducen la sensibilidad de la melatonina a la luz, sin que los niveles de síntesis se vean alterados.32,33 Por este motivo, se cree que el efecto de los estabilizadores del ánimo puede ser explicado parcialmente por estos efectos cronobiológicos,7 lo que sería coherente con la propuesta de la alteración en los ritmos circadianos como base del trastorno.
Asimismo, se ha hallado evidencia sobre la vinculación del trastorno bipolar con los genes TIM (timeless) y Per3,56 así como sobre la influencia que el polimorfismo de un sólo nucleótido en CLOCK humano (sustitución de T → C en la posición 3,111, llamada Rs1801260) ejerce en ciertos aspectos del trastorno bipolar.57,58 Este polimorfismo se caracteriza por la presencia de dos alelos, uno en T (variación 3111T) y otro en C (variación 3111C).59,60 Los portadores de la variante 3111C parecen mostrar una ocurrencia menor de episodios de insomnio durante la etapa depresiva, así como durante su vida en general.60 De la misma forma, se ha visto que en los pacientes bipolares, el Rs1801260 puede estar influyendo en la ejecución neuropsicológica y el nivel de oxígeno en sangre (Blood-Oxygen-Level-Dependent, BOLD, en inglés) en tareas de decisión de valencia moral.61
Otro elemento intracelular relevante, ya mencionado como una de las alteraciones moleculares características del trastorno bipolar es la GSK3. En ratones, se sabe que GSK3 se expresa a nivel del NSQ e hígado. En humanos, una de las isoformas de GSK3, la GSK3β, se localiza en una región que ha sido vinculada con el trastorno bipolar, la 3q21.1. En concreto, el polimorfismo en un nucleótido (-50 T/C, T → C) de la región promotora parece influir en la edad de la primera aparición del trastorno bipolar,62 y determinadas variaciones alélicas de este gen muestran mejor respuesta aguda a la cronoterapia antidepresiva.63 Tomando estos resultados conjuntamente, podría sugerirse que la GSK3, expresada en el NSQ y siendo afectada por el litio de forma indirecta, pudiera estar actuando como enlace entre los efectos de los estabilizadores del ánimo y su habilidad para reducir la frecuencia de recaídas en sujetos con trastorno bipolar. Lo realmente destacable de los datos previamente expuestos es que los polimorfismos en los genes Clock no sólo muestran una asociación con el trastorno y sus características sintomatológicas, sino también parecen influir la respuesta al tratamiento,64 lo que abre una ventana a la exploración terapéutica de estos elementos.
Sin que quede clara todavía su relación con los mecanismos cronobiológicos, otro locus que parece estar afectado en el trastorno bipolar es la región de unión 6q21, lugar donde reside el gen que codifica el receptor de glutamato 6: Glur6 (también conocido como GRIK2), uno de los receptores glutamatérgicos de kainato.65,66 En concreto, se ha observado que los niveles de los receptores Glur5 y KA2 en hipocampo y corteza están reducidos en ratones mutantes de Glur6, sin que el tratamiento con litio afecte a esta reducción o a otro tipo de receptores glutamatérgicos.66 En un estudio llevado a cabo para comprobar los efectos de la eliminación del gen para este receptor, los resultados que se obtuvieron sugieren un papel determinante de este gen en el control de distintas conductas sintomáticas del estado de manía, como un aumento en la agitación psicomotora y conductas de riesgo, ansiedad reducida, mayor agresividad y búsqueda de sensaciones.4,66
5. Modelos animales de Trastorno Bipolar.
Hoy por hoy, se carece de un modelo animal de manía que sirva para explicar de forma válida la neurobiología de este trastorno. Como mucho, se puede estudiar determinados síntomas característicos de forma independiente. Aún así, una de las propuestas más interesantes se ha logrado mediante la obtención de un ratón mutante para el gen CLOCK.46,67 Los genes Clock, como se describió más arriba, son un conjunto de genes implicados en el mecanismo molecular de los ritmos circadianos (Fig. 1). Gran parte de la importancia de la obtención de mutantes de CLOCK reside en la creciente evidencia acerca del papel de los ritmos circadianos en la etiopatogenia del trastorno bipolar.7,43,47,68
Los estudios realizados con mutantes de CLOCK muestran que los ratones con alteraciones en este gen presentan un patrón de conductas similar al que identifica a una persona maníaca, lo que apoya la idea de una desregulación circadiana en el trastorno.47,58 La supresión del exón 19 en el gen CLOCK produce conductas sintomáticas de la manía, como hiperactividad, sueño y un incremento en la respuesta a cocaína, sucrosa y estimulación intracraneal.67,68 Igualmente, se ha observado en los animales manipulados genéticamente menos ansiedad y una respuesta aumentada al refuerzo en experimentos de estimulación intracraneal, en los que se observó que la intensidad de corriente necesaria para mantener la respuesta es menor en los ratones manipulados.68 Además, se ha visto que es posible bloquear estas conductas con litio70,71 y restaurando la función de CLOCK en el área tegmental ventral (VTA).72 En este sentido, los resultados obtenidos en diferentes paradigmas sugieren que los mutantes de CLOCK son un buen candidato a un modelo animal de manía.
Otros modelos han encontrado resultados prometedores manipulando otros genes que transducen proteínas relacionadas con el efecto del litio o la sintomatología maniaca. Los mutantes de ERK1,40 o los ya comentados de Glur666 y GSK3,25,29,30 sin abarcar todos los aspectos del trastorno bipolar, han resultados satisfactorios en los distintos criterios de validez.
La vía MAP quinasa, también llamada vía MAP/ERK es una vía mayor de señalización intracelular implicada en la regulación de la transcripción génica. Una de las funciones más destacadas de está vía intracelular se relaciona directamente con el mecanismo neurotrófico mediado por BDNF,71,73 cuya implicación en el tratamiento de los trastornos del ánimo ha sido repetidamente demostrada.37,69,71,73,74 Los ratones mutantes de ERK1 son hiperactivos y muestran conductas típicas de la manía, como por ejemplo, una búsqueda de recompensa, aun cuando esto implique consecuencias potencialmente dañinas.42 No obstante, al igual que los mutantes de CLOCK, el tratamiento con litio reduce estas conductas aunque el mecanismo molecular por el que esto ocurre no está totalmente claro. Se ha observado que muchas de estas alteraciones del comportamiento son reversibles mediante el transplante de neuronas dopaminérgicas en el área tegmental ventral procedentes de ratones que poseen el gen intacto, así como mediante tratamientos terapéuticos con litio.75-77 Estudios recientes sugieren que una forma de acción de los antidepresivos y estabilizadores del ánimo se produce mediante vías de acción intracelular interconectadas que fomentan la neurogénesis y la plasticidad sináptica. Un ejemplo de esto se puede ver en el incremento de la expresión de BDNF, TrkB y Bc1-2, mediante la activación de CREB por la acción de la adenilatociclasa activada por proteína G.67
La discusión sobre la implicación del componente genético en el trastorno bipolar y cómo las alteraciones genéticas interactúan para dar lugar a la aparición del mismo es de relevancia limitada si no se traduce en tratamientos capaces de controlar el trastorno. Los datos revisados sugieren que el futuro de la terapia para el trastorno bipolar debería incidir de forma directa en la regulación de las alteraciones circadianas.78
Los ritmos biológicos están regulados por el NSQ. La organización que sigue este núcleo es jerárquica: el reloj central recibe inputs lumínicos desde la retina a través del tracto retinohipotalámico, se sincroniza con ciclos de luz-oscuridad de 24 horas del exterior y comunica esa información a otros osciladores periféricos presentes en las células de varios tejidos. De este modo, los ritmos circadianos están normalmente sincronizados unos con otros. La luz es el zeiteberg o sincronizador más poderoso, hasta el punto de ser capaz de reiniciar el estimulador mediante cambios de fase inducidos por luz. La privación de sueño es una de las formas en que se puede influir en la función del NSQ, modificando los estados de transición entre un estado de alerta y otro de sueño. Se ha observado que la respuesta aguda a la terapia de privación del sueño es similar a la obtenida con psicofármacos.53,71,78 No obstante, a pesar de la rapidez con la que actúa, lo que la diferencia de los tratamientos farmacológicos es que el efecto de esta terapia es más transitorio. También relacionado con la disponibilidad de la luz, se ha demostrado que la exposición a la oscuridad disminuye los síntomas maníacos tan rápidamente como los fármacos antipsicóticos,68 apoyando la idea de una disfunción en la señalización circadiana.7,44,75
Estos resultados encajan además con la propuesta mencionada al principio de este trabajo referente a un modelo de trastorno bipolar basado en el modelo de atractores.9 La idea fundamental es que variaciones muy pequeñas en el sistema de partida pueden desencadenar consecuencias dramáticamente diferentes al sistema original. Tiene sentido pensar que pequeñas variaciones y alteraciones en bases de nucleótidos (variante alélica 3111C, el lugar de unión 6q21, el polimorfismo -50 T/C, T → C o el lugar de unión 3q21.1), la expresión del gen (CLOCK, Glur6, GSK3β), la codificación de proteínas implicadas con la regulación de los ritmos biológicos y las alteraciones en esta regulación (receptores Glu5 y KA2, proteína GSK3, melatonina), puedan desembocar en patrones inadaptados como la conducta maníaca y depresiva. Los cambios de un estado a otro en el trastorno bipolar pueden venir dados por ligeras variaciones en el funcionamiento del NSQ y su sensibilidad a los cambios en los ciclos de luz-oscuridad. Esta hipótesis se ve apoyada por los datos obtenidos en estudios de privación de sueño y terapias con estabilizadores del ánimo, y su capacidad para afectar los niveles de melatonina.7,32,33,51,79,80
En este sentido, cabe destacar la influencia que ejerce el litio sobre distintas vías de señalización. Por un lado, se ha visto que la inhibición del litio sobre la GSK3 se produce de forma directa (por competición con el ión Mg2+) e indirecta (vía PKB), lo que permite, entre otras funciones, la génesis axónica. Otra evidencia relevante es que la exposición crónica al litio es capaz de regular a la baja el sustrato de MARCKS, implicado en procesos de neuroplasticidad, especialmente en hipocampo. Se ha demostrado que el tratamiento con antidepresivos puede aumentar la producción de neuronas en esta área en ratones.73,79 También se ha visto que el tratamiento con estabilizadores de ánimo es capaz de reducir los síntomas de manía de ratones mutantes de ERK1, cuya vía (MAP/ERK) se ve profundamente implicada en el mecanismo neurotrópico mediado por BDNF.74,77,79
Estudios recientes sugieren que una forma de acción de los antidepresivos y estabilizadores del ánimo se produce mediante vías intracelulares interconectadas que fomentan la neurogénesis y la plasticidad sináptica. Un ejemplo de esto se puede ver en el incremento de la expresión de BDNF, TrkB y Bc1-2, mediante la activación de CREB por la acción de la adenil-ciclasa activada por proteína G. Así pues, estos datos sirven claramente de apoyo empírico para el modelo de redes neuronales presentado previamente.10,41,42
Es importante tener en cuenta, que un tercio de estos pacientes tiene su primer episodio durante la adolescencia, y el 50% de casos presenta comorbilidad con abuso de drogas.2 Además, rara vez es diagnosticado a la primera, y en ocasiones puede confundirse con la esquizofrenia. Esta circunstancia retoma la cuestión planteada sobre la necesidad de un nuevo enfoque diagnóstico que aborde los trastornos mentales desde una perspectiva neurobiológica, más que categorial. Centrarse en las características neuropsicológicas de la enfermedad mental reduciría la limitación en el diagnóstico, y, por consiguiente, en el tratamiento de la misma.
A modo de resumen, la evidencia aquí recogida sirve de base para proponer que, más allá de como se definido hasta ahora, el trastorno bipolar resulta algo más que un mero trastorno del estado de ánimo. Más bien se trata de un complejo patrón cognitivo-conductual que se expresa de manera cíclica, con un fuerte sustrato genético, en el que los polimorfismos y cambios epigenéticos que influyen en la función de varios genes relacionados con la familia Clock, afectan centralmente a las características clínicas de esta dolencia. Así, la eficacia demostrada de los estímulos capaces de actuar directamente sobre el reloj del organismo (la luz, la melatonina, o la manipulación del ciclo sueño-vigilia), en el tratamiento de los episodios tanto maníacos como depresivos, abre una puerta para un nuevo enfoque de tratamiento. De este modo, la posibilidad de afectar sistemas directa y profundamente implicados en este trastorno de una forma efectiva, acompañando a la terapia farmacológica, favorecerá sin duda la mejora de los síntomas del trastorno y, por consiguiente, la calidad de vida de los pacientes que lo sufren.
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders (4º ed., rev.). Washington, D.C.; 2000.
- Hyman E. Can neuroscience be integrated into the DSM-V? Nat. Rev. Neurosci. 2007; 8(9): 725-32.
- Geller B, Luby J. Child and adolescent bipolar disorder: a Review of the past 10 years. J. Am. Acad. Child Adoles. Psychiatry 1997; 36:1168-76.
- Belmaker, RH. Bipolar Disorder. N. Engl. J. Med. 2004; 351: 476-86.
- Einat H. Different behaviors and different strains: potential new ways to model bipolar disorder. Neurosci. Biobehav. Rev. 2007; 31: 850-57.
- Goodwin FK, Jamison KR. Manic-Depressive Illness: Bipolar Disorders and Recurrent Depression, 2nd Edition. Oxford University Press, USA; 2007.
- Benedetti F, Dallaspezia S. Melatonin, Circadian rythms, and Clock genes in Bipolar Disorder. Current Psychiatry Reports 2009; 11: 488-93.
- Eisenberg DP, Berman KF. Executive function, neural circuitry and genetic mechanisms in schizophrenia. Neuropsychopharmacology 2010; 35: 258-77.
- Berns GS, Nemerof CB. The neurobiology of Bipolar Disorder. Am. J. Med. Genet. 2003; 123: 76-84.
- Castren E. Is mood chemistry? Nat. Rev. Neurosci. 2005; 6(3): 241-46.
- Cummings JL, Mendez MF. Secondary mania with focal cerebrovascular lesions. Am. J. Psychiatry 1984; 141(9): 1084-87.
- Starkstein SE, Fedoroff P, Berthier ML, Robinson RG. Manic-depressive and pure manic states after brain lesions. Biol. Psychiatry 1991; 29(2): 149-58.
- Strakowski SM, Adler CM, DelBello MP. Volumetric MRI studies on mood disorders: do they distinguish unipolar and bipolar disorder? Bipolar Disord. 2002; 4(2): 80-8.
- Strakowski SM. Brain structures involved in bipolar disorder: findings from structural and functional imaging. CNS Spectr. 2007; 6(Suppl 8): 5-8.
- Pearlson GD. Structural and functional brain changes in bipolar disorder: a selective review. Schizophrenia Research 1999; 39(2): 133-40.
- Swayze VW, Andreasen NC, Alliger RJ, Yuh TJ, Ehrhardt JC. Subcortical and temporal structures in affective disorder and schizophrenia: a magnetic resonance study. Biol. Psychiatry 1992; 31(3): 221-40.
- Savitz J, Drevets WC. Bipolar and major depressive disorder: Neuroimaging the developmental-degenerative divide. Neurosci. Biobehav. Rev. 2009; 33(5): 699-771.
- Bremner JD, Vythilingam M, Vermetten E, Nazeer A, Adil J, Khan S, Staib LH, Charney DS. Reduced Volume of Orbitofrontal Cortex in Major Depression. Biol. Psychiatry 2002; 51: 273–79.
- Buchsbaum MS. Brain imaging in the research for biological markers in affective disorder. J. Clin. Psychiatry 1986; 47: 7-12.
- Baxter LR Jr, Schwartz JM, Phelps ME, Mazziotta JC, Guze BH, Selin CE, Gerner RH, Sumida RM. Reduction of prefrontal cortex glucose metabolism common to three types of depression. Arch. Gen. Psychiatry 1989; 46(3): 243-50.
- Vawter MP, Freed WJ, Kleinman JE. Neuropathology of bipolar disroder. Biol. Psychiatry 2000; 48:486-504.
- Meador-Woodruff JH, Hogg AJ, Smith RE. Striatal ionotropic glutamate receptor expression in schizophrenia, bipolar disorder, and major depressive disorder. Brain Research Bulletin 2001; 55(5): 631-40.
- Shi J, Badner JA, Hattori E, Potash JB, Willour VL, McMahon FJ, Gershon ES, Liu C. Neurotransmission and bipolar disorder: a systematic family-based association study. Am. J. Med. Genet. B. Neuropsychiatr. Genet. 2008; 147B(7): 1270-77.
- Ongür D, Jensen JE, Prescot AP, Stork C, Lundy M, Cohen BM, Renshaw PF. Abnormal glutamatergic neurotransmission and neuronal-glia interactions in acute mania. Biol. Psychiatry 2008; 64(8): 718-26.
- Rao JS, Rapoport SI, Kim HW. Decreased GRK3 but not GRK2 expression in frontal cortex in bipolar disorder patients. Int. J. Neuropsychopharmacol. 2009; 12(6): 851-60.
- Martinowich K, Schloesser RJ, Manji HK. Bipolar disorder: from genes to behavior pathways. J. Clin. Invest. 2009; 119: 726-36.
- Lebegue B. Mania precipitated by fluoxetine. Am. J. Psychiatry 1987; 144(12): 1620.
- Kupfer DJ, Carpenter LL, Frank E. Possible role of antidepressants in precipitating mania and hypomania in recurrent depression. Am. J. Psychiatry 1989; 145(7); 804-08.
- O'Brien WT, Klein PS. Validating GSK3 as an in vivo target of lithium action. Biochem. Soc. Trans. 2009; 37: 1133-38.
- Fang X, Xing Yu S, Bast RC Jr., Woodgett JR, Mills GB. Phosphorylation and inactivation of glycogen syntase 3 by protein kinase A. Proc. Natl. Acad. Sci. USA 2002; 27(22): 11960-65.
- Licht RW. Drug treatment of mania: a critical review. Acta Psychiatr. Scand. 1998; 97(6): 387-97.
- Hallam KT, Olver JS, Horgan JE, McGrath C, Norman TR. Low doses of lithium carbonate reduce melatonin light sensitivity in healthy volunteers. Int. J. Neuropsychopharmacol. 2005; 8: 255-59.
- Hallam KT, Olver JS, Norman TR. Effect of sodium valproate on nocturnal melatonin sensitivity to light in healthy volunteers. Neuropsychopharmacology 2005; 30: 1400-04.
- Manji HK, Bitran JA, Masana MI, Chen GA, Hsiao JK, Risby ED, Rudorfer MV, Potter WZ. Signal transduction modulation by lithium: cell culture, cerebral microdialysis and human studies. Psychopharmacol. Bull. 1991; 27(3): 199-208.
- Manji HK, Lenox RH. Signaling: cellular insights into the pathophysiology of bipolar disorder. Biol. Psychiatry 2000; 48: 518-30.
- Young LT, Li PP, Kish SJ, Siu KP, Warsh JJ. Postmortem cerebral cortex Gs alpha-subunit levels are elevated in bipolar affective disorder. Brain Res. 1991; 553(2): 323-6.
- Perez J, Tardito D, Racagni G, Smeraldi E, Zanardi R. cAMP signaling pathway in depressed patients with psychotic features. Mol. Psychiatry 2002; 7: 208-12.
- Grewal SS, Fass DM, Yao H, Ellig CL, Goodman RH, Stork PJ. Calcium and cAMP signals differentially regulate cAMP-responsive element-binding protein function via a Rap1-extracellular signal-regulated kinase pathway. J. Biol. Chem. 2000; 275(44): 34433-41.
- Berridge MJ, Downes CP, Hanley MR. Neural and developmental actions of lithium: a unifiying hypothesis. Cell. 1989; 59(3): 411-19.
- Manji HK, Chen G. PKC, MAP kinases and the bcl-2 family of proteins as long-term targets for mood stabilizers. Molecular Psychiatry 2002; 7: S46-56.
- Lenox RH, McNamara RK, Watterson JM, Watson DG. Myristoylated alanine-rich C kinase substrate (MARCKS): a molecular target for the therapeutic action of mood stabilizers in the brain? J. Clin. Psychiatry 1996; 13: 23-31.
- Chen G, Manji HK. The extracellular signal-regulated kinase pathway: an emerging promising target for mood stabilizers. Curr. Opin. Psychiatry 2006; 19: 313-23.
- Bauer M, Grof P, Rasgon N, Bschor T, Glenn T, Whybrow PC. Temporal relation between sleep and mood in patients with bipolar disorder. Bipolar Disord. 2006; 8: 160-67.
- Jones SH. Circadian rhythms, multilevel models of emotion and bipolar disorder: an initial step towards integration? Clin. Psychol. Rev. 2001; 21: 1193-209.
- Pandi-Perumal SR, Srinivasan V, Maestroni GJ, Cardinali DP, Poeggeler B, Hardeland R. Melatonin: nature’s most versatile biological signal? FEBS J. 2006; 273: 2813-38.
- Sato TK, Yamada RG, Ukai H, Baggs JE, Miraglia LJ, Kobayashi TJ, Welsh DK, Kay SA, Ueda HR, Hogenesch JB. Feedback repression is required for mammalian circadian clock function. Nat. Gen. 2006; 38: 312-19.
- Von Schantz M. Phenotypic effects of genetic variability in human clock genes on circadian and sleep parameters. J Genet. 2008; 87:513-19.
- Maywood ES, Mrosovsky N, Field MD, Hastings MH. Rapid down-regulation of mammalian period genes during behavioral resetting of the circadian clock. Proc. Natl. Acad. Sci USA 1999; 96(26): 15211-16.
- Nakahata Y, Grimaldi B, Sahar S, Hirayama J, Sassone-Corsi P. Signaling to the circadian clock: plasticity by chromatin remodeling. Curr. Opin. Cell. Biol. 2007; 19: 230-37.
- Nakahata Y, Kaluzova M, Grimaldi B, Sahar S, Hirayama J, Chen D, Guarente LP, Sassone-Corsi P.The NAD+-dependent deacetylase SIRT1 modulates CLOCK-mediated chromatin remodeling and circadian control. Cell 2008; 134: 329–40.
- Kenedy SH, Kutcher SP, Ralevski E, Brown GM. Nocturnal melatonin and 24-hour 6-sulphatoxymelatonin levels in various phases of bipolar affective disorder. Psychiatry Res. 1996; 63: 219-22.
- Taniguchi H, Fernández AF, Setién F, Ropero S, Ballestar E, Villanueva A, Yamamoto H, Imai K, Shinomura Y, Esteller M. Epigenetic inactivation of the circadian clock gene BMAL1 in hematologic malignancies. Cancer Res. 2009; 69(21): 8447-54.
- Lewy AJ, Wehr TA, Goodwin FK, Newsome DA, Markey SP. Light suppresses melatonin secretion in humans. Science 1980; 210: 1267-69.
- Lewy AJ, Nurnberger JI Jr, Wehr TA, Pack D, Becker LE, Powell RL, Newsome DA. Supersensitivity to light: possible trait marker for manic-depressive illness. Am. J. Psychiatry1985; 142: 725-27.
- Kennedy SH, Brown GM. Effect of chronic antidepressant treatment with adinazolam and desipramine on melatonin output. Psychiatry Res. 1992; 43(2): 177-85.
- Nievergelt CM, Kripke DF, Barret TB, Thomas BB, Elyssa R, Ronald A, Sadovnick AD, McElroy SL, Keck PE Jr, Schork NJ, Kelsoe JR. Suggestive evidence for association of the circadian genes PERIOD3 and ARNTL with bipolar disorder. Am. J. Med. Genet. B. Neuropsychiatr. Genet. 2006; 141B: 234-41.
- Benedetti F, Dallaspezia S, Fulgosi MC, Mara C, Lorenzi C, Serretti A, Barbini B, Colombo C, Smeraldi E. Actimetric evidence that CLOCK 3111 T/C SNP influences depressive insomnia and activity patterns in bipolar depression. Am J Med Genet B Neuropsychiatr Genet. 2007; 144B: 631-35.
- Roybal K, Theobold D, Graham A, DiNieri J, Russo S, Krishnan V, Chakravarty S, Peevey J, Oehrlein N, Birnbaum S, Vitaterna MH, Orsulak P, Takahashi JS, Nestler EJ, Carlezon WA Jr, McClung CA. Mania-like behavior induced by disruption of CLOCK. Proc. Natl. Acad. Sci. USA 2007; 104: 6406-11.
- Mansour HA, Wood J, Logue T, Chowdari KV, Dayal M, Kupfer DJ, Monk TH, Devlin B, Nimgaonkar VL. Association study of eight circadian genes with bipolar disorder, schizoaffective disorder and schizofrenia. Genes Brain Behav. 2006; 5: 150-57.
- Serretti A, Gaspar-Barba E, Calati R, Cruz-Fuentes CS, Gomez-Sanchez A, Perez-Molina A, De Ronchi D. 3111T/C clock gene polymorphism is not associated with sleep disturbances in untreated depressed patients. Chronobiology International 2010; 27(2): 265-77.
- Benedetti F, Radaelli D, Bernasconi A, Dallaspezia S, Falini A, Scotti G, Lorenzi C, Colombo C, Smeraldi E. Clock genes beyond the clock: CLOCK genotype biases neural correlates of moral valence decision in depressed patients. Genes, Brain and Behav. 2008; 7: 20-25.
- Benedetti F, Serretti A, Colombo C, Lorenzi C, Tubazio V, Smeraldi E. A glycogen sintase kinase 3-beta promoter gene single nucleotide polymorphism is associated with age at onset and response to total sleep deprivation in bipolar depression. Neurosci. Lett. 2004; 376: 51-5.
- Schulze TG, Buervenich S, Badner JA, Steele CJ, Detera-Wadleigh SD, Dick D, Foroud T, Cox NJ, MacKinnon DF, Potash JB, Berrettini WH, Byerley W, Coryell W, DePaulo JR Jr, Gershon ES, Kelsoe JR, McInnis MG, Murphy DL, Reich T, Scheftner W, Nurnberger JI Jr, McMahon FJ. Loci on chromosomes 6q and 6p interact to increase susceptibility to bipolar affective disorder in the national institute of mental health genetics initiative pedigrees. Biol. Psychiatry 2004; 56: 18-23.
- Dick DM, Foroud T, Flury L, Bowman ES, Miller, MJ, Rau NL, Moe PR, Samavedy N, El-Mallakh R, Manji H, Glitz DA, Meyer ET, Smiley C, Hahn R, Widmark C, McKinney R, Sutton L, Ballas C, Grice D, Berrettini W, Byerley W, Coryell W, DePaulo R, MacKinnon DF, Gershon ES, Kelsoe JR, McMahon FJ, McInnis M, Murphy DL, Reich T, Scheftner W, Nurnberger JI Jr. Genomewide linkage analyses of bipolar disorder: a new sample of 250 pedigrees from the National Institute of Mental Health Genetics Initiative. Am. J. Hum. Genet. 2003; 73: 107-14.
- Schulze TG, Buervenich S, Badner JA, Steele CJM, Detera-Wadleigh SD, Dick D, Foroud T, Cox NJ, MacKinnon DF, Potash JB, Berrettini WH, Byerley W, Coryell W, DePaulo, JRJr., Gershon ES, Kelsoe JR, McInnis MG, Murphy DL, Reich T, Scheftner W, Nurnberger, JIJr., McMahon FJ. Loci on Chromosomes 6q and 6p Interact to Increase Susceptibility to Bipolar Affective Disorder in the National Institute of Mental Health Genetics Initiative Pedigrees. Biol Psychiatry 2004; 56: 18-23.
- Shaltiel G, Maeng S, Malkesman O, Pearson B, Schloesser RJ, Tragon T, Rogawski M, Gasior M, Luckenbaugh D, Chen G, Manji HK. Evidence for the involvement of the kainate receptor subunit GluR6 (GRIK2) in mediating behavioral displays related to behavioral symptoms of mania. Mol. Psychiatry 2008; 13: 858-72.
- Coyle JT. What can a clock mutation in mice tell us about bipolar disorder? Prc. Natl. Acad. Sci. USA 2007; 104(15): 6097-98.
- Manev H, Uz T. Clock genes: influencing and being influenced by psychoactive drugs. Trends. Pharmacol. Sci. 2006; 27: 186-89.
- Malkesman O, Austin DR, Chen G, Manji HK. Reverse translational strategies for developing animal models of bipolar disorder. Disease Models & Mechanisms 2009; 2: 238-45.
- Manji HK, Duman RS. Impairments of neuroplasticity and cellular resilience in severe mood disorders: implications for the development of novel therapeutics. Pharmacol. Bull. 2001; 35(2): 5-49.
- Duman RS, Nakagawa S, Malberg J. Regulation of adult neurogenesis by antidepressant treatment. Neuropsychopharmacology 2001; 25: 836-4.
- McClung CA. Circadian rhythms, the mesolimbic dopaminergic circuit, and drug addiction. TSWJ. 2007; 7: 194-20
- Malberg JE, Eisch AJ, Nestler EJ, Duman RS. Chronic antidepressant treatment increases neurogenesis in adult rat hippocampus. J. Neurosci. 2000; 20: 9104–9110.
- Huang EJ, Reichardt LF. Trk receptors: roles in neuronal signal transduction. Annu. Rev. Biochem. 2003; 72:609-4.
- Mansour HA, Monk TH, Nimgaonkar VL. Circadian genes and bipolar disorder. Ann. Med. 2005; 37: 196-205.
- Chen G, Henter ID, Manji HK. Translational research in bipolar disorder: emerging insights from genetically based models. Mol. Psychiatry 2010 [In press].
- O’Brien WT, Harper AD, Jove F, Woodgett, JR, Maretto, S, Piccolo S, Klein PS. Glycogen synthase kinase-3beta haploinsufficiency mimics the behavioral and molecular effects of lithium. Journal of Neuroscience 2004; 24(30): 6791–98.
- Barbini B, Benedetti F, Colombo C, Dotoli D, Bernasconi A, Cigala-Fulgosi M, Florita M, Smeraldi E. Dark therapy for mania: a pilot study. Bipolar Disord. 2005; 7: 98-10.
- Coyle JT, Duman RS. Finding the intracellular signaling pathways affected by mood disorder treatments. Neuron 2003; 38(2): 157-60.
- Lewy AJ, Emens J, Jackman A, Yuhas K. Circadian uses of melatonin in humans. Chronobiol. Int. 2006; 23(1-2): 403-12.
| Recibido: 14 de julio de 2011 | Aceptado: 03 de octubre de 2011 |
Correspondencia:
Correspondencia: Dr. Ernesto Tarragón Cros, Área de Psicobiología, Universidad Jaume I., Av. Sos Baynat sn, 12071 Castellón. España., Correo: tarragoe@psb.uji.es
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
