Modelos experimentales de epilepsia en ratas en desarrollo
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Artículo de Revisión
Experimental models of epilepsy in the developing rat
Cecilia Zavala-Tecuapetla1 y María Leonor López-Meraz2,3*
1Departamento de Farmacobiología, Cinvestav Sede Sur, México D.F. 2Programa de Neurobiología, UniversidadVeracruzana, Xalapa, Veracruz. 3Posgrado en Neuroetología, Universidad Veracruzana, Xalapa, Veracruz.
Resumen/Abstract
Introducción
Conclusiones
Agradecimientos
Referencias
Correspondencia
La epilepsia es un trastorno neurológico crónico que se presenta más comúnmente en los niños que en los adultos. El período posnatal temprano representa un período crítico del desarrollo para el sistema nervioso central, de tal forma que un cerebro inmaduro es generalmente más susceptible a la generación de crisis epilépticas que uno adulto. Además, puesto que los efectos de las crisis epilépticas producidas en el cerebro en desarrollo son dependientes de la edad, las crisis generadas en un sujeto inmaduro resultan en diferentes consecuencias. El uso de modelos animales para el estudio de la epilepsia, empleando ratas en desarrollo, permite al investigador entender los mecanismos que generan las crisis epilépticas, los que las detienen, los procesos de epileptogénesis, así como la identificación de posibles terapias farmacológicas; sin embargo, cada uno de estos abordajes experimentales presentan peculiaridades y también limitantes que deben ser consideradas. Dichos modelos se clasifican en base al tiempo que toma generar las crisis epilépticas, al agente causante de la actividad epiléptica e incluso dependiendo del tipo de crisis epiléptica generada. Este artículo aborda a manera de revisión, los diferentes modelos de epilepsia que se han utilizado en la rata neonata y en desarrollo.
Palabras clave : Epilepsia, Modelos experimentales, Crisis epiléptica, Cerebro en desarrollo, Periodo postnatal.
Epilepsy is a chronic neurological disorder that occurs most commonly in children than in adults. The early postnatal period represents a critical phase of development for central nervous system, so that the immature brain is generally more susceptible to the generation of seizures than in the adult. Furthermore, since the effects of seizures occurring in the developing brain are age-dependent, seizures generated in immature individuals result in different consequences to those caused in adults. The use of animal models for the study of epilepsy in developing rats will allow the researcher to understand the mechanisms that trigger seizures and those which stop them, the processes of epileptogenesis as well as the identification of potential drug therapies. However, each one of these experimental approaches has quirks and limitations that must be considered. These experimental models are classified considering the time taken to generate seizures, the causative agent of seizure activity and the type of seizure activity generated. This review summarizes the models of epilepsy in the developing rat currently employed.
Key words: Epilepsy, Experimental models, Seizure, Developing brain, Postnatal period.
La incidencia de la epilepsia es mayor en niños que en adultos, aparentemente debido a las diferencias que existen en la vulnerabilidad neuronal, la reorganización celular y sináptica, así como en los procesos regenerativos.1 Datos clínicos indican que el cerebro inmaduro es altamente susceptible a la generación de crisis epilépticas, su incidencia es mayor durante los primeros años de vida2, 3, 4 y esta depende de variables tales como la edad de inicio de las crisis, el tipo de crisis que presentan, así como su frecuencia y duración, además de factores genéticos y de los fármacos antiepilépticos empleados, entre otras.5, 6 También es un hecho que la farmacología de las crisis en el cerebro inmaduro es diferente a la de un cerebro maduro.7 El uso de modelos animales permite al investigador controlar varias de estas variables además de obtener un acercamiento a los mecanismos que generan las crisis epilépticas y el daño producido por éstas.5 En los modelos experimentales de epilepsia, las consecuencias de las crisis son dependientes de la edad, la etiología, la duración y la frecuencia de las mismas.1 El animal más comúnmente utilizado para la investigación de la epilepsia es la rata. Las ratas nacen en un estado prematuro relativo al humano, lo cual debe considerarse al momento de interpretar los datos obtenidos de los estudios en ratas.1, 6 Se ha sugerido que del día postnatal (P) 8 al día 10 en la rata, corresponde con un neonato humano en completo término. La rata de entre P10-17 es equivalente al desarrollo de un infante, mientras que del día P18-30 corresponde a la etapa de prepubertad y finalmente, a partir del día P32-36 inicia la pubertad de la rata.1, 6, 8 Por ello, los modelos animales de epilepsia en ratas han contribuido a determinar las causas y los efectos tanto de las crisis epilépticas aisladas y recurrentes como del estado epiléptico sobre el cerebro en desarrollo. Esta revisión pretende exponer los modelos de epilepsia actualmente utilizados en ratas en desarrollo.
2. Epilepsia vs crisis epilépticas.
Debe tenerse claro que la epilepsia es un padecimiento crónico que cursa con un incremento y sincronización anormales de la actividad eléctrica neuronal, lo que conlleva a alteraciones electroencefalográficas y crisis recurrentes y espontáneas.9, 10 Una crisis epiléptica es un cambio conciso en la conducta, una alteración motora o sensorial recurrente que resulta de la actividad excesiva de las neuronas; puede ser convulsiva o no convulsiva.9 El padecer epilepsia implica que el cerebro presente una anormalidad persistente capaz de generar actividad neuronal excesiva de manera súbita y espontánea, lo cual difiere de un cerebro que ha tenido una crisis aguda como una respuesta natural a una alteración o pérdida de la homeostasis.11 Adicionalmente, debe señalarse que el término epilepsia incluye diferentes tipos de síndromes epilépticos con características sui generis, pero cuya coincidencia es la presentación de las crisis recurrentes y espontáneas. A este respecto, La Comisión para la Clasificación y Terminología de la Liga Internacional contra la Epilepsia (International Legue Against Epilepsy, ILAE) intenta clasificar los tipos de epilepsias, por un lado categorizando a las epilepsias y por el otro, a las crisis epilépticas.12, 13, 14
3. Modelos experimentales de epilepsia.
Para facilitar el estudio de la epilepsia, desde las causas hasta sus consecuencias, se han desarrollado modelos experimentales basados principalmente en mimetizar las crisis epilépticas observadas en el humano. Sin embargo, debe resaltarse que en numerosos casos, el término de crisis epiléptica se aplica aún cuando la alteración de la actividad cerebral anormal que las origina es aguda y no persistente ni espontánea, esto es, a pesar de no ser propiamente epilepsia.
Existen al menos tres categorías aceptadas para clasificar a los modelos experimentales de epilepsia, esto es, considerando la duración del protocolo para inducir las crisis epilépticas (agudos y crónicos), la causa de la actividad epiléptica (por sustancias químicas, estímulos físicos, alteraciones metabólicas, o mutaciones genéticas) o bien el tipo de actividad epiléptica que se genera (focales o generalizadas; corticales o límbicos; clónicas o tónicas; estado epiléptico; etc.).15, 16 Debe mencionarse que en muchos casos la categorización de los modelos experimentales es más bien una combinación de todas las clasificaciones anteriores (Tabla 1).
Tabla 1. Modelos experimentales de epilepsia en ratas.
| Tipo Agente Pro-Epiléptico | Agente Causante | Tipo de Actividad Epiléptica Generada | Tipo Protocolo (Duración) | Edad de las Ratas |
| Químico | Ácido kaínico | Crisis parciales complejas secundariamente generalizadas, status epilepticus | Agudo, crónico | Adultas y en desarrollo |
| Pilocarpina | Crisis parciales complejas secundariamente generalizadas, status epilepticus | Agudo, crónico | Adultas y en desarrollo | |
| Pentilentetrazol | Crisis clónico-tónicas generalizadas | Agudo | Adultas y en desarrollo | |
| Crisis parciales complejas secundariamente generalizadas | Crónico (kindling químico) | Adultas | ||
| Crisis de ausencia | Agudo | Adultas | ||
| Glutamato monosódico | Crisis tónico-clónicas generalizadas | AgudoCrónico | En desarrollo | |
| Fluoroetil | Crisis clónico-tónicas generalizadas | Agudo | En desarrollo | |
| Toxina tetánica | Crisis secundariamente generalizadas | Crónico | Adultas y en desarrollo | |
| Físico | Kindling eléctrico | Crisis parciales complejas secundariamente generalizadas | Crónico | Adultas y en desarrollo |
| Generación de postdescargas corticales | Crisis parciales complejas o crisis mioclónicas | Agudo | En desarrollo | |
| Electrochoques | Crisis mioclónicasCrisis tónico-clónicas | Agudo | Adultas y en desarrollo | |
| Hipertermia | Crisis parciales complejas secundariamente generalizadas | AgudoCrónico | En desarrollo | |
| Hipoxia | Crisis clónico-tónicas | Agudo | En desarrollo | |
| Genético | Ratas genéticamente propensas a crisis de ausencia GAERS (GeneticAbsence Epilepsy Rat from Strasbourg) | Crisis de ausencia | *Descargas electrográficas tipo espiga onda espontáneas | Jóvenes (1 mes de edad) y adultas |
| Ratas genéticamente propensas a crisis de ausencia WAG/Rij (Wistar Absence Glaxo rat) | ||||
| Ratas Genéticamente Propensas a la Epilepsia GEPR (GeneticallyEpilepsy-Prone Rats) | Crisis convulsivas primaria o secundariamente generalizadas (clónicas/tónico-clónicas) | Sonido | Adultas |
3.1 Modelos agudos y crónicos.
En esta clasificación se hace referencia al tiempo que conlleva inducir las crisis epilépticas, principalmente convulsiones, y se dividen en agudos, crónicos y multifactoriales.15 En los modelos agudos, las crisis epilépticas se inducen sólo una vez y de manera rápida en un animal normal, generalmente en una sola sesión (de hecho no son propiamente modelos de epilepsia) por medios físicos o químicos. Este tipo de modelos son útiles para estudiar los mecanismos de inducción y detención de la actividad epiléptica, así como las alteraciones postictales.15, 16 Por su parte, los modelos crónicos requieren de una manipulación repetida que permita, normalmente, la generación de crisis epilépticas espontáneas o actividad epiléptica persistente. De aquí que los modelos crónicos sean considerados verdaderos modelos de epilepsia. Estos modelos facilitan el estudio de los procesos de epileptogénesis así como las consecuencias postictales e interictales que la actividad epiléptica persistente causa en el individuo que lo padece. Finalmente, los modelos multifactoriales, implican una manipulación genética que predispone al sujeto a sufrir epilepsia, la cual puede involucrar diferente blancos moleculares, pero importantemente aquellos implicados en el funcionamiento de canales iónicos.
3.2 Modelos químicos, físicos y genéticos.
Los modelos de epilepsia también pueden clasificarse considerando la causa de las crisis epilépticas, independientemente de que esta actividad se haga espontánea en el futuro o no. En este sentido, los modelos pueden inducirse con agentes químicos, con estimulación eléctrica, alteraciones metabólicas e incluso genéticas (por ejemplo ratas que presentan predisposición genética a las crisis de ausencia, o bien sujetos que han sido modificados genéticamente como los ratones transgénicos o knockout). Los modelos químicos, como el nombre lo indica, consisten en la inducción de actividad epiléptica (convulsiva o no) como consecuencia a la administración de sustancias químicas excitadoras (principalmente análogos glutamatérgicos) o agentes que disminuyen o bloquean la neurotransmisión inhibidora (principalmente antagonistas GABAérgicos o glicinérgicos). Actualmente se dispone de un amplio repertorio de modelos químicos efectivos en sujetos en desarrollo, tales como los que emplean los vapores del fluoroetil (éter bis-2, 2, 2-trifluoroetil), un agente estimulante del sistema nervioso central; la aplicación cortical o hipocampal de la toxina tetánica secretada por la bacteria Clostridium tetani; y el pentilentetrazol (antagonista no competitivo del receptor GABAA) aplicado sistémicamente, los cuales representan modelos de crisis generalizadas. Mientras tanto, la administración de convulsivantes tales como el ácido kaínico (AK, un agonista del receptor glutamatérgico del tipo AK) y la pilocarpina (un agonista de los receptores muscarínicos colinérgicos) representan modelos de status epilepticus generalizado o de crisis límbicas recurrentes, mismas que reproducen a la epilepsia del lóbulo temporal humana (ELT). Se recomienda ampliamente al lector interesado en estos modelos revisar el manuscrito de Velísek, 2006.17 También las crisis epilépticas pueden generarse utilizando abordajes experimentales físicos en ausencia de sustancias químicas, contemplando en este grupo principalmente aquellos protocolos que modifican la fisiología celular al aplicar corriente eléctrica, generando un aumento de la temperatura corporal (hipertermia) o bien disminuyendo la disponibilidad de oxígeno (hipoxia). Así, a diferencia de los modelos químicos, en estos modelos no se aplica sustancia alguna para generar la actividad epiléptica, sino más bien se modifica el microambiente cerebral para aumentar la actividad y sincronicidad neuronal y generar así las crisis epilépticas. Posteriormente se revisarán algunos de estos modelos empleando ratas en desarrollo.Los modelos genéticos de epilepsia pueden dividirse en al menos dos grandes grupos. La primera categoría incluye distintas especies animales (como el ratón, la rata, el pollo, el perro o el mandril) que presentan actividad epiléptica espontánea, o bien que presentan un umbral bajo a las crisis generadas por diversos métodos (estimulación eléctrica tipo choque eléctrico o kindling, por la aplicación de convulsivantes químicos o por hipertermia), o bien que sufren crisis epilépticas evocadas por estímulos sensoriales como luz o sonido.18, 20 En el caso de la rata, el sujeto de interés en esta revisión, existen dos cepas de ratas que presentan espontáneamente descargas espiga-onda similares a las observadas en las crisis de ausencia: las Ratas Genéticamente Propensas a Crisis de Ausencia de Estrasburgo (GAERS, siglas para Genetic Absence Epilepsy Rat from Strasbourg) y las Ratas Wistar Albino Glaxo (WAG/Rij, siglas para Wistar Albino Glaxo Rat from Rijswijk).18 Sin embargo, debe destacarse que el tipo de crisis generadas en estas cepas de ratas no son observadas hasta los 30 días de edad y van incrementando gradualmente llegando a ser permanentes a los 3 meses de edad.18 Adicionalmente, existe una cepa de ratas denominada Ratas Genéticamente Propensas a la Epilepsia (GEPR, siglas para Genetically Epilepsy-Prone Rats) que presentan crisis convulsivas primaria o secundariamente generalizadas (clónicas o tónico-clónicas) inducidas por sonidos o hipertermia.20 En esta cepa de ratas, entre el 75-100% de los animales presentan crisis similares a las observadas en el adulto a partir de la tercera semana de vida.21 En la segunda categoría se circunscriben aquellas mutaciones generadas espontáneamente o inducidas por técnicas de ADN recombinante (como sería la inserción de copias o la deleción de un gen en específico, de tal forma que la función normal de dicho gen se pierde).18 Los blancos moleculares de estos acercamientos son principalmente canales iónicos de sodio, calcio, potasio y los receptores GABAA/GABAB.22, 23 Tales modelos permiten investigar los mecanismos cerebrales fundamentales de la epilepsia (implicar o excluir moléculas, sinapsis o ejes neuronales específicos, involucrados en el desarrollo de la epileptogénesis), así como la eficacia de diversos anticonvulsivantes en el tipo particular de epilepsia generada. Sin embargo, la mayoría de las manipulaciones genéticas que permiten reproducir cambios génicos observados en el humano, se han realizado en ratones.18, 22 Considerando lo anteriormente expuesto, cuando se pretende estudiar a la rata en desarrollo, los modelos genéticos de epilepsia no son precisamente los más socorridos, razón por la cual no se detallan en esta revisión.
4. Modelos de epilepsia en la rata en desarrollo.
Los modelos animales han contribuido a determinar los efectos tanto del estado epiléptico como de las crisis breves recurrentes sobre el cerebro en desarrollo.5, 6 Como se indicó previamente existen numerosas formas de modelar a la epilepsia en el laboratorio; sin embargo, esta revisión abordará algunos modelos químicos ampliamente empleados cuando se estudian sujetos en desarrollo (el del ácido kaínico, la pilocarpina, el pentilentetrazol y el glutamato monosódico), así como algunos modelos que no emplean sustancias químicas y que han sobresalido recientemente (convulsiones por hipertermia, el kindling eléctrico y la inducción eléctrica de postdescargas epilépticas).Cabe señalar que dado la inmadurez y continuo cambio del cerebro en desarrollo, incluyendo con esto aspectos moleculares, estructurales, morfológicos y funcionales, es difícil realizar modelos de epilepsia en animales neonatos e infantes, a menos que la epilepsia se presente durante la etapa adulta a partir de la actividad epiléptica generada durante el período postnatal. A continuación revisaremos únicamente algunos modelos, por ser los más empleados para el estudio de la actividad epiléptica en ratas en desarrollo, mencionando el tipo de convulsiones que se generan en cada uno de ellos. La figura 1 resume las diferencias en los modelos experimentales actualmente empleados para el estudio de la epilepsia en ratas en desarrollo.
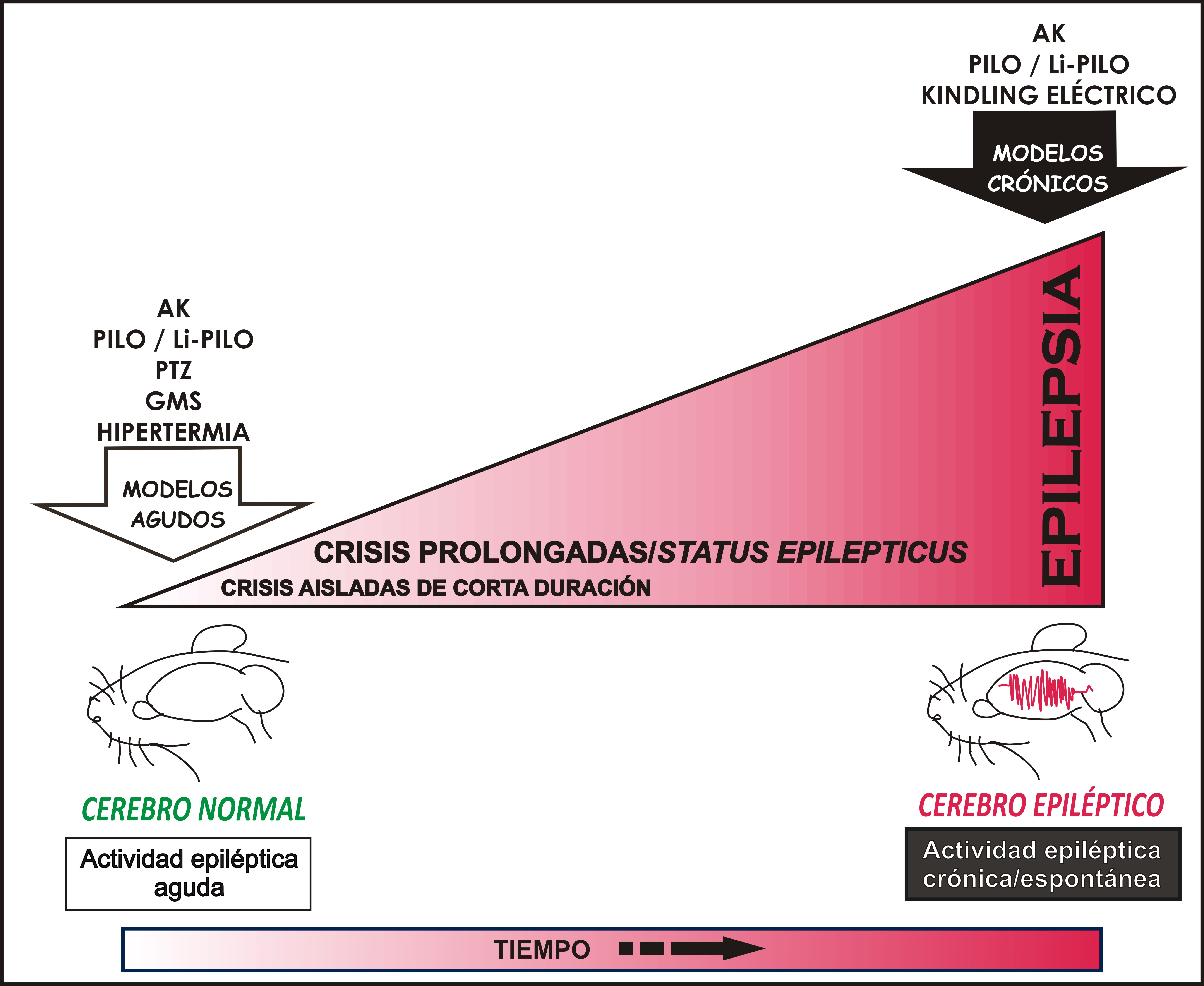
Figura 1. El esquema representa la diferencia entre los modelos agudos de epilepsia, los cuales se emplean para generar actividad epiléptica en un cerebro normal (ya sea crisis de duración corta o prolongada como en el status epilepticus) en comparación con los modelos crónicos, los cuales generan cambios plásticos en el cerebro que causan actividad epiléptica repetida o espontánea. Los modelos agudos más empleados en la rata en desarrollo incluyen la administración de los agentes convulsivantes ácido kaínico (AK), pilocarpina sola (Pilo) o en combinación con litio (Li-Pilo), pentilentetarzol (PTZ) o glutamato monosódico (GMS); la inducción de hipertermia y la generación de postdescargas (PDs) eléctricas. Dentro de los modelos de epilepsia crónicos mas socorridos se encuentran el del AK, el de Pilo/Li-Pilo (note que la aplicación de estas substancias genera inicialmente status epilepticus y posteriormente crisis epilépticas espontáneas o epilepsia) y el kindling eléctrico. Para más detalle referirse al texto.
4.1 Ácido kaínico.
El kainato o ácido kaínico (AK) es un agonista de los receptores glutamatérgicos ionotropicos del mismo nombre, los cuales son particularmente abundantes en el hipocampo.24 Si bien es cierto el repertorio conductual que produce la aplicación del AK varía de acuerdo a la edad de la rata, existe coincidencia en la presentación de crisis parciales secundariamente generalizadas, implicando importantemente al sistema límbico, tan así que las ratas presentan extenso daño hipocampal y cortical.25, 26, 27 Durante las primeras dos semanas de vida, el AK genera un automatismo de “rascado” que desaparece durante la tercera semana, durante la cual aparecen las llamadas sacudidas de perro mojado, mismas que son precedidas por las convulsiones.27 Este modelo se ha usado en ratas con edades de 5-20 días posnatales principalmente tras la aplicación sistémica (2-10 mg/kg, i.p) del alcaloide.17, 27 El ácido kaínico se emplea para inducir convulsiones originadas en el sistema límbico e incluso puede causar estado epiléptico (etapa aguda), el cual produce cambios neurales que promueven el proceso de epileptogénesis (etapa de latencia) dando lugar al desarrollo de crisis epilépticas espontáneas (etapa crónica).17, 25, 26 Por lo tanto, este modelo puede emplearse para inducir status epilepticus o para estudiar sus consecuencias, incluyendo procesos de daño neuronal y epileptogénesis.
4.2 Pilocarpina y Litio-Pilocarpina.
La pilocarpina es un alcaloide con acción colinérgica, actuando principalmente a nivel de los receptores muscarínicos M128 y cuyos efectos convulsivantes fueron inicialmente descritos por Turski y colaboradores.29, 30, 31 Debe mencionarse que con esta sustancia química se puso de manifiesto la importancia de la neurotransmisión colinérgica en la epilepsia. Existen dos variantes de este modelo, en la primera, la pilocarpina se administra sistémicamente en dosis de 300-400 mg/kg de peso; en la otra, la administración de la pilocarpina a dosis de 30-60 mg/kg de peso, es precedida (entre 16-24 h) por la inyección de cloruro de litio (3 mEq/kg), aminorando las afectaciones periféricas de la pilocarpina, razón por la cual este modelo es denominado litio-pilocarpina.32 Las crisis convulsivas, así como la neuropatología que se genera por las convulsiones en ambos protocolos son comparables.31 El modelo de la pilocarpina puede inducirse en ratas en desarrollo (ambos géneros) de 10 a 21 días de edad, con diferente susceptibilidad y mortalidad dependiendo de la edad, pero con características convulsivas similares a las crisis límbicas.33, 34, 35, 36 En las ratas en desarrollo, la pilocarpina produce inicialmente estado epiléptico, fenómeno que posteriormente (alrededor 4-5 meses) puede desencadenar crisis epilépticas espontáneas.37 Una de las principales ventajas de este modelo aplicado en ratas en desarrollo radica en su alta eficiencia para generar las convulsiones y la baja mortalidad, parámetro que aumenta conforme la rata crece. Debe señalarse que tanto en el modelo de pilocarpina sola como en el de litio-pilocarpina, se produce daño hipocampal, cuyo patrón de muerte neuronal depende de la edad de la rata.36 Al igual que en el modelo del AK, este modelo permite estudiar las causas del status epilepticus, su farmacología, así como mecanismos de muerte neuronal y la generación de epilepsia.
4.3 Pentilentetrazol.
El pentilentetrazol (PTZ) es un antagonista no competitivo de los receptores GABAA (interacciona con el sitio de unión a picrotoxina).38, 39 Las manifestaciones conductuales causadas por el PTZ lo hacen un modelo de crisis generalizadas (crisis de ausencia, cuando se emplean dosis bajas del PTZ [20–30 mg/kg de peso]; o crisis tónico- clónicas, con dosis altas [40 a 100 mg/kg de peso]).40, 41 Puede ser administrado en ratas neonatas (a partir de P7) y ratones adultos. Las manifestaciones conductuales convulsivas son dependientes de la edad: las crisis tónico clónicas son observadas durante todo el desarrollo mientras que las crisis clónicas son limitadas durante las dos primeras semanas postnatales de vida.17, 42 Es un modelo fácil de usar y las crisis producidas generan baja mortalidad. El PTZ es el modelo de primera elección para la investigación de fármacos con efecto anticonvulsivante.43
4.4 Glutamato monosódico.
Si bien es cierto el glutamato penetra con dificultad la barrera hematoencefálica, su sal sódica, el glutamato monosódico (GMS) lo hace con relativa facilidad en sujetos en desarrollo. Así, este modelo ha sido ampliamente usado en neonatos y consiste en la aplicación subcutánea de una dosis de 4 mg/kg de la sal de glutamato durante los días postnatales 1, 3, 5, y 7. Este modelo se emplea principalmente para evaluar mecanismos de muerte neuronal por excitotoxicidad,44, 45 aunque recientemente también se ha enfatizado su uso como un modelo de convulsiones en neonatos, lo anterior debido a que durante las 3 primeras sesiones produce un patrón conductual de convulsiones tónico-clónicas generalizadas con un claro correlato de actividad electrográfica anormal. 45
4.5 Hipertermia.
Las crisis febriles son el tipo más común de convulsiones en la niñez.4, 46 Se han realizado varios abordajes experimentales para tratar de reproducir este tipo de convulsiones utilizando ratas en desarrollo (P6-P22).47, 48, 49 Los métodos desarrollados producen hipertermia (38-45°C corporales), lo cual a su vez desencadena las convulsiones. Sobresalen procedimientos como los siguientes: 1) la exposición de las ratas (P13-17) a microondas (9.4-18 W/kg) durante 10 min;50 2) la inmersión del sujeto experimental (P22) en agua caliente a 45°C durante 4 min, protocolo que causa crisis tónico-clónicas;51 3) la exposición de las ratas inmaduras (P6-12) al aire caliente (40.5-42.5°C) emitido por una secadora de cabello durante 30 min, lo que causa diferentes conductas dependientes de la edad, desde arresto conductual, automatismos y masticación hasta crisis tónicas.47 Se ha sugerido que la generación prolongada de crisis febriles promueve los procesos de epileptogénesis y en consecuencia podría generarse Epilepsia del Lóbulo Temporal (ELT), la forma más común de epilepsia humana.48, 51 Este modelo también se ha empleado para estudiar posibles agentes farmacológicos con potencial anticonvulsivante en el cerebro inmaduro.
4.6 Postdescargas epilépticas generadas eléctricamente.
Las crisis generadas por estimulación eléctrica presentan una ventaja: el agente epileptogénico actúa únicamente durante la aplicación de la corriente.52 Las crisis generadas eléctricamente pueden ser divididas en dos tipos de acuerdo al modo de estimulación: 1) aquellas generadas por la estimulación del cerebro completo (crisis por choque eléctrico); 2) aquellas generadas por estimulación local de una estructura cerebral definida (postdescargas epilépticas).52 Precisamente, éste último modelo será detallado a continuación.Las postdescargas electroencefalográficas (PDs) generadas por estimulación eléctrica local, tienen distintos patrones electrográficos y correlatos conductuales de acuerdo a la estructura estimulada. Los experimentos pueden ser dirigidos hacia dos diferentes vertientes: 1) la medición del umbral de la intensidad de la corriente eléctrica necesaria para generar las PDs ó 2) la aplicación repetida de estimulación eléctrica de la misma intensidad pero con intervalos cortos, evitando el kindling.52 Este segundo tipo de medición puede ser empleado para estudiar los efectos anticonvulsivantes agudos. Las PDs epilépticas representan un modelo de crisis parciales complejas (estimulación de estructuras límbicas como el hipocampo, la amígdala y la corteza piriforme) o crisis mioclónicas (estimulación de la corteza sensorimotora) y pueden generarse principalmente en ratas. La evaluación se enfoca a la presencia o ausencia de las PDs epilépticas, las cuales deben tener una duración mínima de 5 s, aunque también se consideran los cambios conductuales que las acompañan (siendo los más comunes los movimientos de cabeza y las sacudidas de perro mojado).52La generación de las PDs en estructuras cerebrales específicas, depende del nivel de maduración del cerebro. Por ejemplo, las PDs corticales son generadas en rata a partir de los 12 días postnatales (P12),53, 54, 55 mientras que en el hipocampo se generan a partir del día P7.56, 57 El implante de los electrodos de estimulación, en ratas neonatas, puede ser de manera epidural o bien, introduciéndolos en la corteza cerebral o el hipocampo empleando un aparato estereotáxico. En general, se debe tomar en cuenta que este modelo es de crisis epilépticas, no epilepsia, y que las crisis generadas experimentalmente son a partir de un cerebro sano.
4.7 Kindling eléctrico.
El kindling eléctrico es un modelo experimental descrito a final de la década de los 60´s por Goddard y colegas, y que consiste en la estimulación eléctrica repetida (pulsos de 1 ms de duración, a 60 Hz, durante 1s) de regiones cerebrales específicas (principalmente la amígdala y el hipocampo), lo que conlleva al desarrollo de crisis parciales complejas secundariamente generalizadas.58 Sin embargo, fue Racine quien realizó un estudio detallado de los cambios electroencefalográficos y conductuales que acompañan a este modelo en la rata adulta.59 De hecho, una de las escalas más empleadas en los modelos de ELT en roedores, es la descrita por este autor. En la rata en desarrollo, Hass y colegas60 emplearon ratas de 14 y 16 días de edad para inducir el fenómeno kindling, aunque debido a las inherencias propias del desarrollo de la rata, la aplicación de los estímulos (1s a 60 Hz y 400 mA) se llevó a cabo cada 15 min durante 2 días. Este protocolo de estimulación produce crisis similares a las observadas en adultos, pero en algunos casos acompañadas de saltos, carreras (running) e incluso extensión tónica. En la actualidad también se emplea más ampliamente el denominado kindling “rápido”, que inicialmente consiste en la aplicación de trenes de 10 s de estimulación eléctrica tetánica supraumbral en el hipocampo de ratas adultas durante 3-9 h, produciendo convulsiones similares al kindling convencional.61 Esta versión rápida del kindling también se puede llevar a cabo en animales en desarrollo (7-28 días de edad) al estimular el hipocampo ventral con un tren de estímulos de 10 s de duración, a 20 Hz, cada 5 min durante 6 h, observándose la aparición de crisis generalizadas (y el correspondiente aumento de la posdescarga) en un mismo día experimental,62, 63 lo cual representa una ventaja cuando se emplean sujetos en desarrollo. Este modelo ha sido ampliamente utilizado para identificar fármacos con potencial efecto antiepiléptico en sujetos en desarrollo, e incluso se ha empleado para valorar el potencial epileptogénico del fenómeno kindling en ratas inmaduras y las consecuencias del mismo.
5. Causas de la susceptibilidad de los roedores en desarrollo a las crisis epilépticas.
El efecto de las crisis epilépticas generadas en los modelos anteriormente descritos es dependiente de la edad. Las crisis en el cerebro inmaduro resultan en diferentes patologías en comparación con el cerebro adulto. Numerosas evidencias sugieren que mientras el umbral a las crisis, generadas por convulsivantes o por estímulos eléctricos, es mucho menor en los animales inmaduros, el cerebro inmaduro parece ser relativamente resistente al daño neuronal generado por las crisis epilépticas.5, 64, 65 La causa de esta susceptibilidad aún está bajo estudio, pero existen varias propuestas para explicarla.El período postnatal temprano representa un período crítico del desarrollo para incrementar la sinaptogénesis y la plasticidad neuronal. La neurotransmisión excitadora parece ser requerida para estos procesos y está incrementada en el cerebro inmaduro en comparación con el adulto.7 Varios componentes de la transmisión sináptica están bajo cambios dramáticos durante este periodo, tales como la densidad sináptica, la distribución de los receptores de la neurotransmisión, la composición y la densidad de subunidades de dichos receptores, la expresión de los transportadores de los neurotransmisores, la expresión de los canales iónicos, los mecanismos homeostáticos iónicos y el metabolismo energético.7 Durante este período de cambios, el equilibro entre la transmisión sináptica excitadora y la inhibidora favorece la excitación neuronal. De hecho, los receptores del mayor neurotransmisor inhibitorio (GABA) son despolarizantes en el cerebro inmaduro.7, 66, 67, 68 En la rata antes del día postnatal 5, la activación de los receptores GABAA causa despolarización de la membrana más que hiperpolarización. La inhibición GABAérgica aparece gradualmente durante las primeras tres semanas postnatales. También existen cambios en la densidad de varios subtipos de receptores a glutamato (el mayor neurotransmisor excitatorio) durante el desarrollo.7 Se sabe que los receptores tipo NMDA se expresan mayormente durante la primera semana postnatal en estructuras como el hipocampo y la neocorteza, y que la densidad de los receptores AMPA es mayor durante la segunda semana postnatal (alrededor del día P10), mientras que el número de los receptores a Kainato aumentan gradualmente durante las primeras semanas de vida.7, 67 También la expresión de los canales iónicos y en consecuencia la homeostasis iónica cambia durante el desarrollo lo que prolonga los potenciales de acción e incrementa la excitación neuronal.7
La epilepsia presenta una incidencia del 1% en la población general,69 mientras que en la población pediátrica mexicana, prevalece en 18.5 de cada 1000 niños.70 La experiencia clínica sugiere dos aspectos que relacionan el desarrollo cerebral y la epilepsia.7 El primero establece que el estadío de maduración del cerebro en desarrollo parece disminuir el umbral a las crisis epilépticas; el segundo, considera que ciertos tipos de crisis, al presentarse durante la etapa neonatal o posnatal, resultan en epilepsia u otro tipo de déficit neurocognitivo durante la adultez.7 En numerosos casos, las crisis epilépticas son de difícil control, e incluso pueden volverse resistentes al tratamiento farmacológico, afectando la calidad de vida de quien las padece. Lo anterior urge a desarrollar la investigación que permita entender cómo se genera la actividad epiléptica, identificar tratamientos potenciales para contrarrestarla y a su vez identificar las consecuencias de padecer epilepsia durante el desarrollo de un individuo. Los modelos experimentales sin duda alguna son de vital importancia en el entendimiento de esta enfermedad, pero el investigador debe conocer los alcances y limitaciones de cada uno de ellos para obtener conclusiones valiosas.
La realización de este manuscrito fue apoyada por el Consejo Nacional de Ciencia y Tecnología (beca posdoctoral del proyecto 98386 a CZT; proyecto 106402 a MLLM), así como por el Sistema PROMEP por el apoyo a Nuevos Profesores de Tiempo Completo (Oficio PROMEP/103.5/10/5006, PTC-474 a MLLM).
- Holopainen EI, Seizures in the developing brain: Cellular and molecular mechanisms of neuronal damage, neurogenesis and cellular reorganization. Neurochem Int 2008 52: 935–947.
- DeLorenzo RJ, Pellock JM, Towne AR, Boggs JG. Epidemiology of status epilepticus. J Clin Neurophysiol 1995 12: 316-325.
- DeLorenzo RJ, Hauser WA, Towne AR, Boggs JG, Pellock JM, Penberthy L, Garnett L, Fortner CA, Ko D. A prospective, population-based epidemiologic study of status epilepticus in Richmond, Virginia. Neurology 1996 46:1029-1035.
- Hauser WA. The prevalence and incidence of convulsive disorders in children. Epilepsia 1994 35 (2): S1–S6.
- Holmes G. Effects of Seizures on Brain Development: Lessons from the Laboratory. Pediatr Neurol 2005 33: 1-11.
- Scantlebury HM, Heida JG, Hasson HJ, Velıskova J, VelIsek L, Galanopoulou RS, Moshé SL. Age-Dependent Consequences of Status Epilepticus: Animal Models. Epilepsia 2007 48(2): 75–82.
- Jensen FE. Acute and Chronic Effects of Seizures in the Developing Brain: Experimental Models. Epilepsia 1999 40(1): S51-S58.
- Haut SR, Velísková J, Moshé SL. Susceptibility of immature and adult brains to seizure effects. Lancet Neurol 2004 3(10): 608-617.
- Engel JJr, Pedley TA. What’s the epilepsy?. En: Engel J y Pedley TA (Ed.). Epilepsy: A comprehensive textbook. Philadelphia: Lippincott-Raven Publishers 1995, pp 1-7.
- Fisher RS, Frost JJ. Epilepsy. The Journal of Nuclear Medicine 1991 32: 651-659.
- Engel J Jr. Report of the ILAE classification core group. Epilepsia 2006 47: 1558-1568.
- Commission on classification and Terminology of the International League Against Epilepsy: Proposal for revised clinical and electroencephalographic classification of epileptic seizures. Epilepsia 1981 22: 489-501.
- Commission on classification and Terminology of the International League Against Epilepsy: Proposal for revised clinical and electroencephalographic classification of epileptic seizures. Epilepsia 1989 30: 389-399.
- Engel J Jr. International League Against Epilepsy (ILAE). A proposed diagnostic scheme for people with epileptic seizures and with epilepsy: report of the ILAE Task Force on Classification and Terminology. Epilepsia. 2001 42: 796-803.
- Engel J Jr, Schwartzkroin PA. What should be modeled? En: Pitkanen A, Schwartzkroin PA, Moshe SL (Ed.). Models of seizures and epilepsy. Elsevier Academic Press 2006, pp1-14.
- Fisher RS. Animal models of the epilepsies. Brain Res Rev 1989 14: 245-278.
- Velísek L. Models of Chemically-Induced Acute Seizures. En: Pitkanen A, Schwartzkroin PA, Moshe SL (Ed.). Models of seizures and epilepsy. Elsevier Academic Press 2006, pp127-152.
- Noebels JL, Fariello RG, Jobe PC, Lasley SM, Marescaux C. Genetic Models of Generalized Epilepsy. En: Engel JJr, Pedley TA (Ed.). Epilepsy: A Comprehensive Textbook. Lippincott-Raven Publishers, Philadelphia 1997, pp 457-465.
- Depaulis A, Van Luijtelaar G. Genetic Models of Absence Epilepsy in the Rat. En: Pitkanen A, Schwartzkroin PA, Moshe SL (Ed.). Models of seizures and epilepsy. Elsevier Academic Press 2006, pp 233-248.
- Jobe PC, Browning RA. Mammalian Models of Genetic Epilepsy characterized by sensory-evoked seizures and generalized seizure susceptibility. En: Pitkanen A, Schwartzkroin PA, Moshe SL (Ed.). Models of seizures and epilepsy. Elsevier Academic Press 2006, pp 261-271.
- Reigel CE, Jobe PC, Dailey JW, Savage DD. Ontogeny of sound-induced seizures in the genetically epilepsy-prone rat. Epilepsy Res 1989 4: 63-71.
- Burgess DL. Transgenic and Gene replacement Models of Epilepsy: Targeting Ion Channel and Neurotransmission pathways in mice. En: Pitkanen A, Schwartzkroin PA, Moshe SL (Ed.). Models of seizures and epilepsy. Elsevier Academic Press 2006, pp 199-222.
- Somjen GG. Seizures, Channels, Genes. En: Somjen GG (Ed.). Ions in the Brain, Normal function, Seizures and Stroke. Oxford University Press 2004, pp 235-244.
- Jahr CE, Stevens CF. Glutamate activates single channel conductances in hippocampus neurons. Nature 1987 325: 522-525.
- Ben-Ari Y, Tremblay E, Riche D, Ghilini G, Naquet R. Electrographic, clinical and pathological alterations following systemic administration of kainic acid, bicuculline or pentetrazole: Metabolic mapping using the deoxyglucose method with special reference to the pathology of epilepsy. Neuroscience 1981 6: 1361–1391.
- Lothman EW, Collins RC. Kainic acid induced limbic seizures: Metabolic, behavioral, electroencephalographic and neuropathological correlates. Brain Res 1981 218: 299–318.
- Velísková J, Velísek L, Mares P. Epileptic phenomena produced by kainic acid in laboratory rats during ontogenesis. Physiol Bohemoslov 1988 37: 395–405.
- Hamilton SE, Loose MD, Qi M, Levey AI, Hille B, McKnight GS, Idzerda RL, Nathanson NM. Disruption of the m1 receptor gene ablates muscarinic receptor-dependent M current regulation and seizure activity in mice. Proc Natl Acad Sci USA 1997 94: 13311–13316.
- Turski WA, Cavalheiro EA, Schwarz M, Czuczwar SJ, Kleinrok Z, Turski L. Limbic seizures produced by pilocarpine in rats: A behavioural, electroencephalographic and neuropathological study. Behav Brain Res 1983 9: 315–335.
- Turski L, Cavalheiro EA, Czuczwar SJ, Turski WA, Kleinrok Z. The seizures induced by pilocarpine: behavioral, electroencephalographic and neuropathological studies in rodents. Pol J Pharmacol Pharm 1987 39: 545–555.
- Turski L, Ikonomidou C, Turski WA, Bortolotto ZA, Cavalheiro EA. Cholinergic mechanisms and epileptogenesis: the seizures induced by pilocarpine: a novel experimental model of intractable epilepsy. Synapse 1989 3: 154–171.
- Jope RS, Morrisett RA, Snead III OC. Characterization of lithium potentiation of pilocarpine-induced status epilepticus in rats. Exp Neurol 1986 67: 471–480.
- Cavalheiro EA, Silva DF, Turski WA, Calderazzo-Filho LS, Bortolotto ZA, Turski L. The suceptibility of rats to pilocarpine-induced seizures is age-dependent. Dev Brain Res 1987 37: 43–58.
- Kubova H, Druga R, Lukasiuk K, Suchomelova L, Haugvicova R, Jirmanova I, Pitkanen A. Status epilepticus causes necrotic damage in the mediodorsal nucleus of the thalamus in immature rats. J Neurosci 2001 21: 3593-3599.
- Lopez-Meraz ML, Wasterlain CG, Rocha L, Allen S, Niquet J. Vulnerability of postnatal hippocampal neurons to seizures varies regionally with their maturational stage. Neurobiol Dis 2010 37: 394–402.
- Sankar R, Shin DH, Liu H, Mazarati A, Pereira de Vasconcelos A, Wasterlain CG, Patterns of status epilepticus-induced neuronal injury during development and long-term consequences. J Neurosci 1998 18: 8382–8393.
- Suchomelova L, Baldwin RA, Kubova H, Thompson KW, Sankar R, Wasterlain CG. Treatment of experimental status epilepticus in immature rats: dissociation between anticonvulsant and antiepileptogenic effects. Pediatr Res 2006 59: 237-243.
- Hansen SL, Sperling BB, Sanchez C. Anticonvulsant and antiepileptogenic effects of GABAA receptor ligands in pentylenetetrazole-kindled mice. Prog Neuropsychopharmacol Biol Psychiatry 2004 28: 105–113.
- Ramanjaneyulu R, Ticku MK. Interactions of pentamethylenetetrazole and tetrazole analogues with the picrotoxinin site of the benzodiazepine- GABA receptor-ionophore complex. Eur J Pharmacol 1984 98: 337–345.
- Cortez MA, Snead III OC. Pharmacologic Models of generalized absence seizures in rodents En: Pitkanen A, Schwartzkroin PA, Moshe SL (Ed.). Models of seizures and epilepsy. Elsevier Academic Press 2006, pp 111-126.
- Zhao Q, Holmes GL. Repetitive Seizures in the Immature Brain. En: Pitkanen A, Schwartzkroin PA, Moshe SL (Ed.). Models of seizures and epilepsy. Elsevier Academic Press 2006, pp341-350.
- Velísek L, Kubová H, Pohl M, Stanková L, Mares P, Schickerová R. Pentylenetetrazol-induced seizures in rats: An ontogenetic study. Naunyn Schmiedebergs Arch Pharmacol 1992 346: 588–591.
- Kupferberg H. Animal models used in the screening of antiepileptic drugs. Epilepsia 2001 42 (4): 7–12.
- Beas-Zarate C, Rivera-Huizar SV, Martinez-Contreras A, Feria-Velasco A, Armendariz-Borunda J. Changes in NMDAreceptor gene expression are associated with neurotoxicity induced neonatally by glutamate in the rat brain. Neurochem Int 2001 39:1 – 10.
- Lopez-Perez SJ, Urenna-Guerrero ME, Morales-Villagran A. Monosodium glutamate neonatal treatment as a seizure and excitotoxic model. Brain Res 2010 1317: 246-256.
- Sillanpää M, Camfield PR, Camfield CS, Aromaa M, Helenius H, Rautava P, Hauser WA. Inconsistency between prospectively and retrospectively reported febrile seizures. Dev Med Child Neurol 2008 50: 25-28.
- Baram TZ, Gerth A, Schultz L. Febrile seizures: an appropriate-aged model suitable for long-term studies. Brain Res Dev Brain Res 1997 98(2): 265-270.
- Dubé C, Baram TZ. Complex Febrile Seizures, an Experimental Model in Immature Rodents. En: Pitkanen A, Schwartzkroin PA, Moshe SL (Ed.). Models of seizures and epilepsy. Elsevier Academic Press 2006, pp 333-340.
- Jiang W, Duong TM, de Lanerolle NC. The neuropathology of hyperthermic seizures in the rat. Epilepsia 1999 40(1): 5-19.
- Hjeresen DL, Guy AW, Petracca FM, Diaz J. A microwave-hyperthermia model of febrile convulsions. Bioelectromagnetics 1983 4(4): 341-355.
- Dubé CM, Ravizza T, Hamamura M, Zha Q, Keebaugh A, Fok K, Andres AL, Nalcioglu O, Obenaus A, Vezzani A, Baram TZ. Epileptogenesis provoked by prolonged experimental febrile seizures: mechanisms and biomarkers. J Neurosci 2010 30: 7484-7494.
- Mares P, Kubova H. Electrical Stimulation-Induced Models of Seizures. En: Pitkanen A, Schwartzkroin PA, Moshe SL (Ed.). Models of seizures and epilepsy. Elsevier Academic Press 2006, pp 153-159.
- Kubová H, Lanstiaková M, Mocková M, Mares P, Vorlícek J. Pharmacology of cortical epileptic afterdischarges in rats. Epilepsia 1996 37: 336–341.
- Mares P, Haugvicová R, Kubová H. Unequal development of thresholds for various phenomena induced by cortical stimulation in rats. Epilepsy Res 2002 49: 35–43.
- Mares P, Kubova H. What Is the Role of Neurotransmitter Systems in Cortical Seizures?. Physiol Res 2008 57 (3): S111-S120.
- Velísek L, Mares P. Increased epileptogenesis in the immature hippocampus. Exp Brain Res 1991 20: 183–185.
- Velísek L, Mares P. Hippocampal afterdischarges in rats. I. Effects of antiepileptics. Physiol Res 2004 53: 453–461.
- Goddard GV, McIntyre DC, Leech CK. A permanent change in brain function resulting from daily electrical stimulation. Exp Neurol 1969 25: 295–330.
- Racine RJ. Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalogr Clin Neurophysiol 1972 32: 281–294.
- Haas KZ, Sperber EF, Moshe SL. Kindling in developing animals: expression of severe seizures and enhanced development of bilateral foci. Brain Res Dev Brain Res 1990 56: 275-280.
- Lothman EW, Hatlelid JM, Zorumski CF, Conry JA, Moon PF, Perlin JB. Kindling with rapidly recurring hippocampal seizures. Brain Res 1985 360: 83–91.
- Mazarati A, Shin D, Auvin S, Sankar R. Age-dependent effects of topiramate on the acquisition and the retention of rapid kindling. Epilepsia 2007 48: 765–773.
- Michelson HB, Lothman EW. An ontogenetic study of kindling using rapidly recurring hippocampal seizures. Brain Res Dev Brain Res 1991 61: 79–85.
- Liu Z, Stafstrom CE, Sarkisian M, et al. Age-dependent effects of glutamate toxicity in the hippocampus. Dev Brain Res 1996 97: 178-184.
- Marks JD, Friedman JE, Haddad GG. Vulnerability of CA1 neurons to glutamate is developmentally regulated. Devel Brain Res 1996 97: 194-206.
- . Excitatory actions of GABA durig development: The Nature of the Nurture. Nat Rev Neurosci 2009 3: 728-739.
- Brooks-Kayal AR, Rearranging Receptors. Epilepsia 2005 46 (7): 29-38.
- Holmes GL. The Long-Term Effects of Neonatal Seizures. Clin Perinatol 2009 36: 901–914.
- Torres-Zambrano M, Castillo Támara E, Camargo Ballestas JM. Resistencia farmacológica en epilepsia. Acta Neurol Colomb 2007 23: 278-285.
- Ruiz-García M, Sosa-de-Martinez C, González-Astiazarán A, Rueda-Franco F. Clinical-etiological and therapeutic profile of 719 Mexican epileptic children. Childs Nerv Syst 2002 18: 593-598.
| Recibido: 18 de junio de 2011 | Aceptado: 19 de agosto de 2011 |
Correspondencia:
Dra. Maria Leonor López Meraz, Programa de Neurobiología, Universidad Veracruzana, Xalapa, Ver., Tel.: (228) 8418900 Ext. 13609, Correo: leonorlopez@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
