Conducta sexual y neurogénesis adulta: ¿Por qué estudiar el cerebelo?
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Artículo de Revisión
Sexual behavior and adult neurogenesis: Why thinking about the cerebellum?
Carmen Aguirre1, Dolores Vázquez-Sanromán2, Genaro A. Coria-Avila1, Rebeca Toledo1, María Leonor Lopez-Meraz1, Jorge Manzo1, Marta Miquel2
1Programa de Neurobiología. Universidad Veracruzana. Xalapa, Ver. México
2Área de Psicobiología. Universidad Jaume I. Castellón. España.
Resumen/Abstract
Contenido
Conclusiones
Agradecimientos
Referencias
Correspondencia
La neurogénesis adulta es la formación de nuevas neuronas en cerebro adulto y constituye una respuesta de adaptación al ambiente o a cambios impuestos sobre la fisiología neuronal. Su regulación se lleva a cabo por factores ambientales, hormonales, genéticos y epigenéticos, y es específica para los distintos nichos neurogénicos. El giro dentado del hipocampo y la zona subventricular del bulbo olfatorio son los principales nichos neurogénicos, pero es aceptado que otras zonas del sistema nervioso central presentan precursores neuronales. Esta revisión discute los datos que apoyan la existencia de neurogénesis en el cerebelo adulto y propone una hipótesis sobre la relación funcional de dicho proceso con la experiencia sexual. El cerebelo tiene un desarrollo ontogénico prolongado que finaliza en la etapa posnatal, pero los escasos datos previos parecen restringir la presencia de neurogénesis en roedores a un corto periodo postnatal (21 días), dependiente de la presencia de una zona proliferativa en la capa granulosa externa. No obstante, se ha demostrado neurogénesis en cerebelo de conejo prepuber y adulto. Actualmente estamos investigando si la exposición prolongada a un ambiente enriquecido o la experiencia sexual pueden actuar como un factor estimulador de la neurogénesis cerebelar. Los datos muestran que: 1) el enriquecimiento social y sensorial produce un aumento significativo de la neurogénesis en la capa granulosa de la corteza del cerebelo en ratones adultos; 2) en ratas macho la experiencia sexual promueve de manera muy selectiva la supervivencia de nuevas neuronas, efecto que no se observa en los machos que copulan mal. Los resultados sugieren que existe neurogénesis en el cerebelo adulto y que puede ser modulada por el enriquecimiento social y la culminación de la experiencia sexual.
Palabras clave: Neurogénesis, Experiencia Sexual, Cerebelo, Ratas.
Different stimuli facilitate neurogenesis in the adult brain. These include environmental enrichment, hormones, and genetic/epigenetic factors. The dentate gyrus of the hippocampus and the subventricular zone in the olfactory bulb have been described as the main neurogenetic niches, but it is now also accepted that undifferentiated precursors could be present elsewhere in the adult with the potency to originate newborn neurons. The present review aims to discuss data supporting the existence of neurogenesis in the adult cerebellum and propose a hypothesis for the functional relationship between cerebellar neurogenesis and sexual experience. The cerebellum shows protacted neurogenesis as the ontogenetic development is completed postnatally. The proliferative capacity of the cerebellum appears to depend on the presence of an external granule layer (EGL), a proliferative layer where neuronal precursors are produced and from where they migrate. Recently, it has been described neurogenesis in adolescent and adult rabbits. However, in rodents, neurogenesis seems to be restricted to a short period of 21 postnatal days, when EGL finally disappears. In this review, we discussed new data demonstrating that: 1) social and sensorial enrichment is able to extend and increase the proliferative activity in the adult mouse cerebellum; 2) sexual experience selectively promotes survival of new-born neurons, though this effect is not observed in non-copulating male rats. Results suggest that sexual experience selectively re-wired cerebellum circuitry by allowing a few newborn neurons to survive and be integrated into cerebellar networks.
Key words: Neurogenesis, Sexual experience, Cerebellum, Rats.
1. El proceso de neurogénesis adulta.
El hallazgo de la formación de nuevas neuronas en el cerebro adulto, derivado de los trabajos de Joseph Altman en la década de los sesenta, superó uno de los dogmas fundamentales de las neurociencias que sostenía que la regeneración del Sistema Nervioso Central no puede ocurrir en etapas de la vida adulta. Utilizando la técnica de autorradiografía con timidina tritiada (timidina-3H) para marcar células en división, Altman demostró la existencia de nuevas neuronas en algunas áreas del cerebro postnatal y adulto de la rata, específicamente en el bulbo olfatorio y el giro dentado del hipocampo.1 A partir de la década de los 80, la neurogénesis adulta ha demostrado ser un fenómeno presente en aves,2-3 roedores,4-5 primates superiores6-8 y en la especie humana.9
La neurogénesis en el cerebro adulto está caracterizada por la síntesis de ADN (ácido desoxiribonucléico) que ocurre durante la fase S del ciclo celular de células progenitoras en división.10 Las células duplican su contenido y luego se dividen, proceso que tiene una duración de 24 horas en una célula de mamífero. La síntesis de ADN ocurre durante la fase S, intercalada entre G1 y G2, período que dura de 6 a 8 horas y en el cual las células producen timidina, una de las bases nitrogenadas que las células utilizan para la síntesis de ADN.11 Durante el proceso neurogénico se producen una serie de eventos de forma secuencial y ordenada: proliferación, migración/supervivencia y diferenciación, que finalmente llevan a la incorporación de las nuevas neuronas a los circuitos funcionales existentes.3 Se ha calculado que se desarrollan unas 9,000 neuronas por día, que dan lugar a la aparición mensual de 250,000 nuevas neuronas el cerebro de roedores adultos.12 Bajo determinadas condiciones ambientales, farmacológicas y hormonales las células progenitoras en estado blastocitario se diferencian y maduran como células en su mayoría con fenotipo de neurona granulosa.12 Funcionalmente, la neurogenésis adulta se ha implicado en la formación de circuitos durante el aprendizaje y la memoria,13-15 la restauración de redes neuronales tras lesión o inflamación16-17 y en el efecto terapéutico antidepresivo y antipsicótico.18
Hasta muy recientemente el proceso neurogénico en cerebro adulto parecía estar restringido a dos zonas, la zona subventricular del bulbo olfatorio5,19 y la subgranulosa del giro dentado del hipocampo.1 Sin embargo, otros lugares del sistema nervioso central como son la substancia nigra,20 la corteza piriforme,21-22 la amígdala23 y el cerebelo,24-,27 se han propuesto recientemente como nuevos nichos neurogénicos ya que albergan en su interior células con capacidad mitótica y precursores neuronales, aunque todavía es motivo de debate la evidencia de neurogénesis en estas regiones del sistema nervioso central y su relevancia funcional.
Los objetivos de esta revisión son discutir los datos obtenidos recientemente por nuestro laboratorio que apoyan la existencia de neurogénesis en el cerebelo adulto y analizar algunos factores que actúan como reguladores del proceso.
2. ¿Por qué considerar al cerebelo como un sitio neurogénico en la edad adulta?
El cerebelo tiene un desarrollo ontogenético prolongado que finaliza en la etapa posnatal. Sin embargo, en los roedores, no todas las regiones del cerebelo tienen neurogénesis postnatalmente. Por ejemplo, las grandes neuronas de Purkinje aparecen prenatalmente, adquiriendo su organización y forma final antes del día postnatal 13.28 Durante las primeras etapas del desarrollo postnatal del cerebelo de mamífero, la zona proliferante está localizada en la parte externa de la capa molecular, llamada capa granulosa externa (CGE). En esta capa de proliferación los precursores de las células granulosas migran desde el romboencéfalo.29 La migración de las células recién nacidas se produce desde la superficie de la CGE, a través de la capa molecular y de la capa de Purkinje hasta llegar a la capa granulosa interna donde finaliza el proceso de maduración (Fig. 1).
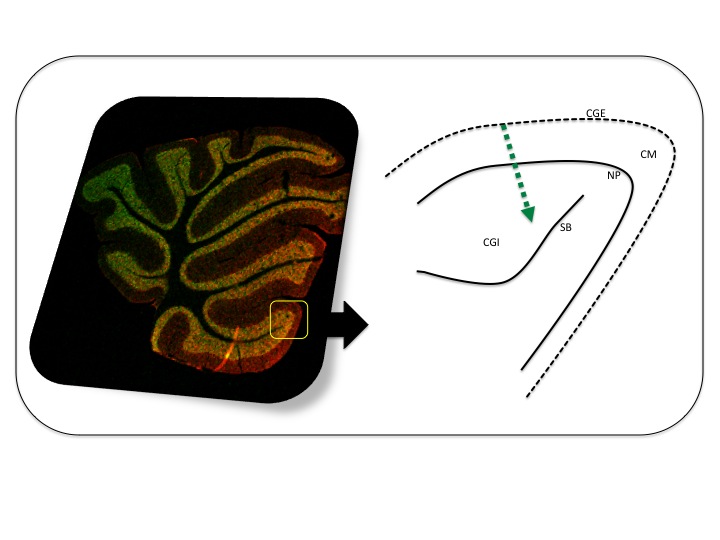
Figura 1. Corte sagital del vermis de cerebelo de ratón. Esquema con las capas que configuran la corteza del cerebelo donde ese señala con una flecha en verde la ruta migratoria de los precursores neuronales. CGE: capa granulosa externa; CGI: capa granulosa interna; NP: neuronas de Purkinje; SB: sustancia blanca; CM: capa molecular.
Este proceso madurativo dura 15 días y aproximadamente la mitad de estas células granulosas generadas llegarán a ser neuronas maduras, pero la otra mitad muere por apoptosis, tanto en la capa granulosa externa, como posteriormente en la capa granulosa interna.33-34 En los roedores, el cerebelo continúa produciendo neuronas granulosas hasta el día postnatal 21.35 A partir de aquí, la CGE comienza a desaparecer y la capacidad proliferante del cerebelo adulto también.25,32
No obstante, recientemente, Ponti y colaboradores24-25 han aportado evidencia de neurogénesis cerebelar en el conejo pre-puber y adulto. En esta especie, estos autores describen una capa subpial, que se deriva de la CGE, la cual desaparece a la cuarta semana del nacimiento. En el conejo prepuber esta capa cuenta con células progenitoras neuronales que dan paso a la formación de células bipolares establecidas en la capa molecular y células multipolares repartidas de forma homogénea en las proximidades de las células de Purkinje. En la etapa adulta, persiste la generación de nuevos elementos neuronales en la capa molecular que, en este caso, adquieren el fenotipo de interneuronas GABAérgicas. En la capa molecular, la población de interneuronas está constituida por las células estrelladas y en canasta.
Por tanto, aunque la escasa información disponible indica que la neurogénesis en el cerebro de los roedores esta restringida a un corto periodo postnatal, dependiente de la presencia de una zona proliferativa en la CGE, también se acepta que puede haber precursores neuronales en el cerebelo adulto que en determinadas condiciones pueden evolucionar a un fenotipo neuronal.26
3. Factores reguladores de la neurogénesis adulta.
En esencia la neurogénesis adulta constituye una respuesta de sintonización y adaptación al medio ambiente o a cambios impuestos en la fisiología neuronal. Por eso, su regulación se lleva a cabo por factores ambientales, hormonales, genéticos y epigenéticos, los cuales son específicos y diferente para los distintos nichos neurogénicos. Por ejemplo, el ambiente socialmente enriquecido7 y el ejercicio8 incrementan significativamente la proliferación y supervivencia de las células en el giro dentado del hipocampo y en la amígdala23 y aumentan la eficiencia sináptica entre estas nuevas neuronas, pero no afectan a la neurogénesis de las áreas olfatorias.36 Por el contrario, el enriquecimiento olfativo genera un aumento en la producción y migración de neuronas hacia el bulbo olfatorio, sin afectar a la neurogénesis del hipocampo.37
En la Tabla 1, se expone un resumen de los factores que estimulan e inhiben el proceso neurogénico. No es objeto de esta revisión discutir detenidamente todos estos factores. Los lectores interesados pueden acudir a las excelentes revisiones de Duman y colaboradores11 y de Lledo y colaboradores.12 Aquí nos centraremos en aquellos factores ambientales ligados a las experiencias de recompensa sexual y en las hormonas relacionadas que promueven la neurogénesis en cerebro adulto.
Factores que aumentan la neurogénesis adulta |
Factores que disminuyen la neurogénesis adulta |
Enriquecimiento ambiental |
Estrés |
Ejercicio voluntario |
Glucocorticoides |
Aprendizaje |
Drogas adictivas |
Conducta sexual |
Envejecimiento |
Esteroides sexuales |
|
Fármacos antidepresivos |
|
Daño neuronal e inflamación |
|
Oxitocina |
La acción de los factores reguladores en las diferentes fases del proceso también presenta especificidad. Gould y colaboradores (1999)38 encontraron que la participación en tareas de aprendizaje tiene un efecto positivo en la supervivencia de las nuevas y recién nacidas neuronas y en menor medida afecta al número de células en proliferación. En contraste, van Praag y colaboradores (1999)8 observaron que el simple ejercicio físico (sin presencia de enriquecimiento) incrementaba el número de células nuevas y por tanto, el porcentaje de neuronas maduras era mayor. Más recientemente, Kempermman y colaboradores (2006)39 utilizando el análisis de identificación y cuantificación de sitios genéticos (QTL por sus siglas en ingles: Quantitive Trait Locus) describen variaciones fenotípicas en los procesos de proliferación y supervivencia en el hipocampo de diferentes estirpes de ratón adulto. En este estudio se observa que dichas variaciones entre-estirpes se deben a la interacción entre varios QTLs y el ambiente lo que produce una diferencia en el número de células nuevas, el número de neuronas inmaduras o bien en la cantidad de neuronas maduras que se instauran como funcionales en la red del hipocampo.
Nada se conoce sobre los factores ambientales que regulan la neurogénesis en cerebelo adulto. Actualmente estamos investigando si la exposición prolongada a un ambiente enriquecido actúa como un estimulador de la neurogénesis cerebelar, tal y como se ha demostrado en el giro dentado. Nuestros datos muestran que dos meses de alojamiento enriquecido social y sensorialmente producen un potente y significativo aumento de la neurogénesis en la capa granulosa de la corteza del cerebelo en ratones adultos.27
4. Neurogénesis adulta y conducta sexual.
Para la pregunta que aborda la presente revisión es interesante el hecho de que en general la neurogénesis adulta aumenta en respuesta a situaciones ambientales que maximizan las posibilidades reproductivas. Las conductas exploratorias, sociales y sexuales que optimizan la posibilidad de sobrevivir suelen estimular la aparición de nuevas neuronas en el cerebro adulto.40 Así, todas las experiencias que producen gratificación como el ejercicio,8 el contacto social,7 la posibilidad de aprender algo38 y la conducta sexual40-41 aumentan la neurogénesis adulta. Por el contrario, las experiencias estresantes inhiben el proceso neurogénico.41-43
Tanto la experiencia sexual casual como repetida incrementan la proliferación neuronal en el giro dentado40-41 y el bulbo olfatorio.44 Es más, en las hembras expuestas a las feromonas de machos dominantes, pero no de machos no dominantes, ocurre más proliferación neuronal en los nichos antes citados.44
Por otra parte, las hormonas sexuales necesarias para la activación de la conducta sexual en hembras y machos45 también son capaces de estimular la neurogénesis adulta.6,46 En condiciones naturales, las ratas hembra muestran más proliferación neuronal en el giro dentado durante la fase del proestro (con los máximos niveles de estrógenos) que durante las fases restantes.47 En concordancia con estos resultados, la ovarectomía en ratas disminuye la proliferación celular en el giro dentado y la terapia hormonal sustitutiva con estradiol la incrementa.47-48 Sin embargo, este efecto no se observa en hembras que han sido sometidas a un periodo prolongado de ausencia de estrógenos a consecuencia de la ovarectomía,48 ni se ocurre cuando se expone continuamente a las hembras a estradiol, eliminando así los ciclos naturales típicos de este esteroide.48 Estos resultados demuestran que el proceso neurogénico se regula de forma muy fina dependiendo de los niveles endógenos de estradiol, de sus efectos a largo plazo a través de los receptores alfa y beta y de su variación cíclica.
En la amígdala medial posterior de roedores macho, la testosterona prolonga la supervivencia de las neuronas recién proliferadas en el giro dentado49 e induce proliferación, aunque no facilita su supervivencia.50 También se ha observado proliferación neuronal en el área preóptica media,51 otra parte fundamental del circuito de control de la conducta sexual. No obstante, los animales castrados no se diferencian de los gonadalmente intactos, lo que indica la insensibilidad de esta área hipotalámica a la acción proliferante de la testosterona.
5. Neuroplasticidad en el cerebelo y conducta sexual.
Aunque hasta hace muy pocos años, el cerebelo no era considerado como una de las estructuras del circuito de control de la conducta y la recompensa sexual, las evidencias más recientes sugieren su participación. En humanos y otros primates, la actividad del cerebelo aumenta durante el orgasmo femenino,52-53 la eyaculación54-55 y la mera exposición de las hembras en estro a las feromonas de machos, que no ocurre cuando las hembras se encuentran en fase no receptiva.56 Por otro lado, de forma similar a lo observado en los primates, en las ratas hembra la recompensa sexual asociada a la cópula voluntaria (pacing), pero no la asociada a la cópula forzada (nonpacing), incrementa la inmunoreactividad de la proteína c-Fos (empleada como marcador de actividad neuronal) en las neuronas de la capa granulosa.57
En roedores macho, la actividad de las neuronas de la capa granulosa ha sido relacionada con la conducta sexual.58-59 En primer lugar, se ha observado un incremento en la expresión de c-Fos después de la primera eyaculación y también después de la estimulación a distancia con feromonas procedentes de hembras en fase estral58 granulosa de los lóbulos 6 al 9 del vermis, sugiriendo que la información sensorial y motora converge en esta región. Sin embargo, a partir de la segunda y tercera eyaculación, es decir, de la ejecución de patrones motores repetidos, el número de células inmunoreactivas disminuye. En segundo lugar, se ha encontrado un incremento en la actividad eléctrica de las neuronas de la capa granulosa del vermis durante la ejecución de la primera cópula, pero una disminución después de cuatro cópulas.59 Por lo tanto, todo parece indicar que en los machos la actividad de las neuronas de la capa granulosa de la corteza del cerebelo está relacionada fundamentalmente con el procesamiento sensorial de la estimulación sexual; pero también, que la adquisición de experiencia sexual y la automatización de los patrones motores sexuales va asociada a una reducción selectiva de la actividad de las neuronas de dicha capa.
Aunque el mecanismo que subyace a dicha reducción no se conoce por el momento, es posible que esté ligado a los procesos de depresión a largo plazo (DLP) y potenciación a largo plazo (PLP), descritos en las sinapsis excitadoras que las fibras paralelas, procedentes de las células granulosas, forman con las dendritas de las neuronas de Purkinje del cerebelo Estas fibras son las derivaciones axónicas de las células granulosas y resultan ser una de las aferencias glutamatérgicas a Purkinje. DLP y PLP están finamente reguladas y equilibradas de forma bidireccional para facilitar el almacenamiento y consolidación de la memoria emocional y motora en el cerebelo.60-61 Uno de los mecanismos reguladores puede depender de la activación de los receptores endocanabinoides del tipo CB1, expresados en las fibras paralelas.62 En apoyo de esta hipótesis, se ha observado que durante la adquisición de la experiencia sexual ocurre una disminución de la densidad de receptores CB1 en los lóbulos 6 y 7 del vermis, misma que retorna a sus niveles iniciales una vez que el macho se vuelve experto.63
Recientemente, hemos estudiado el efecto de la experiencia sexual sobre la neurogénesis de la corteza del cerebelo de ratas macho adultas jóvenes. Nuestra hipótesis fue que la experiencia sexual aguda y crónica aumentaría la supervivencia de las neuronas de origen reciente. Los resultados revelaron que en los animales previamente inyectados con bromodeoxiuridina (BrdU), un análogo de la timidina que se incorpora al ADN durante la replicación celular, la experiencia sexual repetida aumentó el número de nuevas neuronas en la capa granulosa del cerebelo adulto. Sin embargo, este efecto fue selectivo ya que, el número total de neuronas maduras contabilizadas en esta capa se redujo después de 4 cópulas en comparación con los animales control que no tuvieron ninguna experiencia sexual. Uno de los resultados más sorprendentes del estudio fue que los machos clasificados como malos copuladores, es decir, aquéllos que no aprendieron a copular al final de la primera sesión, no presentaron un incremento en la tasa de neurogénesis ni reducción del número de neuronas después de múltiples cópulas.64 Estos resultados sugieren que la experiencia sexual puede dar lugar a una reorganización de los circuitos cerebelares activando el proceso de neurogénesis adulta. Estos resultados sugieren que mediante la aparición y selección de un grupo de neuronas la experiencia sexual puede dar lugar a una reorganización de los circuitos cerebelares.
La evidencia discutida en la presente revisión indica que el cerebelo está involucrado directamente en las redes neuronales de control de la recompensa sexual, así como en la adquisición y consolidación de los patrones motores sexuales. Además, sugiere la posibilidad de que la estimulación asociada con el proceso de apareamiento esté ligada al la inducción de neurogénesis adulta en la capa granulosa del cerebelo, dando lugar a la integración selectiva de nuevas neuronas en los circuitos neuronales existentes, posiblemente para sintonizar la conducta con la experiencia que se va adquiriendo”. Dado que en los animales malos copuladores no se observa un incremento de nuevas neuronas, se puede especular con la posibilidad de que éstas, al integrarse en los circuitos cerebelares activados durante los encuentros sexuales, permitan el refinamiento de los patrones motores sexuales, sintonizando la conducta a la experiencia que se va adquiriendo.
La realización del presente trabajo fue financiada por las siguientes Becas: Conacyt Reg. Nº 170664; Conacyt Reg Nº 12303 CA-28; Secretaría de Estado de Universidades e Investigación del Ministerio de Educación y Ciencia, España (PR2006-0222). Agradecemos asimismo a Gabriel Orozco Hoyuela (Instituto de Fisiología Celular. UNAM. México) por su apoyo con la microscopía confocal.
- Altman J, Das GD. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J Comp Neurol 1965 124:319-35.
- Goldman SA, Nottebohm F. Neuronal production, migration, and differentiation in a vocal control nucleus of the adult female canary brain. Proc Natl Acad Sci U S A 1983 80:2390-4
- Paton JA, Nottebohm FN. Neurons generated in the adult brain are recruited into functional circuits. Science 1984 225:1046-8.
- Reynolds BA, Weiss S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science 1992 255:1707-10.
- Lois C, Alvarez-Buylla A. Proliferating subventricular zone cells in the adult mammalian forebrain can differentiate into neurons and glia. Proc Natl Acad Sci U S A 1993 90:2074-7.
- Gould E. The effects of adrenal steroids and excitatory input on neuronal birth and survival. Ann N Y Acad Sci 1994 743:73-92.
- Kempermann G, Kuhn HG, Gage FH. More hippocampal neurons in adult mice living in an enriched environment. Nature 1997 386:493-5.
- Van Praag H, Kempermann G, Gage FH. Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nat Neurosci 1999 2:266-70.
- Eriksson PS, Perfilieva E, Björk-Eriksson T, Alborn AM, Nordborg C, Peterson DA, Gage FH. Neurogenesis in the adult human hippocampus. Nat Med 1998 4:1313-7.
- Rakic P. DNA synthesis and cell division in the adult primate brain. Ann N Y Acad Sci 1985 457:193-211.
- Duman RS, Malberg J, Nakagawa S. Regulation of adult neurogenesis by psychotropic drugs and stress. J Pharmacol Exp Ther 2001 299:401-7.
- Lledo PM, Alonso M, Grubb MS. Adult neurogenesis and funcional plasticity in neuronal circuits. Nat Rev Neurosci 2006 7:179-193.
- Garthe A, Behr J, Kempermann G. Adult-generated hippocampal neurons allow the flexible use of spatially precise learning strategies. PLoS One 2009: 4; e5464.
- Imayoshi I, Sakamoto M, Ohtsuka T, Takao K, Miyakawa T, Yamaguchi M, Mori K, Ikeda T, Itohara S, Kageyama R. Roles of continuous neurogenesis in the structural and functional integrity of the adult forebrain. Nat Neurosci 2008 10:1153-1161.
- Bruel-Jungerman E, Laroche S, Rampon C. New neurons in the dentate gyrus are involved in the expression of enhanced long-term memory following environmental enrichment. Eur J Neurosci 2005 21: 513-521.
- Hallbergson AF, Gnatenco C, Peterson DA. Neurogenesis and brain injury: managing a renewable resource for repair. J Clin Invest 2003 112:1128-33.
- Das S, Basu A. Inflammation: a new candidate in modulating adult neurogenesis. J Neurosci Res 2008 86:1199-208.
- Drew MR, Hen R. Adult hippocampal neurogenesis as target for the treatment of depression. CNS Neurol Disord Drug Targets 2007 3:205-18.
- Doetsch F, García-Verdugo JM, Alvarez-Buylla A. Regeneration of a germinal layer in the adult mammalian brain. Proc Natl Acad Sci U S A 1999 96:11619-24.
- Zhao M, Momma S, Delfani K, Carlen M, Cassidy RM, Johansson CB, Brismar H, Shupliakov O, Frisen J, Janson AM.Zhao. Evidence for neurogenesis in the adult mammalian substantia nigra. Proc Natl Acad Sci U S A 2003 100:7925-30.
- Bernier PJ, Bedard A, Vinet J, Levesque M, Parent A. Newly generated neurons in the amygdala and adjoining cortex of adult primates. Proc Natl Acad Sci U S A 2002 99:11464-9.
- Pekcec A, Löscher W, Potschka H. Neurogenesis in the adult rat piriform cortex. Neuroreport 2006 17:571-4.
- Okuda H, Tatsumi K, Makinodan M, Yamauchi T, Kishimoto T, Wanaka A. Environmental enrichment stimulates progenitor cell proliferation in the amygdala. J Neurosci Res 2009 87:3546-53.
- Ponti G, Peretto P, Bonfanti L. A subpial, transitory germinal zone forms chains of neuronal precursors in the rabbit cerebellum. Dev Biol 2006 294:168-80.
- Ponti G, Peretto P, Bonfanti L. Genesis of neuronal and glial progenitors in the cerebellar cortex of peripuberal and adult rabbits. PLoS One 2008 3:e2366.
- Bonfanti L, Ponti G. Adult mammalian neurogenesis and the New Zealand white rabbit. Vet J 2008 175:310-31.
- Vazquez-Sanroman D, Sanchis-Segura C; Toledo R; Coria-Avila GA; Lopez-Meraz L, Hernández ME, Aguilar-Roblero R, Manzo J, Miquel M. Neurogenesis in the cerebellum of adult mice in response to enrichment of the living environment. Cerebellum(submitted).
- Sotelo C, Dusart I. Intrinsic versus extrinsic determinants during the development of Purkinje cell dendrites. Neuroscience 2009 162:589-600.
- Altman J, Bayer SA. Prenatal development of the cerebellar system in the rat. I. Cytogenesis and histogenesis of the deep nuclei and the cortex of the cerebellum. J Comp Neurol 1978 179:23-48.
- Rider F, Cepko L. Migration patterns of clonally related granule cells and their progenitors in the developing chick cerebellum. Neuron1994 12:1011-1028.
- Komuro H, Rakic P. Distinct modes of neuronal migration in different domains of developing cerebellar cortex. J Neurosci 1998 18:1478-90.
- Espinosa J, Luo L. Timing neurogenesis and differentiation: insights from quantitative clonal analyses of cerebellar granule cells. J Neurol 2008 28: 2301-2312.
- Raff M, Barres B, Burne J, Coles Hs, Ishizaki Y, Jacobson M. Programmed cell death and the control of cell survival: lessons from the nervous system. Science1999 274:8347-8350.
- Wood KA, Dipasquale B, Youle J. In situ labeling of granule cells for apoptosis associated DNA fragmentation reveals different mechanisms of cell loss in developing cerebellum. Neuron 1993 11:621-632.
- Jiang Y, Kumada T, Cameron D, Komuro H. Cerebellar granule cell migration and the effects of alcohol. Dev Neurosci 2008 30:7-23.
- Brown J, Cooper-Kuhn CM, Kempermann G, Van Praag H, Winkler J, Gage FH, Kuhn HG. Enriched environment and physical activity stimulate hippocampal but not olfactory bulb neurogenesis. Eur J Neurosci 2003 17:2042-6.
- Rochefort C, Gheusi G, Vincent JD, Lledo PM. Enriched odor exposure increases the number of newborn neurons in the adult olfactory bulb and improves odor memory. J Neurosci 2002 22:2679-89.
- Gould E, Beylin A, Tanapat P, Reeves A, Shors TJ. Learning enhances adult neurogenesis in the hippocampal formation. Nat Neurosci 1999 2: 260-265.
- Kempermann G, Chesler EJ, Lu L, Williams RW, Gage FH. Natural variation and genetic covariance in adult hippocampal neurogenesis. Proc Natl Acad Sci U S A 2006 103: 780-785.
- Glasper ER, Schoenfeld TJ, Gould E. Adult neurogenesis: Optimizing hippocampal function to suit the environment. Behav Brain Res 2011.
- Leuner B, Glasper ER, Gould E. Sexual experience promotes adult neurogenesis in the hippocampus despite an initial elevation in stress hormons. PloS One 2010 5: e11597.
- Gould E, McEwen BS, Tanap P, Galea IA, Fuchs E. Neurogenesis in the dentate girus of the adult tree shrew is regulated by psicosocial stress and NMDA receptor activation. J Neurosci 1998 17: 2492-2498.
- Czéh B, Müller-Keuker JI, Rygula R, Abumaria N, Hiemke C, Domenici E, Fuchs E. Chronic social stress inhibits cell proliferation in the adult medial prefrontal cortex: hemispheric asymmetry and reversal by fluoxetine treatment. Neuropsychopharmacology 2007 32:1490-503.
- Mak GK, Enwere EK, Gregg C, Pakaraien T, Poutanen M Hutaniemi I, Weiss S. Male pheromone- stimulated neurogenesis in the adult female brain: possible role in the mating behavior. Nat Neurosci 2007 10: 1003-1011.
- Cooke BM, Woolley CS. Gonadal hormone modulation of dendrites in the mammalian CNS. J Neurobiol 2005 64: 34–46.
- Galea LAM. Gonadal hormone modulation of neurogenesis in the dentate gyrus of adult male and female rodents. Brain Res Rev 2007 57: 332-341.
- Tanapat P, Hastings NB, Reeves AJ, Gould E. Estrogen stimulates a transient increase in the number of new neurons in the dentate gyrus of the adult female rat. J Neurosci 1999 19:5792–5801.
- Tanapat P, Hastings NB, Gould E. Ovarian steroids influence cell proliferation in the dentate gyrus of the adult female rat in a dose- and time- dependent manner. J Comp Neurol 2005 481: 252-265.
- Spritzer MD, Galea, LA. Testosterone and dihydrotestosterone, but not estradiol, enhance survival of new hippocampal neurons in adult male rats. Dev. Neurobiol 2007 67: 1321–1333.
- Fowler CD, Freeman ME, Wang Z. Newly proliferated cells in the adult male amygdala are affected by gonadal steroid hormones. J Neurobiol 2003 57: 257–269.
- Antzoulatos E, Magorien JE, Ruth I. Wood R. Cell proliferation and survival in the mating circuit of adult male hamsters: Effects of testosterone and sexual behavior. Horm Behav 2008 54: 735-740.
- Komisaruk BR, Whipple B, Crawford A, Liu WC, Kalnin A, Mosier K. Brain activation during vaginocervical self-stimulation and orgasm in women with complete spinal cord injury: fMRI evidence of mediation by the vagus nerves. Brain Res 2004 1024:77–88.
- Georgiadis JR, Kortekaas R, Kuipers R, Nieuwenburg A, Pruim J, Reinders AA, et al. Regional cerebral blood flow changes associated with clitorally induced orgasm in healthy women. Eur J Neurosci 2006 24:3305–16.
- Georgiadis JR, Reinders AA, Van der Graaf FH, Paans AM, Kortekaas R. Brain activation during human male ejaculation revisited. NeuroReport 2007 18:553–7.
- Holstege G, Georgiadis JR, Paans AM, Meiners LC, van der Graaf FH, Reinders AA. Brain activation during human male ejaculation. J Neurosci 2003 23:9185–93.
- Ferris CF, Snowdon CT, King JA, Sullivan Jr JM, Ziegler TE, Olson DP, et al. Activation of neural pathways associated with sexual arousal in non-human primates. J Magn Reson Imaging 2004 19:168–75.
- Paredes-Ramos P, Pfaus JG, Miquel M, Manzo J, Coria-Avila GA. Sexual reward induces Fos In the cerebellum of female rats. Physiol & Behav 2010 102:143-148.
- Manzo J., Miquel M., Toledo R., Mayor J. A., Garcia L., Aranda-Abreu., Caba M., Hernandez M. Fos expression at the cerebellum following non-contact arousal and mating behavior in male rats. Physiol and Behav 2008 93: 357-363.
- Garcia-Martinez R, Miquel M,. Garcia LI, Coria-Avila GA; Perez CA, Aranda-Abreu GE, Toledo R, Hernandez ME, Manzo J. Multiunit recording of the cerebellar cortex, inferior olive and fastigial nucleus during copulation in naive and sexually experienced male rats. Cerebellum 2010 9: 96-102.
- Coesmans M, Weber JT, De Zeeuw CI, Hansel C. Bidirectional parallel fiber plasticity in the cerebellum under climbing fiber control. Neuron 2004 44:691-700.
- Jorntell H, Hansel C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron 2006 52:227-238.
- Kawamura Y, Fukaya M, Maejima T, Yoshida T, Miura E, Watanabe M et al. The CB1 cannabinoid receptor is the major cannabinoid receptor at excitatory presynaptic sites in the hippocampus and cerebellum. J Neurosci 2006 26:2991-3001.
- Manzo J, Miquel M, Pérez-Pochoulén M, Coria-Ávila GA, García LI, Toledo R, Hernández ML. Aprendizaje motor y receptores a canabinoides en la corteza del cerebelo. Revista eNeurobiología 2010 1:280610.
- Manzo J; Aguirre MC; Cruz JG; Ortiz CK; Miquel M. Proliferation and survival of new generated cells at the granule layer of the cerebellar vermix of adult rats during sexual training. Neuroscience Abstract 2007 San Diego,CA.
| Recibido: 8 de agosto de 2011 | Aceptado: 5 de septiembre de 2011 |
Correspondencia:
Correspondencia: Dra. Marta Miquel Salgado-Araujo, Área de Psicobiología, Universidad Jaume I., Av. Sos Baynat sn, 12071 Castellón. España., Correo: miquel@psb.uji.es
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
