Efectos de la oxitocina en motoneuronas del pubococcígeo de ratas macho con lesión espinal
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Artículo de Investigación
Effects of oxytocin on pubococcygeous motoneurons of male rats with spinal cord injury
César Antonio Pérez1*, Eduardo Chang2, María del Carmen Aguirre3, Leonor López-Meraz1*, Luis Beltrán1*, Consuelo Morgado1*, Gonzalo Emiliano Aranda1**, Luis Isauro García1+, Porfirio Carrillo4
1Programa de Neurobiología, Universidad Veracruzana, Xalapa, Ver., México. 2Maestría en Neuroetología, 3Doctorado en Neuroetología, 4Instituto de Neuroetología, *Cuerpo Académico de Neurofisiología, +Cuerpo Académico de Neurociencias, **Cuerpo Académico de Neuroquímica.
Resumen/Abstract
Introducción
Material y Métodos
Resultados
Discusión
Conclusiones
Agradecimientos
Bibliografía
Correspondencia
Introducción: Estudios previos han demostrado que después de la lesión espinal, el área del soma y la longitud de las dendritas primarias fueron reducidas en las motoneuronas del músculo Pubococcígeo de ratas macho, y la oxitocina aumentó estos parámetros. El presente estudio, analizó el número de dendritas primarias marcadas con WGA-HRP en motoneuronas del Pubococcígeo (Pc) y la longitud de dendritas secundarias en estas motoneuronas después de la lesión espinal y con tratamiento de oxitocina.
Objetivos: Determinar el efecto de la oxitocina en estas características morfológicas en motoneuronas teñidas con WGA-HRP después de la lesión de médula espinal.
Materiales y Métodos: Se utilizaron 24 ratas macho adultas Wistar agrupadas en: Intactas de la médula espinal (INT) y durante 4 semanas con implante intratecal; con 2 semanas de lesión espinal, implante intratecal- tratadas con solución salina (LE-TS) durante 2 semanas; con 2 semanas de lesión espinal y tratadas durante 2 semanas con oxitocina (LE-TOx). Las motoneuronas del Pubococcígeo fueron marcadas en forma retrógrada con WGA-HRP y posteriormente fueron sometidas a un análisis morfológico. Se usó un análisis de varianza de una vía y una prueba post hoc Dunnet para determinar diferencias significativas (p<0.05).
Resultados: Los datos mostraron que el número de dendritas primarias marcadas por motoneuronas y la longitud de dendritas secundarias fueron disminuidas en ratas con lesión espinal y la oxitocina aumentó estos parámetros a nivel de intactos.
Conclusiones: La oxitocina restauró los cambios morfológicos causados por la lesión espinal en motoneuronas distales de ratas macho.
Palabras clave: Dendritas, Motoneuronas, Oxitocina, Músculo pubococcígeo, Transporte axonal retrógrado, Núcleo paraventricular hipotalámico.
Introduction: Previous studies have demonstrated that length of primary dendrites and area of neuronal soma were reduced in rat Pubococcygeous muscle motoneurons after spinal cord injury, and oxytocin enhanced these parameters. The present study analyzed primary dendrite number-stained and length of secondary dendrites of Pubococcygeous motoneurons after spinal cord injury and treatment with oxytocin.
Objectives: To determine the effect of oxytocin on these morphological characteristics in motoneurons stained with WGA-HRP following spinal cord injury.
Material and Methods: Adult male rats Wistar were used and grouped in: intact of spinal cord with intrathecal implant during 4 weeks (INT); 2 weeks of spinal cord-lesion with intrathecal implant-and treatment with saline solution (LE-TS) during 2 weeks more; 2 weeks of spinal cord-lesion and treatment with oxytocin during 2 weeks more (LE-TOx). Pubococcygeous motoneurons were retrogradely stained with WGA-HRP and subjected to a morphological analysis. Data were analyzed by using a one way ANOVA followed by a Dunnet’s post hoc test in order to determine statistical significance (p<0.05).
Results: Data demonstrated that primary dendrite number-motoneurons stained and length of secondary dendrites were reduced in rats with spinal cord injury, and the oxytocin increased these parameters to intacts level.
Conclusions: Oxytocin restored morphological changes caused by spinal cord injury on distal motoneurons from male rats.
Keywords: Dendrites, Motoneurons, Oxytocin, Puboccygeous, Axonal retrograde transport, Paraventricular nucleus hypothalamic.
Estudios previos han mostrado que el músculo Pubococcígeo (Pc) de la rata macho participa en los procesos de micción, de emisión seminal y mantenimiento de la cola en la línea media.1-3 El músculo Pubococcígeo está inervado por un tipo de células conocidas como motoneuronas. Aunque se han realizado estudios sobre la función que tiene el Pc, las motoneuronas espinales que inervan a este músculo pélvico no han sido suficientemente estudiadas. De este modo, para comprender el papel que ejerce el músculo Pc en la fisiología de la reproducción del macho, se han realizado estudios con la utilización de la técnica de marcaje retrógrado con un neurotrazador conocido como peroxidasa de rábano acoplada a la aglutinina de germen de trigo (WGA-HRP, por sus siglas en inglés). Esta técnica permite analizar la morfología de las motoneuronas que inervan al músculo Pc y así analizar la dependencia de éstas a la fluctuación de las hormonas esteroides.
De esta manera, se ha determinado que las motoneuronas del Pc están localizadas en el núcleo ventral de la lámina IX de la médula espinal, en el segmento lumbar 6 y en el segmento sacro 1en la rata macho.4 Así mismo, este estudio demostró que la castración disminuye el área del cuerpo celular y la longitud de dendritas primarias en dichas motoneuronas mientras que el tratamiento con testosterona (durante cuatro y seis semanas) y estradiol (esta hormona de forma más rápida, pues se vio el efecto tan sólo en 2 semanas de tratamiento) revirtieron estos efectos.4 Los efectos producidos por la castración en las motoneuronas del músculo Pc fueron similares a los observados en otras motoneuronas involucradas en la erección peneana, como las del núcleo espinal del bulbocavernoso (SNB, por sus siglas en inglés), que inervan a músculos estriados en la base del pene de la rata macho.5, 6
Por lo tanto, se propone que el efecto de la aromatización de la testosterona a estradiol en el sistema nervioso central de la rata macho es un proceso fisiológico importante para la apropiada actividad de las motoneuronas del músculo Pc.
Actualmente, se desconoce si las motoneuronas del músculo del Pc tienen aromatasas en su citoplasma, pero se debe considerar que ya se ha reportado que la médula espinal de ratas macho no muestra actividad de aromatasas y carece de receptores a estradiol.7 Así, posiblemente el estrógeno influiría indirectamente en el sistema de transporte intracelular de sustancias, a través de la actividad de neuronas supraespinales, como las neuronas del núcleo paraventricular (PVN, por sus siglas en inglés) del hipotálamo y que esta influencia podría ser a través de la oxitocina liberada como mensajero sobre las motoneuronas para que éstas funcionen correctamente.
Esta propuesta está basada en estudios en donde reportan que neuronas del PVN del hipotálamo, proyectan al núcleo espinal del bulbocavernoso,8-11 y que estas neuronas hipotalámicas contienen receptores a estradiol y aromatasas.12 Cabe señalar que el PVN del hipotálamo parece ser el principal portador de péptidos como la oxitocina hacia la médula espinal ya que se ha observado que una lesión electrolítica del PVN disminuye drásticamente los niveles de oxitocina en la médula espinal.13 Así mismo, se sabe que el PVN proyecta axones que contienen oxitocina hacia la médula espinal9,14-16 para regular la actividad de neuronas autonómicas y de motoneuronas lumbares espinales. Además de la proyección de estas neuronas hipotalámicas hacia la región lumbar de la médula espinal, en donde se encuentran las motoneuronas del SNB, podrían proyectar a la región lumbosacra espinal donde se encuentran las motoneuronas del músculo Pc para regular la actividad de estas motoneuronas.
Varios experimentos se han realizado para demostrar esta teoría. Se mostró la influencia del PVN en las características morfológicas como él área del soma, la longitud de las dendritas primarias y el área de arborización dendrítica de motoneuronas del Pc en la rata macho. Para lo cual, se utilizaron machos intactos a los que se introdujo una cánula en el PVN y fueron tratados con bloqueadores de receptores a andrógenos, estrógenos y del complejo enzimático de aromatasas. En este estudio se observó que el soma y las dendritas de las motoneuronas del Pc estuvieron disminuidos de forma similar a los machos castrados.17 Además, en esta investigación se mostró que en ratas castradas, una dosis diarias de la administración intratecal de oxitocina sobre la médula espinal lumbosacra produce un aumento significativo en el soma y dendritas de las motoneuronas, en comparación con los valores obtenidos a un animal castrado y sin tratamiento, aunque éstos valores no alcanzan al de los intactos. Esto porque posiblemente una sola dosis diaria de oxitocina no es suficiente para ejercer un efecto significativo para restaurar el transporte del trazador dentro del citoplasma de las motoneuronas a niveles de intactos.
Por otro lado, se analizó el efecto producido por la lesión espinal crónica (esto es, la interrupción de la vía núcleo paraventricular hipotalámica-médula espinal lumbosacra) sobre la morfología de motoneuronas del Pc en grupos de ratas macho con 2, 4 y 6 semanas de evolución después de la sección completa transversal de la médula espinal a nivel medio torácico 8 (T8). Los datos mostraron en los grupos de ratas que tuvieron una lesión espinal durante dos, cuatro y seis semanas, una disminución significativa en el área del soma y en el área del árbol dendrítico de las motoneuronas teñidas con WGA-HRP.
Además, se analizó el efecto de la oxitocina en las características morfológicas como el área del soma y el área del árbol dendrítico de motoneuronas del Pc de ratas parapléjicas. En este estudio, se observó que en este modelo de ratas con tratamiento de oxitocina a través de una dosis constante de liberación durante 2 semanas mediante una minibomba osmótica Alzet indujo una restauración de las características morfológicas analizadas de estas motoneuronas hasta alcanzar niveles equivalentes a machos intactos. Por lo tanto, una dosis constante de oxitocina durante dos semanas promovió un aumento del transporte retrógrado intracelular de sustancias (en este caso del trazador HRP), en las motoneuronas del Pc en ratas macho con sección completa transversal de la médula espinal torácica.14
A pesar de que en estudios previos fueron analizados parámetros como el área del soma y la longitud de las dendritas primarias, se ha considerado para la presente investigación un análisis sobre otras características morfológicas en las motoneuronas del Pc. Esta investigación detallará de manera sistemática los efectos del tratamiento con oxitocina en ratas con una lesión espinal.
2.1 Sujetos
Se utilizaron 24 ratas macho de la cepa Wistar las cuales fueron distribuidas aleatoriamente en tres grupos (n=8 en cada grupo) con un peso de 250-350 gr. Se mantuvieron en jaulas de acrílico colectivas (50x30x20 cm; 4 animales por jaula), previamente acondicionadas con una cama de aserrín. Las jaulas estuvieron en un bioterio mantenido a temperatura ambiente, con un ciclo invertido luz-obscuridad de 12:12 hrs. (encendido de la luz, 20:00 hrs). El agua y el alimento (Nutricubos para roedores, Purina, México), se les proporcionó ad libitum.
El diseño experimental fue guiado bajo los estándares que señala la Norma Oficial Mexicana (NOM-062-ZOO-1999) para el uso y manejo de animales de laboratorio y apoyada también en las Políticas del Uso de Animales en la Investigación en Neurociencias por la Sociedad de Neurociencias (Society for Neuroscience).
Las ratas estuvieron agrupadas de la siguiente manera:
Intactas de la médula espinal y durante 4 semanas con implante intratecal (INT). Este fue considerado como grupo control.
Con 2 semanas de lesión espinal, implante intratecal-minibomba Alzet la cual contuvo solución salina (LE-TS) durante otras 2 semanas.
Con 2 semanas de lesión espinal y tratadas durante 2 semanas con oxitocina (LE-TOx).
Se utilizó oxitocina (SIGMA, T-2899; TYR-PRO-LEU-GLY AMIDE; [Tyr6 ]–Oxytocin fragment 6–9) para la administración intratecal (236ml aproximadamente de volumen total por animal a una concentración de 10 mM).
La peroxidasa de rábano utilizada fue la siguiente: SIGMA (L-3892), Lectin from Triticum vulgaris (wheat germ), peroxidase labeled.
A los tres grupos de ratas, una vez anestesiadas con pentobarbital sódico (30 mg/kg de peso), se les implantó un tubo de polietileno de forma intratecal (en la membrana occipitoatloidea), cinco días después se les realizó una lesión espinal que consistió en una sección completa transversal en el segmento espinal T8, excepto al grupo de intactos. El tubo intratecal fue colocado antes de la sección de la médula espinal. Después de la lesión, una minibomba osmótica Alzet (Model 2002, ALZA corporation) fue conectada en la parte externa final del tubo. Este modelo de minibomba está fabricado para liberar constantemente por dos semanas 0.5 ml/hr de droga, en este caso de solución salina o de oxitocina (10 mM). Después de la preparación de la minibomba, ésta fue colocada subcutáneamente en la nuca del cuello.
2.2 Inyección de la HRP en el músculo Pubococcígeo (Pc)
Después de cada tratamiento, dependiendo del grupo a que corresponda, la rata bajo anestesia, se colocó en una unidad espinal en posición decúbito dorsal, luego se realizó una incisión longitudinal en la línea media abdominal, las vísceras pélvicas fueron desplazadas cuidadosamente para localizar y visualizar la región proximal del Pc. Con la ayuda de un microscopio de cirugía Olympus el músculo fue inyectado en la mitad anterior con 25 mg de peroxidasa de rábano (HRP), diluida en 5 ml de dimetilsulfóxido al 1%. El músculo y la piel fueron suturadas, la rata se colocó en una jaula a una temperatura de 28 °C hasta su recuperación y posteriormente se trasladó nuevamente al bioterio. Después de 48 hrs de la cirugía, la rata fue anestesiada con una dosis mayor de pentobarbital sódico (50 mg/kg de peso, i.p.), y finalmente se le realizó una perfusión transcardíaca.
2.3 Perfusión transcardíaca
La rata previamente anestesiada, se le abrió el tórax y después se realizó una incisión en la cavidad ventricular izquierda del corazón, para colocarle la cánula conectada a una bomba de perfusión (Masterflex, modelo 7518-12) a una velocidad de 20 ml/min, la cánula quedó sujetada con una pinza para poder introducir las sustancias y evitar la fuga de la misma. Posteriormente se le realizó una incisión en la cavidad auricular superior derecha del corazón para facilitar la salida de sangre y las substancias de perfusión. Primero se perfundió con solución salina heparinizada (0.09%, 500 ml) a temperatura ambiente. Inmediatamente se procedió a realizar la fijación del tejido con una solución fijadora compuesta de paraformaldehído al 1% y glutaraldehído al 1.25% disueltos en un amortiguador de buffer de fosfatos (0.1 M, pH 7.4; 800 ml) a temperatura ambiente. Finalmente se le administró buffer-sacarosa al 10% a 4 °C (600 ml), para proteger al tejido de la baja temperatura (-20 °C) en el que se realizaron cortes transversales con un microtomo de congelación.
2.4 Extracción de la médula espinal y obtención de cortes
Después de la perfusión, se le realizó una laminectomía de la vértebra T13 a la vértebra S1 para visualizar la médula espinal desde la región sacra hasta la región toraco-lumbar y, guiándonos por los segmentos de la clasificación vertebral en rata, se realizó un corte para extraer el segmento de la médula lumbo-sacra en donde están localizadas las motoneuronas a analizar. El segmento de médula se almacenó durante 72 hr en solución buffer-sacarosa a 4 °C. Posteriormente se congeló la médula lumbosacra en hielo seco (a –20 °C), mediante un microtomo de congelación (Leica CM 1850) para realizar cortes transversales a 40 µm de espesor. Se colocaron los cortes en solución de buffer de fosfato sin sacarosa. Los cortes fueron progresivos y estuvieron separados en grupos de 10 cortes. Al finalizar los cortes, todos se transfirieron a buffer de fosfato fresco sin sacarosa. Ahí se mantuvieron a 4 °C durante 48 horas.
2.5 Técnica histológica de WGA-HRP
Después de cada tratamiento, las motoneuronas del músculo Pc fueron marcadas retrógradamente con WGA-HRP. Para ello se lavaron los cortes en dos cambios de agua destilada (30 seg. c/u). Se sumergieron en la solución de incubación (buffer de acetato de sodio de pH=3.3, nitroferricianuro de sodio y agua destilada + tetrametilbenzidina y etanol absoluto) y se colocó el recipiente que contiene los cortes en agitación durante 20 min. Se removieron los cortes de la solución de incubación y luego se añadió solución de peróxido de hidrógeno 0.3%. Se reintrodujeron a la solución y se dejaron 20 min. Posteriormente se lavaron en seis cambios por un lapso de 30 min. en la solución para lavados (buffer de acetato de sodio de pH=3.3 y agua destilada) mantenida a 4 °C. Los cortes se dejaron en el último lavado hasta antes de ser montados. Los cortes fueron montados a temperatura ambiente de la solución para lavados a los portaobjetos gelatinizados, luego se secaron a temperatura ambiente por 24 horas. Se realizó el proceso de la contratinción, introduciendo todos los portaobjetos por 3 min. en una solución de rojo neutro 1% (rojo neutro y agua destilada, eliminando 30 ml de buffer de acetato de pH= 4.8). Se introdujeron todos los portaobjetos de manera consecutiva en: a) agua destilada por 10 seg.; b) etanol al 70% por 10 seg.; c) etanol al 95% por 10 seg.; d) etanol al 100% por 10 seg.; e) se repitió el etanol al 100% en 10 seg.; f) xileno por 2 min.; g) se repitió el xileno por 2 min. Finalmente, se dejan secar a temperatura ambiente y se cubrieron con cubreobjetos utilizando permount (Fisher scientificTM).
2.6 Análisis morfológico de las motoneuronas del Pc
Las motoneuronas marcadas fueron observadas en un microscopio de luz (Olympus, mod. U-PMTVC, No. OB4109). El microscopio tiene adaptada una cámara fotográfica (Olympus, OM 2000) para obtener impresiones en papel de las motoneuronas. Las fotomicrografías fueron obtenidas con la cámara. Las imágenes en video fueron obtenidas usando una video cámara (CCD Hitachi, KP-D51) conectada a una tarjeta Pcvisionplus Frame Grabber que estuvo conectada a una computadora (Pentium Hewlett Packard PC). El Frame Grabber envía la imagen a un monitor, y utiliza el JAVA Software (Jandel Scientific, USA) instalado en la computadora para obtener el análisis morfométrico de las motoneuronas. Los parámetros analizados fueron los siguientes: Número de motoneuronas marcadas con WGA-HRP por sujeto; número total de motoneuronas analizadas de su morfología; número de dendritas primarias marcadas con WGA-HRP por motoneurona; proporción de motoneuronas que muestran dendritas secundarias; longitud de dendritas secundarias; y el número de dendritas secundarias marcadas por motoneurona. Los números obtenidos del análisis de estos parámetros fueron vaciados en el paquete estadístico GB-STAT para Windows, en el cual se realizaron las pruebas estadísticas pertinentes. En este caso se realizó el análisis de varianza de una vía, para la comparación intergrupal fue considerado un valor significativo de *p<0.05, estas diferencias particulares fueron detectadas con la prueba post hoc de Dunnet.
Las motoneuronas del Pc fueron marcadas en la porción caudal del segmento lumbar 6 y de la mitad rostral del segmento espinal sacro 1, y se encontraron ipsilateralmente al sitio de la inyección de la WGA-HRP.
El análisis se realizó en motoneuronas de segmentos distales al sitio de lesión (de L6-S1) en secciones transversales. En dicho análisis se mostró marcaje con la WGA-HRP en motoneuronas del Pc en ratas machos de todos los grupos utilizados. El análisis fue realizado en motoneuronas individuales o en caso de que estuvieran agrupadas no presentaran la dificultad de medir sus dendritas entrelazadas unas con otras y así no crear una confusión sobre el origen del soma al que pertenecían. Este marcaje retrógrado con el trazador en las dendritas primarias y secundarias tuvo proyecciones hacia las regiones dorsal, medial y ventral de la sustancia gris de la médula espinal (Fig. 1).
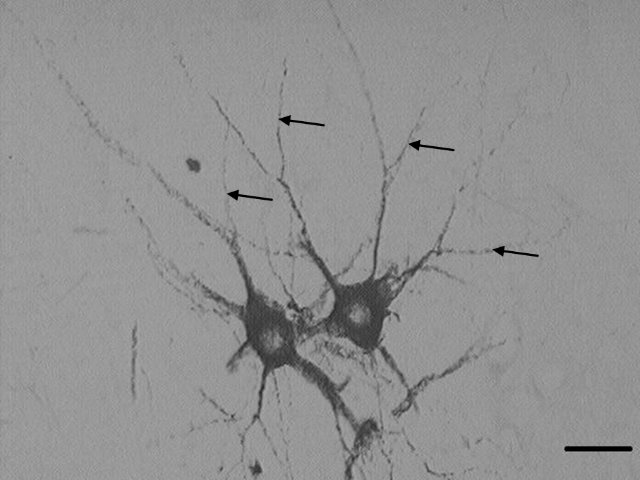
Figura. 1. Corte transversal donde se muestra la distribución de la WGA-HRP en las motoneuronas del Pc en la rata macho con lesión espinal y tratada con oxitocina. Como se observa, la oxitocina indujo un marcaje en dendritas secundarias (señaladas con flechas) por lo que promovió una mejor distribución del neurotrazador dentro del citoplasma de las motoneuronas. La barra de calibración indica 40 µm de longitud.
Dendritas primarias marcadas por motoneurona. Los resultados obtenidos mostraron que la oxitocina indujo un aumento significativo en este parámetro analizado en comparación a los valores de los intactos, por lo que revirtió el efecto producido por la lesión espinal (Fig. 2).
.
Figura 2. Los datos muestran la media y error estándar en el que se observa una disminución significativa en el grupo de ratas con lesión espinal y sin tratamiento (LE-TS) y un aumento significativo en el grupo de tratamiento con la oxitocina (LE-TOx). ANOVA 1 vía, post hoc Dunnet; *p< 0.05 y **p<.01 con respecto al grupo Intacto.
Longitud de dendritas secundarias. Los resultados obtenidos mostraron que la oxitocina indujo un aumento en este parámetro que alcanzan valores similares a los del grupo de intactos, por lo que restauró el efecto producido por la lesión espinal (Fig. 3).
Figura 3. Los datos muestran la media y error estándar en el que se observa una disminución significativa en el grupo de ratas con lesión espinal y sin tratamiento (LE-TS) y valores equivalentes en el grupo de tratamiento con la oxitocina (LE-TOx) con los valores de intactos. ANOVA 1 vía, post hoc Dunnet; **p< 0.01 con respecto al grupo Intacto.
Cuando se obtuvieron los valores de las características morfológicas analizadas en este estudio en las motoneuronas que inervan al músculo Pc en los diferentes grupos, se observó que no todos los parámetros analizados tuvieron diferencias significativas, tal fue el caso para el número de motoneuronas marcadas con WGA-HRP por sujeto y el número de dendritas secundarias marcadas por motoneurona. Sin embargo, hubo significancia en relación a parámetros como el número de dendritas primarias marcadas con WGA-HRP por motoneurona y la longitud de las dendritas secundarias (Tabla 1).
Parámetro |
INT |
LE-TS |
LE-TOx |
Estadística |
Número de motoneuronas por sujeto |
39.37 + 4.02 |
30.62 + 5.47 |
37.50 + 4.59 |
F (2,23) = 0.94 |
Número total de motoneuronas analizadas de su morfología |
223 |
181 |
212 |
|
Número de dendritas primarias por motoneurona |
3.82 + .07 |
3.58 + .07** |
4.08 + .07 * |
F (2,615) = 11.13 |
Proporción de motoneuronas que muestran dendritas secundarias |
143/223 |
98/181 |
140/212 |
|
Longitud de dendritas secundarias |
38.39 + 1.33 |
33.97 + 1.55** |
42.06 + 1.57 |
F (2,648) = 6.35 |
Número de dendritas secundarias marcadas por motoneurona |
1.67 + .07 |
1.58 + .07 |
1.78 + .08 |
F (2,382) = 1.38 |
Tabla 1. Características morfológicas analizadas de motoneuronas del Pc retrógradamente marcadas con WGA-HRP de ratas intactas (INT); con lesión espinal y sin tratamiento (LE-TS); y con lesión espinal tratada con oxitocina (LE-TOx). Los datos son presentados como media + error estándar y fueron comparados utilizando ANOVA 1 vía, post hoc Dunnet. Las comparaciones con el grupo INT *p< 0.05 y **p<.0.01.
Los resultados mostraron que parámetros como el número de motoneuronas marcadas con WGA-HRP por sujeto y el número de dendritas secundarias marcadas por motoneuronas, no hay diferencias significativas entre los diferentes grupos. Esto indica que la lesión espinal torácica no afectó la cantidad de motoneuronas distales marcadas con el trazador al sitio dañado como las del Pc. Esto concuerda con lo reportado por McBride y Feringa, donde reportan que no se afecta el número de motoneuronas espinales en regiones rostrocaudales de ratas con sección transversal torácica 9 durante 10, 20 o 52 semanas de evolución de la lesión, por lo que no ocurrió degeneración transneuronal.18
En cambio, en el grupo de la lesión espinal sin tratamiento disminuyó la longitud de dendritas secundarias, y los valores para este mismo parámetro fueron similares en el grupo de intactos versus grupo lesión espinal y con tratamiento de la Ox. Así mismo, para el número de dendritas primarias marcadas, el grupo de lesión espinal sin tratamiento presentó una disminución significativa y esto fue revertido en el grupo de lesión espinal y con tratamiento de Ox.
Aunque ya se ha reportado sobre los efectos de esteroides en el marcaje retrógrado con WGA-HRP sobre otras motoneuronas como las del núcleo espinal bulbocavernoso y del núcleo dorsolateral de la médula espinal lumbar,6, 19 nuestros resultados podrían ir de acuerdo a las posibles hipótesis propuestas: La primera hipótesis, postula que los cambios en los niveles de andrógenos durante la etapa adulta están asociados con alteraciones significativas en la estructura y función de estas neuronas.6 La segunda hipótesis, en la cual apoyamos los resultados de todos nuestros estudios realizados en las motoneuronas del Pc, propone que la testosterona podría afectar la velocidad o cantidad de transporte de materiales desde el soma de las motoneuronas del SNB a las dendritas. Esta última hipótesis está apoyada por el estudio realizado en ratas macho, donde se mostró, por iontoforésis intracelular con peroxidasa de rábano, que no se encontraron diferencias significativas en cuanto al número y la longitud de las dendritas de motoneuronas del SNB en los grupos de ratas intactas y ratas que estuvieron castradas por cuatro semanas.20 El efecto parece estar principalmente en el transporte del trazador HRP, pero no existe una fuerte evidencia de que los andrógenos hayan causado alteraciones drásticas estructurales de las dendritas del SNB en ratas macho adultas. De esta manera, la WGA-HRP además de mostrar un dato morfológico por la misma tinción de la célula, podría representar el estado funcional de la célula. Es decir, se ha propuesto que la tinción intracelular podría indicar la actividad de la neurona y que esta actividad reflejaría el sistema de transporte retrógrado de sustancias, en este caso, del neurotrazador en el citoplasma de la motoneurona. Esto hace suponer, que los efectos que observamos por la manipulación de la testosterona en los estudios previos representan la distribución del trazador HRP dentro del citoplasma de la neurona, pero no el tamaño completo o total de la neurona teñida. Esto explicaría lo que hemos observado en nuestros estudios anteriores sobre los efectos de la fluctuación de hormonas esteroides en el marcaje retrógrado con WGA-HRP sobre las motoneuronas del Pc.4, 14
Si esto es cierto, tanto motoneuronas del grupo de intactos y motoneuronas del grupo de lesión espinal son iguales en tamaño, entonces la lesión redujo el transporte del trazador en las motoneuronas y no afectó el tamaño de éstas. De tal manera, los resultados mostraron que la Ox indujo un aumento significativo en el transporte retrógrado intracelular en la rata macho con lesión espinal teniendo valores equivalentes al de intactos. Así, estos datos muestran que la administración exógena de la Ox revirtió el efecto producido por la lesión espinal sobre el marcaje retrógrado con el trazador y no en el tamaño de las motoneuronas del Pc en ratas macho. Esto es importante porque la Ox activaría el sistema de transportación intracelular de sustancias de motoneuronas distales al sitio dañado. De hecho, un resultado interesante fue que la Ox promovió una distribución del trazador en las dendritas secundarias en sujetos con lesión espinal. Esto ha sido observado en estudios previos sobre las dendritas primarias en motoneuronas del Pc,4, 14 es decir, la Ox ejerció efectos en las dendritas que son las estructuras principales de comunicación entre las neuronas.
Se desconoce si las motoneuronas del Pc son más grandes en tamaño y tampoco se sabe si tienen receptores a Ox, pero suponemos que las dendritas de las motoneuronas del Pc si son más grandes en tamaño y que si tienen receptores a Ox, de tal manera que las dendritas de las motoneuronas podrían extenderse a las áreas donde se ha observado que llegan los axones del PVN,10, 15 y lo que observamos en nuestros resultados fue el desplazamiento del trazador WGA-HRP dentro de las motoneuronas entre los diferentes grupos utilizados. Así, proponemos la existencia de una conexión núcleo paraventricular hipotalámico- motoneuronas del Pc, así como se ha demostrado para otras motoneuronas de médula espinal lumbar involucradas en eventos reproductivos.11, 21 En este circuito, suponemos que el efecto de la Ox en el sistema de transporte de sustancias de las motoneuronas sería a través del siguiente mecanismo: neuronas del PVN del hipotálamo, envían sus axones a las dendritas de motoneuronas lumbosacras como aquellas que inervan al músculo Pc. De tal forma que estas neuronas del PVN cuando capturan a la testosterona que se encuentra a nivel sistémico luego la convierte a estradiol por medio de las aromatasas, esto provocaría la liberación de mensajeros de tipo peptídico como la Ox para promover la adecuada actividad o función en el sistema de transporte intracelular de sustancias en estas motoneuronas espinales. Esta comunicación entre PVN y motoneuronas lumbosacras mantendrían el circuito funcionando de forma correcta para su participación en procesos motores y/o autonómicos (erección peneana en el caso de las motoneuronas del SNB; procesos de micción, emisión seminal y movimiento de la cola en el caso de las motoneuronas del Pc). Por lo tanto, en una rata con lesión espinal este circuito estaría interrumpido o dañado, de tal manera que la administración exógena de Ox reactivaría a las motoneuronas espinales debajo del sitio de lesión, esto es, estas neuronas que no reciben esta señal oxitocinérgica del PVN de manera natural, restaurarían su función dañada, tanto del soma o cuerpo celular como de sus dendritas.
Por otro lado, se sabe que la lesión de médula espinal afecta otros sitios o circuitos distales al sitio local dañado, es decir, se ha reportado que la lesión espinal altera la actividad neural de estructuras como el PVN y Núcleo Supraóptico del hipotálamo,22 así como la actividad neural de estructuras del tallo cerebral como son el área postrema, el núcleo del tracto solitario y la formación reticular23 en ratas macho. Así, existen estudios que han mostrado que la contusión espinal aumentó significativamente la actividad neural en estas áreas cerebrales, por lo que dicha actividad neural estaría asociada a procesos bioquímicos, inflamatorios y procesos isquémicos que suceden de inmediato a la lesión. Nuestros resultados mostraron que la lesión espinal torácica afectó el marcaje retrógrado de motoneuronas de una región distal al sitio de lesión como lo fue el área lumbosacra.
Sin embargo, se debe considerar la significancia funcional de nuestros resultados, ya que los datos mostraron que en ratas macho después de dos semanas con lesión espinal podrían tener la capacidad de activar sus motoneuronas distales, mediante la estimulación exógena adecuada, en este caso, por la Ox intratecal. Es decir, la Ox podría tener efectos benéficos como el inducir la activación de motoneuronas en sujetos con lesión de médula espinal que estarían en un periodo asociado a procesos bioquímicos que formen parte del daño secundario, con la consecuente posibilidad de influir en la actividad de sus músculos blanco para generar movimiento durante un tiempo apropiado de tratamiento. Este tipo de estudios requiere de futuras investigaciones para fortalecer esta propuesta como parte de las estrategias para la rehabilitación en sujetos con lesión espinal.
La lesión espinal redujo el número de dendritas primarias marcadas con WGA-HRP y la longitud de dendritas secundarias en motoneuronas del Pc de ratas macho, en tanto que la oxitocina revirtió estos efectos de estas motoneuronas, un hallazgo significativo como estrategia en la rehabilitación y/o reparación en sujetos con lesión espinal.
Se agradece al PROMEP donativo de proyecto (C.A.P.; NPTC-244), autorizado mediante Oficio No. PROMEP/103.5/07/2753 y al CONACYT por Beca de Posgrado (E.Ch.; No. de beca 235969).
- Manzo J, Esquivel A, Hernandez ME, Carrillo P, Martinez-Gomez M, Pacheco P. The role of pubococcygeus muscle in urinary continence in the male rat. J Urol 1997 157:2402-2406.
- Manzo J, Vazquez MI, Cruz MR, Hernandez ME, Carrillo P, Pacheco P. Fertility ratio in male rats: effects after denervation of two pelvic floor muscles. Physiol Behav 2000 68:611-618.
- Manzo J, Garcia LI, Hernandez ME, Carrillo P, Pacheco P. Neuroendocrine control of urine-marking behavior in male rats. Physiol Behav 2002 75:25-32.
- Manzo J, Nicolas L, Hernandez ME, Cruz MR, Carrillo P, Pacheco P. Spinal organization and steroid sensitivity of motoneurons innervating the pubococcygeus muscle in the male rat. J Comp Neurol 1999 409:358-368.
- Arnold AP, Gorski RA. Gonadal steroid induction of structural sex differences in the central nervous system. Annu Rev Neurosci 1984 7:413-442.
- Kurz EM, Sengelaub DR, Arnold AP. Androgens regulate the dendritic length of mammalian motoneurons in adulthood. Science 1986 232:395-398.
- MacLusky NJ, Clark CR, Shanabrough M, Naftolin F. Metabolism and binding of androgens in the spinal cord of the rat. Brain Res 1987 422:83-91.
- Monaghan EP, Breedlove SM. Brain sites projecting to the spinal nucleus of the bulbocavernosus. J Comp Neurol 1991 307:370-374.
- Sawchenko PE, Swanson LW. Immunohistochemical identification of neurons in the paraventricular nucleus of the hypothalamus that project to the medulla or to the spinal cord in the rat. J Comp Neurol 1982 205:260-272.
- Shen P, Arnold AP, Micevych PE. Supraspinal projections to the ventromedial lumbar spinal cord in adult male rats. J Comp Neurol 1990 300:263-272.
- Wagner CK, Clemens LG. Projections of the paraventricular nucleus of the hypothalamus to the sexually dimorphic lumbosacral region of the spinal cord. Brain Res 1991 539:254-262.
- Wagner CK, Sisk CL, Clemens LG. Neurons in the paraventricular nucleus of the hypothalamus that project to the sexually dimorphic lower lumbar spinal cord concentrate 3H-estradiol in the male rat. J Neuroendocrinol 1993 5:545-551.
- Hawthorn J, Ang VT, Jenkins JS. Effects of lesions in the hypothalamic paraventricular, supraoptic and suprachiasmatic nuclei on vasopressin and oxytocin in rat brain and spinal cord. Brain Res 1985 346:51-57.
- Swanson LW, McKellar S. The distribution of oxytocin- and neurophysin-stained fibers in the spinal cord of the rat and monkey. J Comp Neurol 1979 188:87-106.
- Tang Y, Rampin O, Calas A, Facchinetti P, Giuliano F. Oxytocinergic and serotonergic innervation of identified lumbosacral nuclei controlling penile erection in the male rat. Neuroscience 1998 82:241-254.
- Wagner CK, Clemens LG. Neurophysin-containing pathway from the paraventricular nucleus of the hypothalamus to a sexually dimorphic motor nucleus in lumbar spinal cord. J Comp Neurol 1993 336:106-116.
- Perez CA, Concha A, Hernandez ME, Manzo J. Influence of the paraventricular nucleus and oxytocin on the retrograde stain of pubococcygeus muscle motoneurons in male rats. Brain Res 2005 1041:11-18.
- McBride RL, Feringa ER. Ventral horn motoneurons 10, 20 and 52 weeks after T-9 spinal cord transection. Brain Res Bull 1992 28:57-60.
- Sengelaub DR, Jordan CL, Kurz EM, Arnold AP. Hormonal control of neuron number in sexually dimorphic spinal nuclei of the rat: II. Development of the spinal nucleus of the bulbocavernosus in androgen-insensitive (Tfm) rats. J Comp Neurol 1989 280:630-636.
- Sasaki M, Arnold AP. Androgenic regulation of dendritic trees of motoneurons in the spinal nucleus of the bulbocavernosus: reconstruction after intracellular iontophoresis of horseradish peroxidase. J Comp Neurol 1991 308:11-27.
- Rousselot P, Papadopoulos G, Merighi A, Poulain DA, Theodosis DT. Oxytocinergic innervation of the rat spinal cord. An electron microscopic study. Brain Res 1990 529:178-184.
- Xu Y, Zheng Z, Ho KP, Qian Z. Effects of spinal cord injury on c-fos expression in hypothalamic paraventricular nucleus and supraoptic nucleus in rats. Brain Res 2006 1087:175-179.
- Del Bel EA, Borges CA, Defino HL, Guimaraes FS. Induction of Fos protein immunoreactivity by spinal cord contusion. Braz J Med Biol Res 2000 33:521-528.
| Recibido: 15 de febrero de 2011 | Aceptado: 15 de marzo de 2011 |
Correspondencia:
Correspondencia: Dr. Cesar Antonio Perez Estudillo, Programa de Neurobiología, Universidad Veracruzana, Xalapa, Ver., Tel.: (228) 841-8900 Ext. 13609, Correo: cesperez@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
