Inducción de status epilepticus durante las fases de luz/oscuridad del día y efecto sobre la muerte neuronal en el hipocampo en la rata en desarrollo
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Artículo de Investigación
Induction of status epilepticus during the light/dark phases of day and effect on hippocampal neuronal cell death in the developing rat
María-Leonor López-Meraz 1,2,&,*, Dulce Mariely Álvarez Croda1,2, Alery Platas3, César A. Pérez-Estudillo 1,2,&, María Eva González-Trujano4, Luisa L. Rocha5, María Elena Hernández1,2,#, Jorge Manzo1,2,@
1Programa de Neurobiología, 2Posgrado en Neuroetología, 3Facultad de Medicina, Universidad Veracruzana, Xalapa, Ver., México. 4Dirección de Investigaciones en Neurociencias, Instituto Nacional de Psiquiatría, 5Centro de Investigación y Estudios Avanzados del I.P.N. Ciudad de México &Cuerpo académico de Neurofisiología, #Cuerpo académico de Neuroquímica, @Cuerpo académico de Neurociencias.
Resumen/Abstract
Introducción
Material y Métodos
Resultados
Discusión
Conclusiones
Agradecimientos
Bibliografía
Correspondencia
Introducción: El status epilepticus (SE) es una condición neurológica caracterizada por la presentación de crisis epilépticas continuas por un tiempo prolongado o por crisis intermitentes sin la recuperación completa del individuo entre las mismas. Su incidencia es mayor en sujetos en desarrollo y causa muerte neuronal en diversas áreas cerebrales, siendo el hipocampo una región altamente sensible. Existe evidencia que muestra una variación circádica en la presentación de las crisis epilépticas tanto en humanos como en modelos experimentales de epilepsia.
Objetivo: Analizar la evolución del SE en ratas en desarrollo inducido durante las fases de luz y oscuridad del día y evaluar el consecuente daño neuronal en el hipocampo.
Material y métodos: El SE se indujo con el modelo de litio-pilocarpina en ratas de 14 días de edad durante la fase de luz o de oscuridad del día. Se monitoreó la conducta convulsiva durante el SE y 24 h después se identificaron células muertas en el hipocampo utilizando la tinción de hematoxilina-eosina.
Resultados: La incidencia, latencia y severidad del SE fueron similares cuando se indujo durante la fase de luz y de oscuridad del día. El SE causó muerte neuronal en las regiones subículo-CA1 y giro dentado del hipocampo, un efecto que fue indistinto de la fase del ciclo luz/oscuridad durante el cual se produjo.
Conclusiones: La fase del ciclo luz/oscuridad durante la cual se indujo el SE en la rata en desarrollo no modificó su severidad ni el subsecuente daño neuronal que se presenta en el hipocampo.
Palabras clave: Status epilepticus, muerte neuronal, hipocampo, área CA1, giro dentado.
Introduction: Status epilepticus (SE) is a neurological condition characterized by continues seizures during a prolonged period or by seizures occurring so frequently that patient does not fully recover from one seizure before having another. SE occurs with high incidence in children and causes neuronal cell death in several brain regions, mainly in the hippocampus. Evidence shows a circadian variation in epileptic seizure progression in both, humans and experimental models of epilepsy.
Objective: To study the effect of the light/darkness cycle on seizure activity during SE induced in developing rats and on hippocampal neuronal damage.
Material and Methods: SE was induced in fourteen days old rat pups either during the light or darkness phase of day by using the lithium-pilocarpine model. Seizure severity was evaluated during SE and 24 h later, neuronal cell death in hippocampus was analyzed with hematoxylin-eosin staining.
Results: Incidence, latency and duration of SE in developing rats were similar when induced during the light and darkness phases of day. SE produced neuronal cell death in subiculum-CA1 and dentate gyrus fields, effect that was independent of light-darkness periods.
Conclusion: No differences were detected in seizure severity when SE was induced during the light or darkness phases of day in the immature rat, neither in the neuronal cell death observed in the hippocampus.
Keywords: Status epilepticus, neuronal cell death, hippocampus, subículo-CA1 field, dentate gyrus.
La liga internacional contra la epilepsia (ILAE por sus siglas en inglés) contempla al estado epiléptico o status epilepticus (SE) en las crisis continuas;1 lo anterior considerando que el SE es una condición neurológica aguda caracterizada por crisis epilépticas continuas por un tiempo prolongado (parciales o generalizadas, convulsivas o no convulsivas) o por crisis epilépticas intermitentes sin que individuo recupere por completo la consciencia entre éstas.2 Datos epidemiológicos indican que el cerebro en desarrollo es altamente sensible a experimentar crisis epilépticas3 y de hecho, el SE ocurre más frecuentemente en niños que en adultos.4, 5 Estudios prospectivos y retrospectivos han determinado que el riesgo de padecer epilepsia posterior a un episodio de SE en la etapa infantil puede ser de 15 a 50%.6-8Un modelo ampliamente utilizado para inducir SE en animales de experimentación es el que emplea cloruro de litio y pilocarpina. Con este modelo se han caracterizado zonas de muerte neuronal causado por el SE en el cerebro de la rata en desarrollo que incluyen principalmente el área CA1, el subículo, el hilus y el giro dentado del hipocampo, así como en áreas extrahipocampales como la corteza, la amígdala y el tálamo.9-11Por otro lado, existe evidencia que apunta que las crisis epilépticas son susceptibles de modulación circadiana tanto en animales de experimentación como en humanos.12 La epileptogénesis inducida por el fenómeno “kindling” tras la estimulación eléctrica de la amígdala, se facilita cuando el proceso se realiza durante la fase de noche.13 El efecto del convulsivante pilocarpina en ratas adultas también presenta una variación si se aplica durante la fase de luz u oscuridad. La actividad epiléptica se generaliza más rápidamente durante la fase de oscuridad y los animales muestran carreras violentas y extensión tónica; mientras que durante la fase de luz, las ratas presentan crisis generalizadas con mioclonias de miembros anteriores y pérdida de la postura, típicas de este modelo, pero con una latencia mayor.14 De manera similar, la aplicación intrahipocampal de ácido kaínico (AK) en ratas adultas produce SE y subsecuentemente crisis espontáneas, con una mayor frecuencia durante el periodo de luz.15 Sin embargo, otros autores proponen que a pesar de que el AK promueve la aparición de crisis motoras espontáneas preferencialmente durante la fase de luz, la ocurrencia de las mismas depende primariamente del estado de actividad del animal más que del ciclo luz-oscuridad, al detectar un aumento de su frecuencia durante los periodos de inactividad versus los estados de actividad.16 En humanos, se sabe que pacientes con epilepsia del lóbulo temporal presentan un mayor número de crisis electrográficas durante la fase de luz.12, 17A la fecha se desconoce un posible efecto circádico asociado a la inducción del SE en ratas en desarrollo. Por tal motivo, en el presente estudio se evaluó si la inducción del SE utilizando litio-pilocarpina en ratas en desarrollo y la muerte neuronal hipocampal posterior a éste, difieren dependiendo de la etapa del ciclo luz-oscuridad durante la cual se causa dicho evento.
2.1 Sujetos
Se utilizaron ratas de la cepa Wistar criadas en el bioterio del Instituto de Neuroetología. Las madres gestantes y posteriormente las madres con sus crías se mantuvieron a temperatura ambiente, con libre acceso a agua y alimento y con ciclos luz-oscuridad de 12 h, ya sea normal o invertido. Se emplearon animales de ambos sexos y el día de nacimiento se consideró como el día posnatal cero. En todos los casos, la inducción del SE se llevó a cabo entre las 10:00 y 12:00 h del día posnatal 14 (peso corporal promedio de 26±0.8 g) i.e., durante la fase de luz de los animales en ciclo normal y durante la fase de oscuridad de los animales en ciclo invertido. Al finalizar el evento epiléptico, las crías se regresaron al nido y permanecieron con sus madres hasta el final de los experimentos. Todos los procedimientos se llevaron a cabo de acuerdo a las regulaciones vigentes para el uso y cuidado de animales de investigación de la NOM-062-ZOO-1999.
2.2 Inducción del status epilepticus
Durante el día posnatal 13, las ratas se inyectaron con cloruro de litio (3 mEq/kg, i.p; Sigma) y 20 h después, durante el día postnatal 14, se administró clorhidrato de pilocarpina (60 mg/kg, s.c.; Sigma) para inducir el SE. El grupo de animales control se inyectó únicamente con cloruro de litio y solución salina. Todos los animales se rehidrataron con solución salina glucosada 5% (1 ml s.c.) 6 h después de la inducción de SE y se regresaron con sus madres. La manifestación de la actividad convulsiva se monitoreó y sólo aquellos animales que desarrollaron SE fueron incluidos en el estudio. Se calculó la latencia y duración del SE, así como la máxima severidad de las crisis durante el SE según una modificación a la escala propuesta por Haas y cols.18 (0= arresto conductual; 1= clonus facial; 2= inclinación repetida de la cabeza hacia abajo (nodding); 3= clonus de miembros anteriores; 4= clonus de miembros anteriores y postura de canguro; 5 = mioclonias de miembros anteriores, postura de canguro y pérdida del tono postural; 6 = carrera violenta, saltos y vocalizaciones), así como el porcentaje de animales que presentaron SE y de muerte.
2.3 Perfusión transcardiaca y procesamiento del tejido
Veinticuatro horas después del inicio del SE, las ratas se anestesiaron con una sobredosis i.p. de pentobarbital sódico (Pentobarbital, Aranda). Posteriormente, los animales se perfundieron transcardiacamente con solución salina (NaCl 0.9%; CTR Scientific) seguida de paraformaldehido al 4% (Sigma-Aldrich) preparado en una solución amortiguadora de fosfatos 0.1 M con pH 7.4 (Fosfato monobásico y bibásico de sodio de Sigma-Aldrich). Los cerebros se mantuvieron in situ una noche y posteriormente se posfijaron durante 2 h en la misma solución fijadora. Al cabo de este tiempo, los cerebros se deshidrataron con etanol (70, 80, 95 y 100%; J.T.Baker) y xileno (J.T.Baker), para subsiguientemente incluirse en parafina (Paraplast X-tra, Kendall). Utilizando un microtomo Leica se obtuvieron cortes coronales paralelos de 10 μm a nivel del hipocampo dorsal (2.3 a 2.0 mm anterior a la línea interaural (A 2.3 - 2.0 mm para una rata de 25-30 g de peso corporal19) y se montaron en portaobjetos previamente gelatinizados.
2.4 Tinción de hematoxilina-eosina (H&E)
El daño neuronal en la región subículo-CA1 y el giro dentado del hipocampo se evaluó utilizando la versión modificada de la tinción de H&E.9 Las secciones cerebrales se deparafinizaron con xileno e hidrataron con soluciones de etanol a concentraciones decrecientes. Posteriormente, las secciones se incubaron con hematoxilina de Harris (Sigma) durante 10 min. Al cabo de este tiempo, los cortes se lavaron con agua corriente para después colocarlas en etanol 70% ácido. Después de una serie de lavados con agua destilada e incubaciones subsecuentes en una solución de hidróxido de amonio 0.3%, los cortes cerebrales se contratiñeron con una solución alcohólica y ácida de eosina (0.01%; Sigma) durante 1 min. Finalmente, las secciones se deshidrataron con etanol y xileno y se montaron con un medio no acuoso (permount; Fisher Scientific) para su posterior análisis con un microscopio óptico Olympus AX70. Se consideraron como células muertas aquellas que presentaban eosinofilia y claros cambios en la morfología nuclear, incluyendo intensa condensación del núcleo (picnosis) o la fragmentación del mismo (cariorrexis) ya sea en forma de cúmulos redondos de cromatina o de fragmentos delineando el margen del núcleo.
2.5 Análisis semicuantitativo del número de células acidofílicas
Se analizaron un total de 3 secciones por animal y se realizó un conteo bilateral de las células dañadas en la capa piramidal de la región subículo-CA1 y en la capa granular del giro dentado (un total de 6 campos), de manera similar a lo realizado en estudios previos.20, 21 Los resultados se expresaron como el promedio de los campos analizados para cada región hipocampal.
2.6 Análisis estadístico
El análisis estadístico se llevó a cabo dependiendo del parámetro a analizar. Los datos sobre la latencia y la duración del SE, así como de la severidad de las convulsiones se evaluaron utilizando una prueba t de Student o una prueba de Mann Whitney, dependiendo de la presentación o no de una distribución normal. El número de animales que presentaron SE, crisis generalizadas y la mortalidad posterior al SE, se comparó utilizando una prueba de Fisher. El número de células muertas en la región subículo-CA1 y en el giro dentado del hipocampo, se analizó por separado empleando una ANOVA de dos vías, considerando como factores: 1) tratamiento: controles (sin convulsiones) Vs SE; y 2) fase del ciclo luz-oscuridad: luz Vs oscuridad, seguida de la prueba de comparación múltiple Tukey. En todos los casos se empleó el programa estadístico Sigma Stat versión 3.5 y las diferencias se consideraron significativas cuando el valor de p resultó ser menor o igual a 0.05.
3.1 Análisis conductual. El desarrollo del SE en los animales durante la fase de luz fue similar al de los sujetos a los que se les indujo SE durante la fase de oscuridad. Todos los animales en ambos grupos presentaron SE con nula mortalidad y no existieron diferencias significativas en la latencia y duración del SE, ni en la máxima severidad de las convulsiones que presentaron (Tabla 1). Las ratas a las que se les indujo el SE durante la fase de luz mostraron una tendencia a iniciar el SE mas temprano en comparación a cuando el evento convulsivo se causó durante la fase de oscuridad, aunque un menor número de animales presentaron crisis generalizadas escala 4-6 (fase de luz, 50%, fase de oscuridad, 100%, (p=0.085) (Tabla 1).
Tabla 1. Características del status epilepticus (SE) inducido durante la fase de luz u oscuridad en la rata de 14 días de edad.
Parámetro |
Fase de Luz |
Fase de Oscuridad |
p |
n |
8 |
6 |
--- |
Sujetos con SE (%) |
100 |
100 |
ND |
Mortalidad (%) |
0 |
0 |
ND |
Latencia al SE (min) |
9.6±0.4 |
13.7±2.3 |
0.068 |
Duración del SE (min) |
292.5 (274±25.8) |
289.5 |
0.085 |
Severidad de las convulsiones |
3.5 |
5 |
0.108 |
Los datos presentados en porcentaje se analizaron con la prueba exacta de Fisher. La latencia al SE se presentan como la media ± el error estándar de la media (EEM) y se analizó con una prueba t de Student; la duración y la severidad del SE, se presentan como la mediana y entre paréntesis la media ± EEM y se analizaron con una prueba de Mann Whitney. ND, no determinada.
3.2 Muerte neuronal. El análisis del número de células muertas en la región subículo-CA1 hipocampal mostró diferencias debido al tratamiento [F(1, 23)=22.3; p<0.001] y la prueba post hoc reveló que los animales que sufrieron SE presentaron un mayor número de células muertas en comparación con los sujetos sin convulsiones (p<0.001). Respecto a la fase del ciclo durante la cual se indujo el SE, ésta no afectó el número de células muertas detectadas en esta región cerebral [F(1, 23)=2.38; p=0.137], aunque se observo una tendencia a presentar menor daño hipocampal debido al SE durante la fase de luz. De igual manera, no se detectó una interacción entre los factores analizados [F(1, 23)=2.35; p=0.139] (Figura 1 y 2).
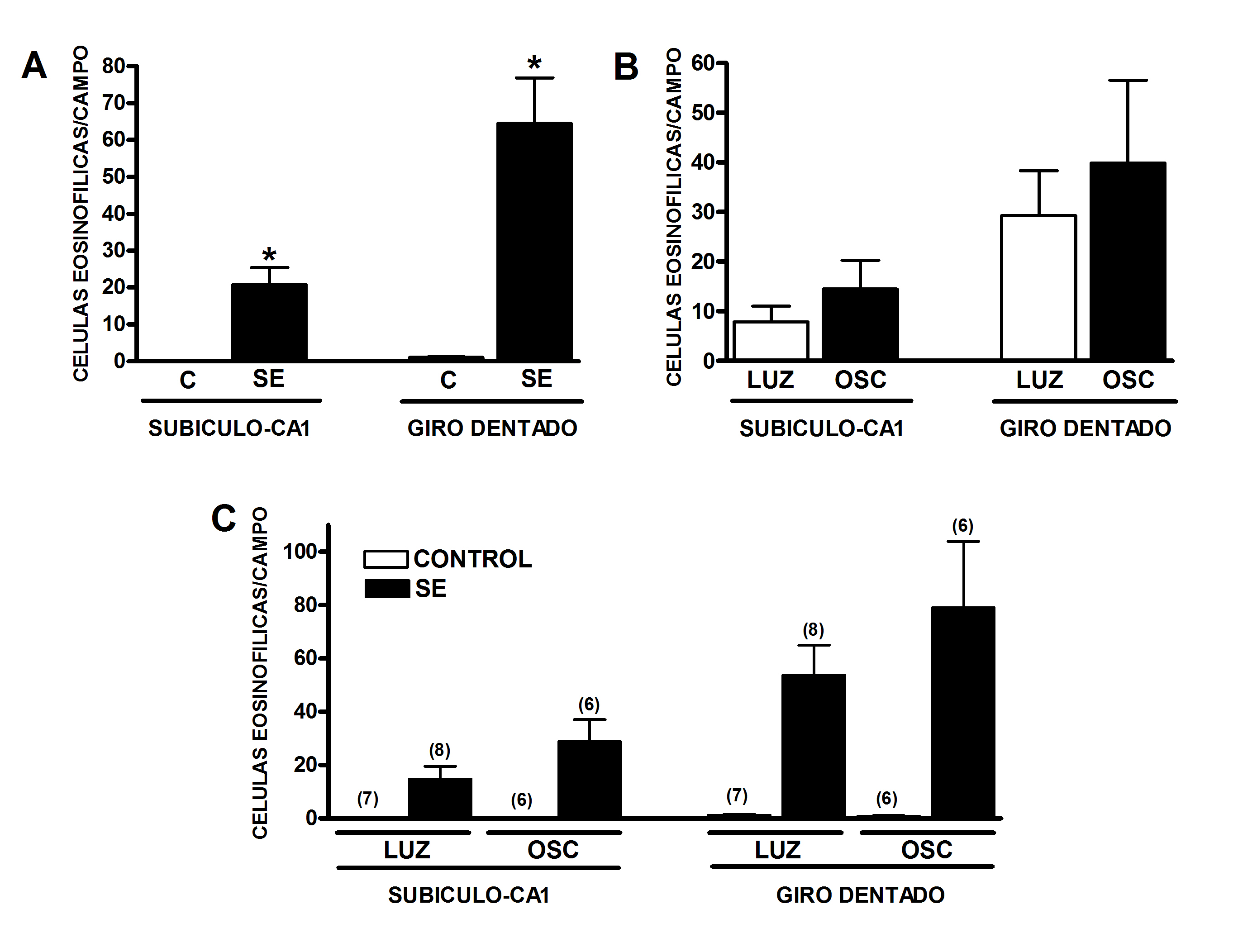
Figura 1. Daño neuronal causado por el status epilepticus (SE) en las áreas subículo- CA1 y giro dentado del hipocampo 24 h después del evento convulsivo. (A) El SE aumentó el número de células muertas en ambas regiones hipocampales en comparación con los animales que no convulsionaron (controles, C). (B) La fase de ciclo (luz u oscuridad, OSC) no modificó el número de células muertas detectadas ni el la región subículo- CA1 ni en el giro dentado hipocampales. (C) La interacción entre el SE y la fase del ciclo durante el cual se causó no modificó el número de células muertas en ninguna de las regiones evaluadas. Los datos se expresan como la media ± el EEM. Los resultados se analizaron con una ANOVA de dos vías seguida de una prueba post hoc de Tuckey. *p<0.05. Entre paréntesis se indica el tamaño muestral para cada grupo.
Por otro lado, al analizar el número de células muertas en el giro dentado del hipocampo se identificaron diferencias debido al tratamiento [F(1, 23)=25.5; p<0.001] y la prueba post hoc mostró que el SE aumentó el número de células muertas en comparación con el grupo control (p<0.05). La fase del ciclo durante la cual se indujo el SE no modificó el número de células muertas detectadas en el giro dentado del hipocampo [F(1, 23)=0.91; p=0.349] y tampoco se detectó una interacción entre los factores analizados [F(1, 23)=0.98; p=0.332] (Figura 1 y 2). Cabe mencionar que el giro dentado fue más sensible al daño neuronal causado por el SE que la región subículo-CA1 (Figura 2).
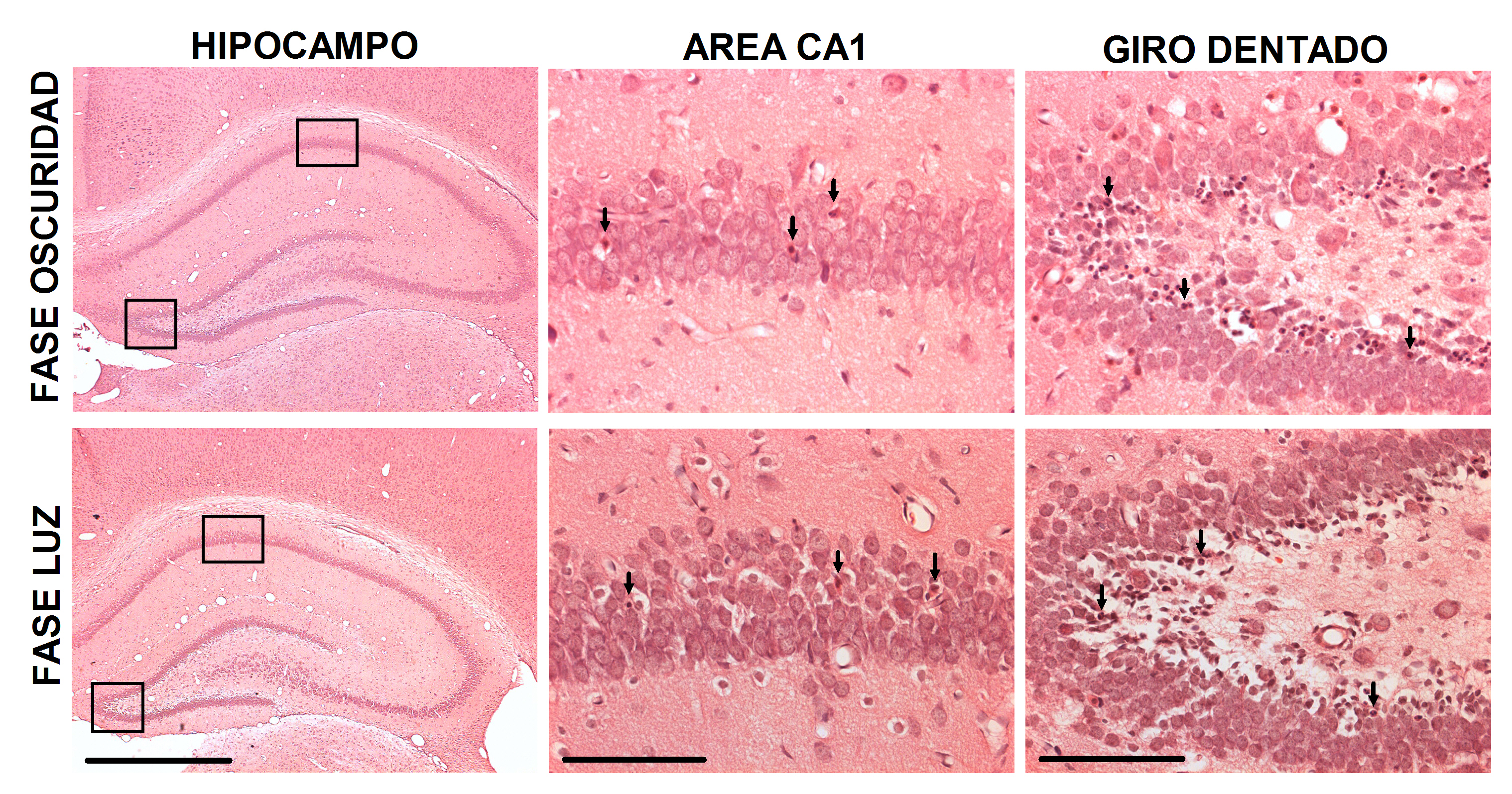
Figura 2. Microfotografías a nivel del hipocampo dorsal de un animal al que se le indujo status epilepticus en la fase de oscuridad (panel superior) o durante la fase de luz (panel inferior) durante el día posnatal 14. Las fotografías de mayor aumento muestran una porción del área CA1 y del giro dentado que presenta células muertas (eosinofílicas y condensación o fragmentación nuclear, indicadas con flechas). Escala: 1000 μm (hipocampo dorsal) y 200 μm (área CA1 y giro dentado).
Los resultados del presente trabajo muestran que el SE puede ser inducido por litio-pilocarpina en ratas de dos semanas de edad durante la fase de luz y de oscuridad del día, aunque con ligeras variaciones. Animales a los que se les aplicó la pilocarpina durante la fase de luz muestran una tendencia a desarrollar el SE más tempranamente y a presentar convulsiones de menor severidad, en comparación con las ratas tratadas durante la fase de oscuridad.
Estos hallazgos, muestran ciertas diferencias con el modelo de pilocarpina, según lo previamente descrito por Stewart y cols.14 en ratas adultas. Estos autores reportaron que las convulsiones inducidas durante la fase de oscuridad se presentaron más rápido y con mayor severidad. Debe destacarse que las condiciones experimentales de ambos trabajos son diferentes, en el presente estudio se emplearon el modelo de litio-pilocarpina y ratas en desarrollo, mientras que Stewart y colaboradores emplearon ratas adultas tratadas únicamente con pilocarpina. Está documentado que cambios neuroquímicos, tales como la liberación de neurotransmisores (e.g. serotonina y noradrenalina), neuromoduladores (e.g. melatonina) y de hormonas (e.g. cortiscosterona) asociados con el ciclo circadiano pueden modificar la susceptibilidad convulsiva.22-24 Además, la excitabilidad del cerebro en desarrollo y en particular del hipocampo de la rata, depende del grado de maduración de las neuronas en cuestión.25, 26 Lo anterior aunado a que varias vías neurales no han llegado a su completo desarrollo, podría enmascarar las variaciones debidas al ciclo luz-oscuridad (día/noche) y explicar estas diferencias.
Por otro lado, es completamente aceptado que el SE produce daño neuronal en el hipocampo de la rata en desarrollo,9, 20, 21 lo cual se evidencía con los resultados de este estudio, ya que este evento convulsivo de larga duración produjo muerte neuronal en las regiones subículo-CA1 y giro dentado del hipocampo. Como se indicó previamente, no de detectaron diferencias significativas en la severidad convulsiva del SE cuando se indujo durante la fase de luz Vs la fase de oscuridad. Este resultado coincide con el hecho de que no existió diferencia en el número de células hipocampales muertas observado tras ambos esquemas experimentales. No obstante, vale la pena señalar que durante la fase de oscuridad, la severidad del SE mostró una tendencia a ser mayor (más animales con crisis generalizadas), y precisamente estos sujetos mostraron valores superiores en el conteo de células muertas. A futuro valdría la pena realizar un análisis más detallado a este respecto, ya que implicaría que en la rata en desarrollo, las crisis generalizadas son responsables en gran medida de la muerte neuronal hipocampal.
La fase del ciclo luz/oscuridad durante la cual se aplica litio-pilocarpina en la rata en desarrollo no modifica la progresión del SE, ni el subsecuente daño neuronal que se presenta en el las regiones subículo-CA1 y giro dentado del hipocampo.
Al Consejo Nacional de Ciencia y Tecnología por el donativo de Investigación Básica número 106402 y al Programa de Mejoramiento del Profesorado por el apoyo a UV-PTC-474 otorgados a MLLM.
- Engel J Jr. A Proposed Diagnostic Scheme for People with Epileptic Seizures and with Epilepsy: Report of the ILAE Task Force on Classification and Terminology. Epilepsia 2001 42(6):796–803.
- Wasterlain CG, Chen J. Definition and classification of status epilepticus. En: Status epilepticus, Mechanisms and management. Wasterlain CG, Treiman DM (Eds.). The Mit Press 2006 pp 11-16.
- Hauser W. The prevalence and incidence of convulsive disorders in children. Epilepsia 1994 35:1-6.
- DeLorenzo RJ, Hauser WA, Towne AR, Boggs JG, Pellock JM, Penberthy L, Garnett L, Fortner CA, Ko D. A prospective, population-based epidemiologic study of status epilepticus in Richmond, Virginia. Neurology 1996 46:1029-1035.
- DeLorenzo RJ, Pellock JM, Towne AR, Boggs JG. Epidemiology of status epilepticus. J Clin Neurophysiol 1995 12:316-325.
- Hauser WA, Anderson VE, Loewenson RB, McRoberts SM. Seizure recurrence after a first unprovoked seizure. N Engl J Med 1982 307:522-528.
- Annegers JF, Shirts SB, Hauser WA, Kurland LT. Risk of recurrences after an initial unprovoked seizure. Epilepsia 1986 27:43-50.
- Maytal J, Shinnar S, Moshe SL, Alvarez LA. The low morbidity and mortality of status Epilpeticus in children. Pediatrics 1989 83:323-331.
- Sankar R, Shin DH, Liu H, Mazarati A, Pereira de Vasconcelos A, Wasterlain CG. Patterns of status epilepticus-induced neuronal injury during development and long-term consequences. J Neurosci 1998 18:8382-8393.
- Nairismagi J, Pitkanen A, Kettunen MI, Kauppinen RA, Kubova H. Status epilepticus in 12-day-old rats leads to temporal lobe neurodegeneration and volume reduction: a histologic and MRI study. Epilepsia 2006 47:479-488.
- Kubova H, Druga R, Lukasiuk K, Suchomelova L, Haugvicova R, Jirmanova I, Pitkanen A. Status epilepticus causes necrotic damage in the mediodorsal nucleus of the thalamus in immature rats. J Neurosci 2001 21:3593-3599.
- Quigg M. Circadian rhythms: interactions with seizures and epilepsy. Epilepsy Res 2000 42:43–55.
- Weiss G, Lucero K, Fernandez M, Karnaze D, Castillo N. The effect of adrenalectomy on the circadian variation in the rate of kindled seizure development. Brain Res 1993 612(1-2):354-356.
- Stewart LS, Leung LS, Persinger MA. Diurnal variation in pilocarpine-induced generalized tonic–clonic seizure activity. Epilepsy Res 2001 44:207–212.
- Raedt R, Van Dycke A, Van Melkebeke D, De Smedt T, Claeys P, Wyckhuys T, Vonck K, Wadman W, Boon P. Seizures in the intrahippocampal kainic acid epilepsy model: characterization using longterm video-EEG monitoring in the rat. Acta Neurol Scand 2009 119:293–303.
- Hellier JL, Dudek FE. Spontaneous motor seizures of rats with kainate-induced epilepsy: effect of time of day and activity state. Epilepsy Res 1999 35:47–57.
- Hofstra WA, Grootemarsink BE, Dieker R, van der Palen J, de Weerd AW. Temporal distribution of clinical seizures over the 24-h day: a retrospective observational study in a tertiary epilepsy clinic. Epilepsia 2009 50(9):2019-2026.
- Haas KZ, Sperber EF, Moshe SL. Kindling in developing animals: expression of severe seizures and enhanced development of bilateral foci. Brain Res Dev Brain Res 1990 56:275-280.
- Sherwood NM, Timiras PS. A stereotaxic atlas of the developing rat brain. University of California Press, USA. 1970.
- Niquet J, Auvin S, Archie M, Seo DW, Allen S, Sankar R, Wasterlain CG. Status Epilepticus Triggers Caspase-3 Activation and Necrosis in the Immature Rat Brain. Epilepsia 2007 48:1203-6
- Lopez-Meraz ML, Wasterlain CG, Rocha LL, Allen S, Niquet J. Vulnerability of postnatal hippocampal neurons to seizures varies regionally with their maturational stage. Neurobiol Dis 2010 37:394–402.
- Agren H, Koulu M, Saavedra JM, Potter WZ, Linnoila M. Circadian covariation of norepinephrine and serotonin in the locus coeruleus and dorsal raphe nucleus in the rat. Brain Res 1986 397(2):353–358.
- Roberts AJ, Keith LD. Sensitivity of the circadian rhythm of kainic acid-induced convulsion susceptibility to manipulations of corticosterone levels and mineralocorticoid receptor binding. Neuropharmacology 1994 Sep;33(9):1087-93.
- Stewart LS, Leung LS. Hippocampal melatonin receptors modulate seizure threshold. Epilepsia 2005 46(4):473-80.
- Harris KM, Teyler TJ. Developmental onset of long-term potentiation in area CA1 of the rat hippocampus. J Physiol 1984 346:27-48.
- Bekenstein JW, Lothman EW. An in vivo study of the ontogeny of longterm potentiation (LTP) in the CA1 region and in the dentate gyrus of the rat hippocampal formation. Brain Res Dev Brain Res 1991 63(1-2):245-51.
| Recibido: 20 de septiembre de 2010 | Aceptado: 14 de octubre de 2010 |
Correspondencia:
Dra. Maria Leonor López-Meraz, Programa de Neurobiología, Universidad Veracruzana, Xalapa, Ver., Tel.: (228) 841-8900 Ext. 13609, Correo: leonorlopez@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
