Alteraciones cognitivas en la epilepsia
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Martínez-Díaz Jorge Antonio1, Sánchez-Zavaleta Viridiana1, Mateos-Moreno Alejandro1, Suárez-Medellín Jorge Manuel2, Hernández-Aguilar María Elena2, Aranda-Abreu Gonzalo2*
1Doctorado en investigaciones cerebrales. Universidad Veracruzana, Veracruz, México. 2Centro en investigaciones cerebrales. Universidad Veracruzana, Veracruz, México.
Resumen/Abstract
Introducción
Conclusiones
Referencias
Correspondencia
La epilepsia es una enfermedad neurológica asociada con frecuencia a alteraciones cognitivas, las cuales alteran significativamente la calidad de vida de los pacientes. Por lo que, el objetivo de este artículo es brindar un panorama general sobre los múltiples factores implicados en dicha asociación, como son el estrés, la ansiedad, la depresión, los medicamentos y el daño generado por la propia enfermedad. También se mencionan los principales predictores conocidos para desarrollar un deterioro cognitivo durante la epilepsia, como son la edad, la duración y la localización de las crisis. Finalmente se comentan los beneficios de algunos tratamientos anticonvulsivantes sobre la cognición.
Palabras clave: Epilepsia, Cognición, Depresión, Ansiedad.
Epilepsy is a neurological disease often associated with cognitive alterations, which significantly alter the quality of life of patients. Therefore, the aim of this article is to provide an overview of the multiple factors involved in this association, such as stress, anxiety, depression, medications and the damage generated by the disease itself. Also mentioned are the main known predictors for developing cognitive impairment during epilepsy, such as age, duration and location of seizures. Finally, the benefits of some anticonvulsant treatments on cognition are discussed.
Keywords: Epilepsy, Cognition, Depression, Anxiety.
La epilepsia se encuentra como una de las enfermedades neurológicas crónicas más frecuentes en el mundo, afectando aproximadamente a 65 millones de personas.1 La prevalencia de la epilepsia a nivel mundial es de 6.38 por cada mil habitantes y su tasa de incidencia es de 61.44 por cada cien mil habitantes.2 En el caso de Latinoamérica, se reporta una prevalencia entre 2,7 a 8 por cada mil habitantes, mientras que en México se estima que el 1,2% de la población general sufre de epilepsia.3 La edad promedio para iniciar con las manifestaciones clínicas se ubica alrededor de los diez años y no hay una diferencia en su presentación con respecto al género.3 Su etiología es variada e incluye el accidente cerebrovascular,4-8 la enfermedad de Alzheimer,9-13 el traumatismo craneoencefálico,14-16 infecciones (abscesos, meningitis, encefalitis y VIH),17-19 malformaciones cerebrales congénitas, 20,21 lesión cerebral durante el nacimiento,22 trastornos metabólicos presentes al nacer (fenilcetonuria),22-24 enfermedades autoinmunes,22,25 tumor cerebral26, 27 y vasos sanguíneos anormales en el cerebro.28-31
La epilepsia es definida por la Organización Mundial de la Salud (OMS) como “la presentación recurrente de fenómenos paroxísticos del sistema nervioso central secundarios a la descarga eléctrica anormal de las neuronas en el cerebro de forma crónica”.3 La Liga Internacional contra la Epilepsia (ILAE por sus siglas en inglés: International League Against Epilepsy) propone la siguiente definición: “es la ocurrencia transitoria de signos y/o síntomas debidos a una actividad neuronal anormalmente excesiva o sincrónica en el cerebro”,32 esto conlleva consecuencias neurobiológicas, sociales, psicológicas y cognitivas. La definición operativa del año 2014 considera el diagnóstico de epilepsia bajo las siguientes condiciones: “(1) por lo menos dos convulsiones no provocadas (o reflejas) que ocurran con una diferencia mayor de 24 horas; (2) cualquier convulsión no provocada (o refleja) y una probabilidad de presentar futuras convulsiones similares al riesgo de recurrencia general después de dos convulsiones no provocadas, al menos del 60%, que ocurran durante los siguientes 10 años; y (3) cualquier diagnóstico de un síndrome epiléptico”.33 Es importante señalar que no todas las convulsiones son sinónimo de epilepsia,34 como señala la definición operativa. En el presente trabajo se considera principalmente a la definición propuesta por la ILAE.
La complejidad de su definición se ve reflejada en su clasificación, de forma etiológica se consideran las causas genéticas, estructurales o metabólicas, y desconocidas.1 La clasificación en los distintos tipos y subtipos de epilepsia es la siguiente: convulsiones generalizadas que se originan rápidamente dentro de redes distribuidas bilateralmente en el cerebro y engloba a la crisis tónico-clónica, ausencia (típica, ausencia con características especiales y atípica), clónica, tónica, atónica, mioclónica (mioclónica, mioclónica-atónica, mioclónica-tónica); crisis focales que se originan en redes limitadas en un solo hemisferio, puede contener uno o más componentes como el aura, motores, autonómicos, alteraciones de la conciencia y capacidad de respuesta; finalmente se encuentra la crisis epiléptica desconocida o idiopática, en la cual no hay evidencias suficientes para caracterizarla en focal o generalizada.1 Tanto en la definición de la epilepsia como en su clasificación se hace evidente la relación que tiene con la cognición. Las causas que producen alguna alteración cognitiva en la epilepsia son variadas y no se debe únicamente al efecto directo de las crisis epilépticas. Por lo que el objetivo de esta revisión es ofrecer un panorama general de los factores relacionados con la epilepsia y las alteraciones cognitivas, así como de sus principales predictores y el efecto benéfico de algunos medicamentos anticonvulsivantes.
2. Antecedentes del deterioro cognitivo asociado a la epilepsia
Desde la época de la Roma antigua ya se había identificado una estrecha relación entre el deterioro cognitivo con la epilepsia,35 definimos de forma amplia a la cognición como el procesamiento de información,36 se hace evidente que cualquier alteración en las redes neuronales del cerebro induciría alteraciones cognitivas sin importar de qué tipo de crisis se trate o su etiología, incluso se ha encontrado que entre el 70 al 80% de los pacientes epilépticos muestran algún grado de deterioro cognitivo.37,38 En 1972, Tarter reunió múltiples reportes de pacientes con epilepsia de distinta etiología asociados a deterioro intelectual durante un periodo de 50 años, lo que le permitió establecer una correlación entre los patrones del electroencefalograma y el foco epiléptico con la función intelectual, reuniendo una gran cantidad de evidencia que relaciona directamente a la epilepsia con el deterioro cognitivo.39
Estos reportes se fueron incrementando en los años noventa, lo que permitió lograr la identificación de algunos predictores de la alteración en la capacidad cognitiva en pacientes con epilepsia, como son: la edad, puesto que el inicio de las crisis a una menor edad se asocia a menor desarrollo intelectual; una mayor duración de las crisis se relaciona con una pobre habilidad intelectual; la localización, aunque suele ser controversial, se ha reportado que la disfunción extra-temporal como la del lóbulo frontal, fue asociada con bajo cociente de inteligencia a escala completa y el déficit en la memoria verbal es más frecuente en la alteración del lóbulo temporal,40 incluso el riesgo de una disminución en la memoria verbal puede aumentar después de la resección del lóbulo temporal, principalmente el izquierdo, en niños con una memoria verbal normal previa a la cirugía.41 En el 2015 se reportaron resultados similares, al asociar la focalización a nivel fronto-temporal, un mayor tiempo de evolución, duración y frecuencia de las crisis, con un aumento del deterioro cognitivo, siendo mayor la probabilidad de aparición de deterioro en la cognición luego de 11 años de evolución.37
Ure en el 2004, hace un apunte interesante respecto al limitado entendimiento que tenemos de la asociación epilepsia-cognición, menciona que términos como “agresividad epiléptica” o “demencia epiléptica”,42 son rechazados debido a dos puntos principales: (1) para evitar una mayor estigmatización de la que ya conlleva la enfermedad por sí misma y (2) debido a la insuficiente información para validarlas como entidades nosológicas.39 Por esta razón es preferible utilizar el término “deterioro cognitivo en pacientes epilépticos” en lugar de “demencia epiléptica”, aunado a que la presencia de demencia en pacientes epilépticos no es tan común como el segundo término podría sugerir,39 y el deterioro cognitivo en pacientes epilépticos es muy variable, incluso parece inexistente en muchos pacientes, que se hace necesario buscar las causas de las alteraciones cognitivas no solo en la etiología propia de la epilepsia.
3. Causas de alteraciones cognitivas en pacientes con epilepsia
Existen múltiples factores que contribuyen al deterioro cognitivo en pacientes con epilepsia (ver figura 1), empezando con la etiología de la enfermedad, la cual puede ejercer un efecto negativo importante sobre la cognición de forma directa y junto a las crisis prolongadas o recurrentes exacerban el daño cognitivo.43 Por ejemplo, en la encefalopatía epiléptica las mismas crisis y las descargas interictales pueden exacerbar la disfunción cognitiva mediada por el efecto tóxico de la acumulación de metabolitos, falla energética a nivel celular y disfunción neuronal asociada a cambios estructurales junto a una insuficiente o excesiva despolarización, generando un estado de letargia durante los periodos de actividad provocando problemas de aprendizaje, déficit de atención e hiperactividad, así como discapacidad intelectual.44 En otros casos la disfunción cognitiva está relacionada directamente con el efecto adverso de los fármacos antiepilépticos, como es el caso del topiramato, el cual está asociado principalmente con déficit del lenguaje, disminución de la memoria, atención, velocidad de procesamiento, fluencia verbal, su mecanismo de acción es mediante la potenciación de la transmisión GABAergica, la inhibición de canales de sodio dependientes de voltaje, calcio y AMPA45 lo que genera una alteración dinámica en la actividad cerebral en la corteza cingulada posterior bilateral, giro temporal inferior y la corteza prefrontal.46 También se ha identificado la participación de microdeleciones microsomales como la mutación homocigótica de TBC1D24, un gen implicado en la guía del axón y relacionado con la epilepsia mioclónica familiar de la infancia, ocasionando disartria, ataxia y discapacidad intelectual.47
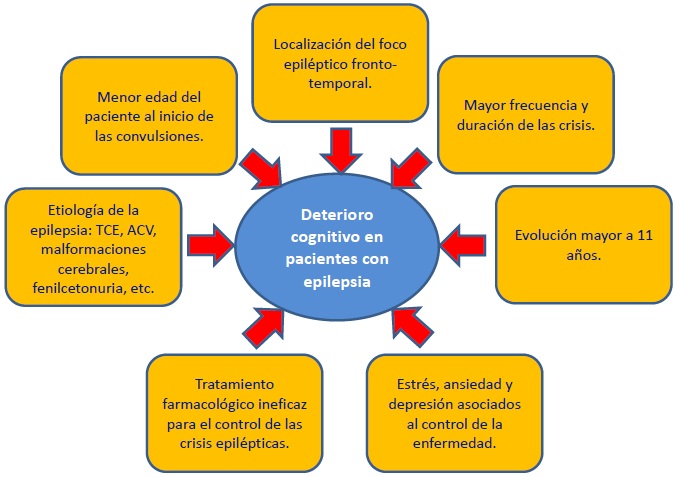
Figura 1.- Factores implicados en el deterioro cognitivo de pacientes con epilepsia. Se observan algunos de los factores más frecuentes que contribuyen al desarrollo del deterioro cognitivo en pacientes con epilepsia. Abreviaturas: TCE: Traumatismo craneoencefálico, ACV: accidente cerebrovascular.
Algunas alteraciones focales asociadas a regiones específicas del cerebro presentan diferentes alteraciones cognitivas. Lomlomdjian y colaboradores en el año 2017, encontraron que pacientes con epilepsia del lóbulo temporal derecho muestran deficiencias en el discurso conversacional y narrativo interictal con un discurso desarticulado, falta de categorización e interpretación errónea del significado social, en cambio el grupo con epilepsia del lóbulo temporal izquierdo tiene únicamente una tendencia a un menor rendimiento en la secuenciación lógico temporal.48 En niños con epilepsia idiopática generalizada (IGE siglas en inglés) y con epilepsia idiopática relacionada con la localización (ILRE siglas en inglés) de reciente aparición muestran una amplia gama de anormalidades cognitivas al comienzo de su trastorno, incluso en los subsíndromes específicos se revelan varios patrones únicos de vulnerabilidad cognitiva, incluso entre las epilepsias infantiles consideradas como las más benignas, por ejemplo, ausencia, epilepsia benigna con picos centro-temporales. Se encontró un aumento significativo de los problemas académicos en los niños con epilepsia, muchos de los cuales se identificaron antes del inicio del diagnóstico y el tratamiento de la epilepsia. En general, las funciones ejecutivas parecen ser afectadas en IGE, mientras que el lenguaje y la memoria verbal son más afectados en ILRE.49 Este estudio muestra la afectación cognitiva que en ciertos tipos de epilepsia poco conocidas no se habían reportado.
Aunque se ha puesto mayor atención a las crisis epilépticas, es altamente probable que la etiología pueda contribuir a la disfunción cognitiva mediante mecanismos independientes a las crisis. Un caso notable es el síndrome de Dravet, se trata de un síndrome epiléptico con inicio en la infancia asociado a un daño cognitivo severo, y una mala calidad de vida, con un coeficiente intelectual por debajo de 50 en la mayoría de los casos, se debe en el 85% de los casos a mutaciones en el gen SN1A, lo que genera una pérdida de la función del canal de sodio dependiente de voltaje 1.1 (Nav1.1), el cual es crítico para la iniciación y propagación del potencial de acción en neuronas.50-54 Una vez identificada la disfunción de los Nav1.1,50,54 esta información permitió proponer un mecanismo independiente de las crisis que contribuye al daño cognitivo debido a la alteración de Nav1.1. Para demostrarlo Bender y colaboradores en el 2013, utilizaron siRNA para bloquear la expresión del canal Nav1.1 de forma selectiva en la región basal del cerebro anterior de ratas macho Sprague-Dawley, y encontraron que la reducción en su expresión en el septum medial y la banda diagonal de Broca, induce una desregulación del hipocampo en asociación con una memoria espacial deficiente, sin presentar crisis epilépticas. Esto sugiere que la etiología puede contribuir directamente al daño cognitivo independiente de las crisis.50
Otro factor importante es la percepción de la enfermedad, que incluye características como la identidad que abarca el diagnóstico y la expectativa de los síntomas, el tiempo de la enfermedad, la etiología, las secuelas y el adecuado control o cura. Una percepción conjunta de la epilepsia, considerada como una “amenaza de la enfermedad” se asocia a una menor calidad de vida, ya que la persona afectada tiene la percepción de una crisis inminente en cualquier momento, lo que genera estrés. También se ha identificado que la percepción de la enfermedad es un predictor significativo de depresión y riesgo de suicidio entre pacientes epilépticos.55,56 El estrés, la ansiedad y la depresión son manifestaciones muy comunes en los pacientes epilépticos, y estás también contribuyen al deterioro cognitivo mediante procesos distintos al que provoca las crisis epilépticas directamente.
4. Estrés, ansiedad y depresión en la epilepsia
El impacto del estrés es particularmente importante, ya que es el factor desencadenante de crisis más frecuente, el cual se puede ver incrementado por la incapacidad de predecir el momento de una crisis epiléptica. Existe una alta prevalencia de estrés en la epilepsia, ligado a dificultades psicosociales como desordenes emocionales y cognitivos. En ese sentido, el estrés juega un papel clave en el inicio de la depresión y ansiedad que incluso las empeora. Siendo la depresión mayor y la ansiedad generalizada las dos comorbilidades más graves en epilepsia, además ambas enfermedades pueden anteceder una crisis, esto indica una bidireccionalidad entre ellas. Las vías neuroendocrinas y neurológicas de la regulación del estrés implicadas en la epilepsia aún son desconocidas, especialmente en la epilepsia del lóbulo temporal en la cual el estrés es un desencadenante importante.57
Se ha reportado que entre el 9 y el 37% de los pacientes con epilepsia padecen de depresión, y del 11 al 25% sufren de ansiedad.58 En estudios recientes no se ha identificado una diferencia en la presencia de ansiedad por género, pero si hay un incremento en la presentación de síntomas depresivos en mujeres.34 Estos datos cobran importancia debido a que la depresión y la ansiedad están fuertemente relacionadas con la epilepsia refractaria a drogas, especialmente del lóbulo temporal. Casi un tercio de los pacientes muestran epilepsia refractaria la cual es una cifra cercana a la de pacientes epilépticos con ansiedad y depresión. Se ha sugerido también que anormalidades estructurales dentro de las regiones afectadas tales como la región frontal, temporal y límbica, alteraciones en las vías de las monoaminas, metabolismo de la glucosa, eje hipotálamo-hipofisis-adrenal alterado, aumento de interleucina-1b son las causantes de la ansiedad y el estado depresivo en pacientes con epilepsia.58
Así mismo, la ansiedad y la depresión han sido asociadas con un incremento de eventos adversos en respuesta a los fármacos antiepilépticos, en un meta-análisis la presencia fue de 23.1%, mientras que en pacientes con pobre control de las crisis tienen hasta un 54.3% de depresión asociada. Pacientes con epilepsia resistente a drogas tienen un 19.6% de ansiedad. Las ideas suicidas son al menos dos veces más altas en pacientes con epilepsia.58 Aunque el tratamiento farmacológico ineficaz para el control de las crisis epilépticas, o sus propios efectos adversos ocasionan alteraciones de estrés, ansiedad y depresión, así como un deterioro en la cognición, también es cierto que un adecuado tratamiento, y sobre todo nuevas terapias son capaces de mejorar estas comorbilidades.
5. Beneficio de los tratamientos antiepilépticos
Hay evidencias que demuestran un potencial independiente para los fármacos antiepilépticos para lograr una mejoría de los síntomas de la enfermedad, de igual forma inducen una mejora en el desempeño cognitivo y reducen la ansiedad, lo que origina un beneficio indirecto sobre otras áreas personales como la sexualidad, por ejemplo, que contribuye a una mejor calidad de vida de los pacientes. Como es el caso del valproato y la lamotrigina, que no alteran significativamente los niveles hormonales en pacientes con epilepsia luego de un tratamiento de 6 a 12 meses, por lo que su beneficio se considera es gracias a un efecto estabilizador del ánimo.59,60
Los medicamentos no son los únicos que han demostrado una mejoría significativa de las crisis epilépticas y de las alteraciones cognitivas y emocionales, la estimulación del nervio vago es una terapia alternativa a los fármacos antiepilépticos que se utiliza para mejorar la sintomatología asociada a la epilepsia refractaria y la depresión mayor. Sun y colaboradores en el 2017, reportaron que la estimulación del nervio vago produce una mejoría en el rendimiento de la memoria de trabajo, un mayor tiempo de reacción, siendo el primer estudio en aportar pruebas de una mejoría inmediata sobre el rendimiento de la memoria de trabajo en humanos con estimulación del nervio vago, y que sea clínicamente relevante.
Una diana prometedora para realizar una adecuada terapia antiepiléptica es el sistema de la adenosina. Este sistema tiene un efecto inhibidor sobre la modulación de la actividad neuronal en el sistema nervioso central, es un potente anticonvulsivante y tiene funciones neuroprotectoras, actúa en las proteínas G pre y post-sinápticas mediante los receptores A1 (A1Rs) altamente expresadas en corteza cerebral, cerebelo, hipocampo. Inhibe la liberación de aminoácidos excitatorios mediante las proteínas Gi/o y los canales iónicos de calcio y potasio dependientes de voltaje demostrado en modelos animales.62-64 Recientemente en el 2017, se aportó un mayor conocimiento sobre el mecanismo de acción de la adenosina al bloquear en ratones la expresión de los A1R y se encontró que la potenciación a largo plazo (LPT) en el hipocampo en las regiones CA1-CA3 fue altamente inhibida, junto a una reducción significativa en la supervivencia celular en la región CA1 y un aumento en la activación de la caspasa-3, la cual está implicada en la apoptosis, así como una disminución en la expresión de factores neurotróficos como el factor neurotrófico del cerebro (BDNF) y la proteína de la densidad post-sináptica 95 (PSD95 por sus siglas en inglés Post synaptic density protein 95) que es importante para el anclaje y posterior movilización de los receptores sinápticos y contribuye activamente a la LPT. Por lo tanto, se deduce que su papel protector en el daño cognitivo es mediante el incremento de BDNF y PSD95. La activación de los A1Rs durante la epileptogénesis podría beneficiar la preservación de las funciones cognitivas.64
Entre un 70 a un 80% de los pacientes con epilepsia padecen de algún grado de deterioro cognitivo, aún se desconocen todos los factores implicados, sin embargo, se cuenta con ciertos predictores para desarrollarlo, los cuales son: un inicio de las convulsiones durante la infancia, duración prolongada de las crisis, mayor frecuencia de las crisis, evolución mayor a 11 años y el foco epileptógeno en lóbulos frontal o temporal. Las causas principales que contribuyen al detrimento cognitivo son las alteraciones fisiológicas y metabólicas originadas por las crisis epilépticas en sí mismas, la etiología de la epilepsia (Síndrome de Dravet, TCE, EVC, alteraciones estructurales, genéticas), el efecto adverso de algunos fármacos antiepilépticos y factores emocionales como el estrés, la ansiedad y la depresión. Las distintas causas mencionadas pueden afectar la cognición por diversos mecanismos, que en su conjunto podrían agravar el problema sobre todo si la epilepsia se encuentra asociada a ansiedad y depresión, que es el caso de al menos un tercio de los pacientes.
Entre las alteraciones cognitivas más frecuentemente asociadas a diversos tipos de epilepsia se encuentran los problemas de aprendizaje, déficit de atención e hiperactividad, discapacidad intelectual, disminución de la atención, afectación de las funciones ejecutivas, reducción en la velocidad de procesamiento, disminución en el rendimiento de la secuenciación lógico-temporal, déficit del lenguaje, disfunción de la memoria verbal, alteración en la fluencia verbal, falta de categorización e interpretación errónea del significado social, deficiencias en el discurso conversacional, así como en el narrativo. Sin embrago, afortunadamente existen fármacos con efectos positivos, como el valproato y la lamotrigina, los cuales mejoran los síntomas de la enfermedad y de la ansiedad; también se han desarrollado nuevos tratamientos como la estimulación del nervio vago que mejora la sintomatología asociada a epilepsia refractaria y depresión mayor con un impacto benéfico en la cognición.
7. Estrategia de búsqueda y criterios de selección. (Metodología)
Las referencias de este artículo de revisión se identificaron mediante búsquedas en PubMed y google académico, e incluyen hasta el mes de marzo del 2018, con los siguientes términos: epilepsy, cognition, cognitive, improvement (memory, language, attention and neuropsychological). Las referencias fueron identificadas desde artículos originales y artículos de revisión mediante búsqueda en la bibliografía de los autores, tal como se citan en las referencias.
Beca Conacyt No. 428854 (DMR), Cuerpos Académicos de Neurociencias (UV-CA-28) y Neuroquímica (UV-CA-304).
Los autores que aparecen en este artículo de revisión han contribuido en su contenido y en la elaboración del formato de este escrito. Todos los autores declaran que no tienen conflicto de interés alguno en el reporte de este artículo.
- Moshé SL, Perucca E, Ryvlin P, Tomson T. Epilepsy: new advances. Lancet. 2015; 385(9971): 884-898.
- Fiest KM, Sauro KM, Wiebe S, Patten SB, Kwon CS, Dykeman J, Pringsheim T, Lorenzetti DL, Jetté N. Prevalence and incidence of epilepsy A systematic review and meta-analysis of international studies. Neurology. 2017; 88(3): 296-303.
- González-Osornio G. La evaluación neuropsicológica inicial para la epilepsia infantil. Ciencia & Futuro. 2015; 5(3): 99-119.
- Lossius MI, Rønning OM, Slapø GD, Mowinckel P, Gjerstad L. Poststroke Epilepsy: Occurrence and Predictors—A Long‐term Prospective Controlled Study (Akershus Stroke Study). Epilepsia. 2005; 46(8): 1246-1251.
- Hwang JY, Aromolaran KA, Zukin RS. Epigenetic mechanisms in stroke and epilepsy. Neuropsychopharmacology. 2013; 38(1): 167-182.
- Pitkänen A, Roivainen R, Lukasiuk K. Development of epilepsy after ischaemic stroke. Lancet Neurol. 2016; 15(2): 185-197.
- Tanaka T, Ihara M. Post-stroke epilepsy. Neurochem Int. 2017; 107: 219-228.
- Zhao Y, Li X, Zhang K, Tong T, Cui R. The Progress of Epilepsy after Stroke. Curr Neuropharmacol. 2018; 16(1): 71-78.
- Chin J, Scharfman HE. Shared cognitive and behavioral impairments in epilepsy and Alzheimer's disease and potential underlying mechanisms. Epilepsy Behav. 2013; 26(3): 343-351.
- Vossel KA, Beagle AJ, Rabinovici GD, Shu H, Lee SE, Naasan G, Hegde M, Cornes SB, Henry ML, Nelson AB, Seeley WW, Geschwind MD, Gorno-Tempini ML, Shih T, Kirsch HE, Garcia PA, Miller BL, Mucke L. Seizures and epileptiform activity in the early stages of Alzheimer disease. JAMA Neurol. 2013; 70(9): 1158-1166.
- Born HA. Seizures in Alzheimer’s disease. Neuroscience. 2015; 286: 251-263.
- Horváth A, Szucs A, Barcs G, Noebels JL, Kamondi A. Epileptic seizures in Alzheimer disease: a review. Alzheimer Dis Assoc Disord. 2016; 30(2): 186-192.
- Vossel KA, Tartaglia MC, Nygaard HB, Zeman AZ, Miller BL. Epileptic activity in Alzheimer's disease: causes and clinical relevance. Lancet Neurol. 2017; 16(4): 311-322.
- Pugh MJV, Orman JA, Jaramillo CA, Salinsky MC, Eapen BC, Towne AR, Amuan ME, Roman G, McNamee SD, Kent TA, McMillan KK, Hamid H, Grafman JH. The prevalence of epilepsy and association with traumatic brain injury in veterans of the Afghanistan and Iraq wars. J Head Trauma Rehabil. 2015; 30(1): 29-37.
- Keret A, Bennett-Back O, Rosenthal G, Gilboa T, Shweiki M, Shoshan Y, Benifla M. Posttraumatic epilepsy: long-term follow-up of children with mild traumatic brain injury. J Neurosurg Pediatr. 2017; 20(1): 64-70.
- Webster KM, Sun M, Crack P, O’Brien TJ, Shultz SR, Semple BD. Inflammation in epileptogenesis after traumatic brain injury. J Neuroinflammation. 2017; 14(1): 10.
- Benamer HT, Grosset DG. A systematic review of the epidemiology of epilepsy in Arab countries. Epilepsia. 2009; 50(10): 2301-2304.
- Bröer S, Käufer C, Haist V, Li L, Gerhauser I, Anjum M, Bankstahl M, Baumgärtner W, Löscher W. Brain inflammation, neurodegeneration and seizure development following picornavirus infection markedly differ among virus and mouse strains and substrains. Exp Neurol. 2016; 279: 57-74.
- Vezzani A, Fujinami RS, White HS, Preux PM, Blümcke I, Sander JW, Löscher W. Infections, inflammation and epilepsy. Acta Neuropathol. 2016; 131(2): 211-234.
- Iourov IY, Vorsanova SG, Kurinnaia OS, Zelenova MA, Silvanovich AP, Yurov YB. Molecular karyotyping by array CGH in a Russian cohort of children with intellectual disability, autism, epilepsy and congenital anomalies. Mol Cytogenet. 2012; 5(1): 46.
- Pessoa A, Van der Linden V, Yeargin-Allsopp M, Carvalho MDCG, Ribeiro EM, Van Naarden Braun K, Durkin MS, Pastula DM, Moore JT, Moore CA. Motor Abnormalities and Epilepsy in Infants and Children With Evidence of Congenital Zika Virus Infection. Pediatrics. 2018; 141Suppl 2: 167-179.
- Ong MS, Kohane IS, Cai T, Gorman MP, Mandl KD. Population-level evidence for an autoimmune etiology of epilepsy. JAMA Neurol. 2014; 71(5): 569-574.
- Martynyuk AE, Ucar DA, Yang DD, Norman WM, Carney PR, Dennis DM, Laipis PJ. (2007). Epilepsy in phenylketonuria: a complex dependence on serum phenylalanine levels. Epilepsia; 48(6): 1143-1150.
- Yildiz Y, Sivri, HS. Inborn Errors of Metabolism as Mimickers of Pediatric Neuropsychiatric Disorders: Phenylketonuria as an Example. Clin Mother Child Health. 2017; 14(255): 2.
- Ong MS, Kohane IS, Cai T, Gorman MP, Mandl KD. Population-level evidence for an autoimmune etiology of epilepsy. JAMA Neurol. 2014; 71(5): 569-574.
- Rahman Z, Wong CH, Dexter M, Olsson G, Wong M, Gebsky V, Nahar N, Wood A, Byth K, King M, Bleasel AB. Epilepsy in patients with primary brain tumors: the impact on mood, cognition, and HRQOL. Epilepsy Behav. 2015; 48: 88-95.
- Ullrich NJ, Pomeroy SL, Kapur K, Manley PE, Goumnerova LC, Loddenkemper T. Incidence, risk factors, and longitudinal outcome of seizures in long‐term survivors of pediatric brain tumors. Epilepsia. 2015; 56(10): 1599-1604.
- Kraemer DL, Awad IA. Vascular malformations and epilepsy: clinical considerations and basic mechanisms. Epilepsia. 1994; 35 Suppl 6: 30-43.
- Al-Shahi SR. The outlook for adults with epileptic seizure (s) associated with cerebral cavernous malformations or arteriovenous malformations. Epilepsia. 2012; 53 Suppl 4:34–42.
- Josephson CB, Rosenow F, Salman RAS. Intracranial vascular malformations and epilepsy. Semin Neurol. 2015; 35(3): 223-234.
- Takayama M, Hara K, Matsusue A, Waters B, Ikematsu N, Kashiwagi M, Kubo SI. Giant intracranial arteriovenous malformation as the focus of epileptic seizures. Neuropathology. 2017; 38(2):185-191.
- Fisher RS, Van Emde Boas W, Blume W, Elger C, Genton P, Lee P, Engel J Jr. Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE). Epilepsia. 2005; 46(4):470-2.
- Fisher RS, Acevedo C, Arzimanoglou A, Bogacz A, Cross JH, Elger CE, Engel J Jr, Forsgren L, French JA, Glynn M, Hesdorffer DC, Lee BI, Mathern GW, Moshé SL, Perucca E, Scheffer IE, Tomson T, Watanabe M, Wiebe S. ILAE official report: a practical clinical definition of epilepsy. Epilepsia. 2014; 55(4): 475–82.
- Manford M. Recent advances in epilepsy. J Neurol. 2017; 264(8): 1811-1824.
- Devilat M. Historia de la Epilepsia. Rev. chil. epilepsia. 2014; 14(2): 45-47.
- Ledoux JE. Cognition versus emotion, again-This time in the brain: a response to Parrott and Schulkin. Cognition & Emotion. 1993; 7(1): 61-64.
- López RLR, Carvajal AR, Fraga RV. Presencia de deterioro cognitivo y topografía anátomo-clínica en pacientes con epilepsia en Cienfuegos. Revista Finlay. 2015; 5(1): 34-46.
- Helmstaedter C, Witt JA. Epilepsy and cognition–A bidirectional relationship? Seizure. 2017; 49: 83-89.
- Ure, J. Deterioro cognitivo en pacientes epilépticos. Rev. argent. neuropsicol. 2004; 2(1): 1-14.
- Strauss E, Loring D, Chelune G, Hunter M, Hermann B, Perrine K, Westerveld M, Trenerry M, Barr W. Predicting cognitive impairment in epilepsy: findings from the Bozeman epilepsy consortium. J Clin Exp Neuropsychol. 1995; 17(6): 909-917.
- Law N, Benifla M, Rutka J, Smith ML. Verbal memory after temporal lobe epilepsy surgery in children: Do only mesial structures matter? Epilepsia. 2017; 58(2): 291-299.
- Breuer LEM, Grevers E, Boon P, Bernas A, Bergmans JWM, Besseling R, Klooster DCW, de Louw A, Mestrom RMC, Vonck K, Zinger S, Aldenkamp AP. Cognitive deterioration in adult epilepsy: Clinical characteristics of “Accelerated Cognitive Ageing”. Acta Neurol Scand. 2017; 136(1): 47-53.
- Holmes GL. Cognitive impairment in epilepsy: the role of network abnormalities. Epileptic Disord. 2015; 17(2): 101-116.
- Nickels KC, Wirrell EC. Cognitive and Social Outcomes of Epileptic Encephalopathies. Semin Pediatr Neurol. 2017; 24(4):264-275.
- Moavero R, Santarone ME, Galasso C, Curatolo P. Cognitive and behavioral effects of new antiepileptic drugs in pediatric epilepsy. Brain Dev. 2017; 39(6):464-469.
- Tang Y, Xia W, Yu X, Zhou B, Wu X, Lui S, Luo C, Huang X, Ouyang L, Chen Q, Gong Q, Zhou D. Altered cerebral activity associated with topiramate and its withdrawal in patients with epilepsy with language impairment: An fMRI study using the verb generation task. Epilepsy Behav. 2016; 59:98-104.
- Afawi Z, Mandelstam S, Korczyn AD, Kivity S, Walid S, Shalata A, Oliver KL, Corbett M, Gecz J, Berkovic SF, Jackson GD. TBC1D24 mutation associated with focal epilepsy, cognitive impairment and a distinctive cerebro-cerebellar malformation. Epilepsy Res. 2013; 105(1): 240-244.
- Lomlomdjian C, Múnera CP, Low DM, Terpiluk V, Solís P, Abusamra V, Kochen S. The right hemisphere’s contribution to discourse processing: A study in temporal lobe epilepsy. Brain Lang. 2017; 171: 31-41.
- Jackson DC, Dabbs K, Walker NM, Jones JE, Hsu DA, Stafstrom CE, Seidenberg M, Hermann BP. The neuropsychological and academic substrate of new/recent-onset epilepsies. J Pediatr. 2013; 162(5): 1047-1053.
- Bender AC, Natola H, Ndong C, Holmes GL, Scott RC, Lenck-Santini PP. Focal Scn1a knockdown induces cognitive impairment without seizures. Neurobiol Dis. 2013; 54: 297-307.
- Mingarro Castillo M, Carmona de la Morena J, Latre Martínez P, Portilla A, Miguel L. Síndrome de Dravet. Rev Clin Med Fam. 2014; 7(2): 134-136.
- Pérez AB. Síndrome de Dravet. Salus. 2015; 19(3): 27-30.
- Herranz JL. Repercusión cognitiva de las epilepsias precoces. Rev Neurol. 2007; 44 Suppl 3: 43-45.
- Rubinstein M, Westenbroek RE, Frank HY, Jones CJ, Scheuer T, Catterall WA. Genetic background modulates impaired excitability of inhibitory neurons in a mouse model of Dravet syndrome. Neurobiol Dis. 2015; 73: 106-117.
- Gandy M, Sharpe L, Perry KN, Miller L, Thayer Z, Boserio J, Mohamed A. The psychosocial correlates of depressive disorders and suicide risk in people with epilepsy. J Psychosom Res. 2013; 74:227–32.
- Salter KA, Prior KN, Bond MJ. Predicting wellbeing among people with epilepsy using illness cognitions. Epilepsy Behav. 2017; 71: 1-6.
- Kotwas I, Mcgonigal A, Bastien-Toniazzo M, Bartolomei F, Micoulaud-Franchi JA. Stress regulation in drug-resistant epilepsy. Epilepsy Behav. 2017. 71: 39-50.
- Kwon OY, Park SP. Depression and anxiety in people with epilepsy. J Clin Neurol. 2014; 10(3): 175-188.
- Gil-Nagel A, Lopez-Munoz F, Serratosa JM, Moncada I, Garcia-Garcia P, Alamo C. Effect of lamotrigine on sexual function in patients with epilepsy. Seizure. 2006; 15(3): 142-149.
- Lin CY, Burri A, Fridlund B, Pakpour AH. Female sexual function mediates the effects of medication adherence on quality of life in people with epilepsy. Epilepsy Behav. 2017; 67: 60-65.
- Sun L, Peräkylä J, Holm K, Haapasalo J, Lehtimäki K, Ogawa KH, Peltola J, Hartikainen KM. Vagus nerve stimulation improves working memory performance. J Clin Exp Neuropsychol. 2017; 39(10):954-964.
- Huang H, Wang J, Zhang J, Luo Z, Li D, Qiu X, Peng Y, Xu Z, Xu P, Xu Z. Nitrobenzylthioinosine mimics adenosine to attenuate the epileptiform discharge of hippocampal neurons from epileptic rats. Oncotarget. 2017; 8(22):35573-35582.
- Boison D. Adenosinergic signaling in epilepsy. Neuropharmacology. 2016; 104:131-139.
- Zhou Q, Zhu S, Guo Y, Lian L, Hu Q, Liu X, Xu F, Zhang N, Kang H. Adenosine A1 Receptors Play an Important Protective Role Against Cognitive Impairment and Long-Term Potentiation Inhibition in a Pentylenetetrazol Mouse Model of Epilepsy. Mol Neurobiol. 2018; 55(4):3316-3327.
| Recibido: 06 de agosto de 2018 | Aceptado: 21 de noviembre de 2018 |
Aranda-Abreu Gonzalo. Av. Luis Castelazo Ayala s/n, Xalapa, Veracruz, México. C.P. 91010, Tel: 52 (228) 8 418900 ext. 16311. E-mail: garanda@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
