El licopeno y su papel en la prevención del cáncer de próstata
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Artículo de Revisión
Deissy Herrera Covarrubias1*, Cynthia Fernández Pomares1, Gonzalo Emiliano Aranda Abreu2, Miguel Ángel Domínguez Ortiz3, María Elena Hernández Aguilar2.
1Doctorado en Neuroetología, Universidad Veracruzana, Xalapa, Ver., México. 2Centro de Investigaciones Cerebrales, Universidad Veracruzana, Xalapa, Ver., México. 3Instituto de Ciencias Básicas, Laboratorio de Productos Naturales, Universidad Veracruzana, Xalapa, Ver., México.
Resumen/Abstract
Contenido
Conclusiones
Agradecimientos
Referencias
Correspondencia
En la actualidad el cáncer ha ido en aumento en la población mexicana. Durante el 2011, el 86.3% de las defunciones por neoplasias en la población mexicana menor de 20 años fue debida a tumores malignos. En ese mismo año, ocho de cada 100 hombres de 20 años o mayores diagnosticados con cáncer presentaron neoplasia de próstata. Se calcula que de cada 100 defunciones por tumores malignos en hombres de 20 años o mayores, 17 fallecen por cáncer de próstata, 13 de bronquio y pulmón y nueve de estómago, ocupando el cáncer de próstata la primera causa de muerte en nuestro país por cáncer. Esto ha llevado a la innovación de nuevas terapias para la prevención, como incrementar el consumo de vitaminas, la utilización de extractos de plantas medicinales, minerales y el uso de compuestos fitoquímicos como el licopeno. Este último es un carotenoide altamente antioxidante y cuenta con una gran biodisponibilidad en el tejido prostático, por lo cual tiene una fuerte acción preventiva en las diversas enfermedades que afectan a la próstata, así como otros tipos de cánceres. Por tal motivo, esta revisión tiene como objetivo dar a conocer cuales son sus propiedades y los mecanismos usados para prevenir o detener las enfermedades de la próstata.
Palabras clave: Cáncer, carotenoides, licopeno, testosterona, prolactina.
Cardiovascular diseases and cancer have increased importantly in the Mexican population. In 2011, 86.3% of deaths were caused by malignant tumors in the population under 20 years. In the same year 8 out of 100 men aged 20 and older with cancer had prostate neoplasms. For every 100 deaths caused by malignant neoplasms in men, 17 were due to prostate cancer, 13 to lung and bronchus and 9 to stomach. Prostate cancer became the leading cause of death by cancer in our country. This has led to the innovation of new therapies for prevention such as increasing the consumption of vitamins, plant extracts, minerals and phytochemicals such as lycopene. The latter belongs to the family of carotenoids. Its antioxidant activity is highly concentrated in the prostate, so it has a strong preventive action of various diseases affecting the prostate and some types of cancer. This review focuses on the role of lycopene in prostate cancer prevention.
Key words: Cancer, carotenoids, lycopene, testosterone, prolactin.
La próstata es una glándula que depende de la presencia de hormonas como los andrógenos, estrógenos, prolactina (PRL) e insulina para mantener su crecimiento y función. De todos éstos, los andrógenos son los que ejercen los principales efectos en la próstata para mantener su crecimiento y función normal, pero también están implicados en el desarrollo de patologías como el cáncer de próstata. Además, existe una estrecha relación entre andrógenos y PRL la cual incrementa el número de receptores a andrógenos (RA) provocando así un mayor efecto de los andrógenos en la próstata y aumentando la proliferación celular que repercute no sólo en su anatomía sino en su función. La posible participación de PRL en el desarrollo del cáncer de próstata surge desde el punto de vista de que sus niveles en sangre incrementan en relación con la edad y coinciden con la presencia de las enfermedades prostáticas, es decir, la hiperplasia prostática benigna (HPB) y el cáncer.
A pesar de que existen medicamentos que pueden controlar el desarrollo de las enfermedades en la próstata, estos no han sido totalmente exitosos ya que en muchos casos los pacientes que en su momento respondieron al tratamiento se vuelven refractarios al mismo y desarrollan nuevamente la enfermedad pero de manera más agresiva y con expectativas de sobrevivencia muy escasas, es por ello que se ha recurrido a estrategias hacia la medicina alterna entre las que se encuentran los compuestos derivados de los alimentos como son los fitoestrógenos y licopeno, este último perteneciente a la familia de los carotenoides.
2. Licopeno: generalidades
Nuestro organismo está expuesto a una variedad de sustancias prooxidantes o radicales libres capaces de dañar las moléculas biológicamente importantes, como el ácido desoxirribonucleico (ADN), las proteínas, los carbohidratos y los lípidos.1 Por tal motivo, el cuerpo humano cuenta con un sistema de enzimas que contrarrestan el efecto de estos compuestos oxidantes y actúan como antioxidantes, estos bloquean la reactividad de los radicales libres,2 que en cantidades elevadas pueden ser dañinos y causantes de muerte celular. Los radicales libres son átomos que poseen un electrón desapareado por lo cual son sumamente reactivos y tienden a robar un electrón de moléculas químicamente estables con la única finalidad de alcanzar la estabilidad química. Una vez que esto sucede, la molécula que cede el electrón se convierte en un radical libre con lo cual robará electrones a las demás moléculas, dando lugar a una reacción en cadena que no terminará hasta que un agente reductor proporcione los electrones que requieren para que los capte el agente oxidante, que en este caso es el radical libre.2 Cabe mencionar que no todos los radicales libres producidos en nuestro organismo son dañinos; de hecho el sistema inmune los produce en cantidades moderadas para protegernos contra las bacterias y los virus,3 o en la producción de hormonas y la activación de enzimas necesarias para la vida. Los radicales libres que cumplen con ciertas funciones en el organismo son fácilmente neutralizados por la superóxido dismutasa y la glutatión peroxidasa.3 Sin embargo, el problema surge cuando se excede el número de radicales libres en el cuerpo dando lugar a un estado conocido como estrés oxidativo, ocasionando cambios estructurales y funcionales en la célula que pueden repercutir en la promoción de enfermedades como el cáncer.4 Así los antioxidantes como el licopeno, neutralizan la acción oxidante de los radicales libres antes de que logren dañar al cuerpo al proporcionar un electrón a las moléculas inestables y estabilizándolas antes de que utilicen electrones de otras moléculas y ocasione daños a su estructura.5
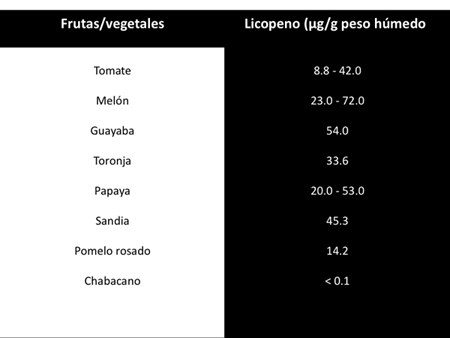
El consumo de una dieta abundante en carotenoides ha sido correlacionado epidemiológicamente con un riesgo menor de padecer diversas enfermedades.4 Dentro de los carotenoides encontrados en los alimentos (Tabla 1),6 el licopeno es considerado el más eficaz antioxidante del grupo.7,8 Predomina en el plasma humano con una vida media alrededor de 2-3 días.9 Es el más abundante en los frutos de color rojo, y se ingiere fundamentalmente a través del consumo de tomate8 en forma de salsa, frito, triturado, en jugo y también se obtiene en menor cantidad en el melón, guayaba, toronja, papaya, sandía, pomelo rosado y chabacano (Tabla 2).9,10
Tabla 1. Carotenoides presentes en los alimentos (tomado y modificado de Carranco y colaboradores, 2011).6
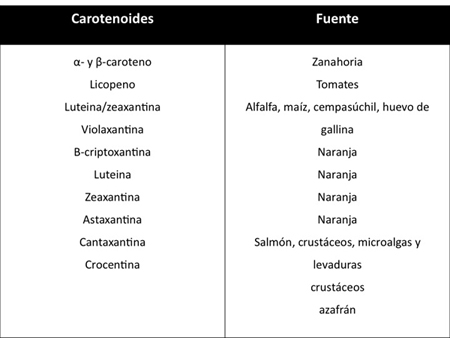
Tabla 2. Cantidad de licopeno presente en frutas y vegetales (tomado y modificado de Rao y Agarwal, 1999).9
El licopeno alimentario esta constituido principalmente por el isómero trans que es la forma termodinámicamente más estable, debido a su estructura química (Figura 1) es un compuesto altamente hidrofóbico.4 El consumo de alimentos ricos en licopeno y su aumento en sangre se asocia con la disminución en el riesgo de padecer cáncer prostático.11,14 La razón de ello, es que se ha demostrado que el licopeno se encuentra en altas concentraciones en la próstata sugiriendo un efecto directo en la prevención de las enfermedades prostáticas como el cáncer. Se ha reportado una serie de 10-15 isómeros diferentes en el suero y la próstata.15 Se ha propuesto que debido a su estructura química los isómeros cis pudieran incorporarse de mejor manera en las lipoproteínas donde pueden ser transportados fácilmente a los tejidos como la próstata, las formas isoméricas cis comúnmente identificadas en el licopeno son 5-cis, 9-cis, 13-cis y 15 cis.9
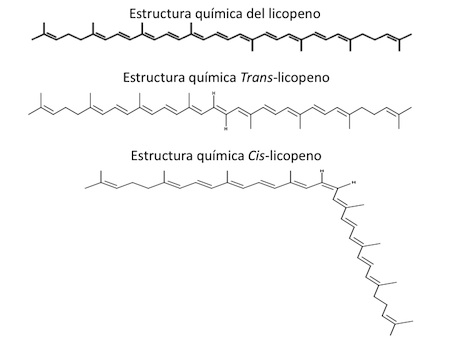
Figura 1. Estructura química del licopeno y sus isómeros Trans y Cis. En ella se pueden observan los dobles enlaces contenidos en el compuesto. Posee 40 átomos de carbono y 11 dobles enlaces conjugados (Tomado y modificado de Surh, 2003).19
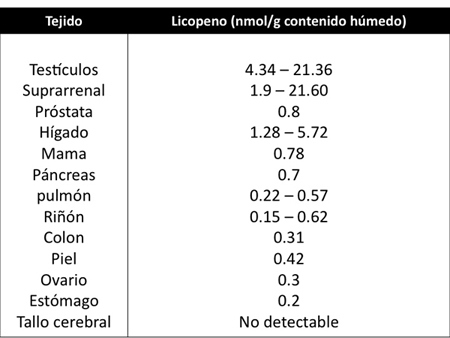
Los niveles de licopeno acumulables en los tejidos humanos también son variables encontrándose diferentes concentraciones en órganos (Tabla 3) como los testículos, glándulas suprarrenales, próstata, hígado, mama, páncreas, pulmón, riñón, colon, piel, ovarios y estómago.9 El mecanismo de captación de este compuesto en estos tejidos mencionados no es del todo claro, pero se ha especulado que estos tejidos poseen un gran número de receptores de lipoproteínas y que son las responsables de transportarlo.9
Tabla 3. Niveles de licopeno en tejido humano. (Tomado y modificado de Rao y Agarwal, 1999).9
Hasta hace unos años no se conocía la localización exacta del licopeno en la célula. Para entender más a fondo su mecanismo de acción, Liu y colaboradores,16 realizaron un estudio en donde utilizaron 3 diferentes líneas celulares (LNCaP, PC-3, DU145) de cáncer de próstata de humano, con la finalidad de averiguar la captación y localización del licopeno en este tipo de células. Sus hallazgos mostraron que el 55% de este compuesto se localiza en las membranas nucleares, el 26% en la matriz nuclear y el 19% en los microsomas, esto pudiera explicar el mecanismo por el cual el licopeno protege a la célula del estrés oxidativo. Debido a que el licopeno se encuentra en mayor cantidad dentro de la membrana nuclear, puede ejercer un efecto de protección directa contra los radicales libres extracelulares, neutralizando su acción oxidante e impidiendo su acción dentro del núcleo y el desarrollo de mutaciones en el ADN de la célula, por lo que si las defensas antioxidantes de la célula son menores que los oxidantes se origina lo que se conoce como el estrés oxidativo, el cual está vinculado con el desarrollo de diversas enfermedades como el cáncer.17
Otras propiedades encontradas al licopeno, es su efecto preventivo en contra de enfermedades cardiovasculares y se le ha atribuido que posee actividad anti aterogénica, anti asma y anti candidiasis.4
3. Cáncer de próstata
El cáncer es una de las principales causas de mortalidad a nivel mundial. La Organización Mundial de la Salud (OMS) estimó en 2008 que la principal causa de muerte en el mundo es el cáncer con un estimado de 7.6 millones de casos registrados.18 En México el cáncer de próstata ocupa el primer lugar de las causas de muerte en hombres (Figura 2), de tal manera que por cada 100 defunciones reportadas por tumores malignos en hombres de 20 años o más, 17 fallecen por cáncer de próstata, 13 por cáncer de pulmón y 9 por cáncer de estómago.18
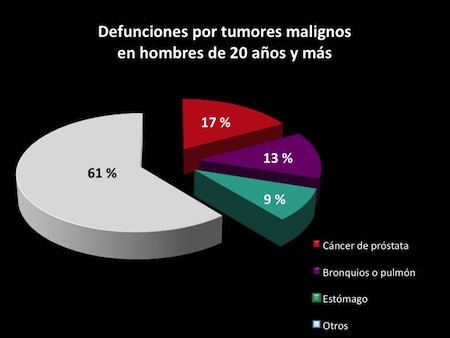
Figura 2. Datos de INEGI 2011. Porcentaje de casos de muerte por cáncer de próstata, pulmón y estómago. 18
El desarrollo del cáncer es un proceso que conlleva varias etapas de alteraciones moleculares y celulares. El inicio de un tumor es considerado como un proceso relativamente largo y reversible en el que proliferan de manera activa células pre neoplásicas que posteriormente pueden llegar a ser potencialmente invasivas y metastásicas.19
Las neoplasias malignas de próstata comprenden un amplio grupo de lesiones que representan una morbilidad colectiva que probablemente sea mayor que cualquier otro grupo de enfermedades, por lo menos en lo que respecta al mundo occidental.20
La etiología del cáncer de próstata, no es completamente clara, sin embargo existen factores que han sido asociados como factores de riesgo para desarrollar la enfermedad, como son: edad, población, hábitos dietéticos, antecedentes familiares y un factor clave que es el hormonal, el cual está directamente vinculado con el desarrollo del cáncer.21,22
4. Mecanismo molecular activado por hormonas
Es ampliamente conocido que los andrógenos son fundamentales en el desarrollo y función normal de la próstata.23 Sin embargo, la testosterona también está involucrada en el crecimiento prostático a un nivel anormal. Los andrógenos juegan un papel permisivo en la etiología de la hiperplasia prostática.24 Se ha descrito que los andrógenos son capaces de estimular el estroma prostático (Figura 3) al inducir el aumento en el número de RA al favorecer la producción de dihidrotestosterona (DHT) y alterar la apoptosis. La acción intracelular de los andrógenos está mediada por su RA considerado como el elemento clave en la cascada de la transducción de señal y como un objetivo de la terapia endocrina para el cáncer de próstata.25,26 Por lo mismo, las alteraciones cualitativas y/o cuantitativas del RA, así como sus posibles implicaciones en la progresión del cáncer de próstata ha causado un gran interés dentro de la comunidad científica.
Existen factores de crecimiento como el factor de crecimiento tumoral beta (TGFβ) y el factor de crecimiento insulínico tipo I (IGF-I) e interleucinas como la interleucina 6 (IL-6) que a través de varias vías de señalización (e.g. AKT, MAPK), incrementan la transcripción o la actividad del RA, propiciando la proliferación y crecimiento del tumor.27
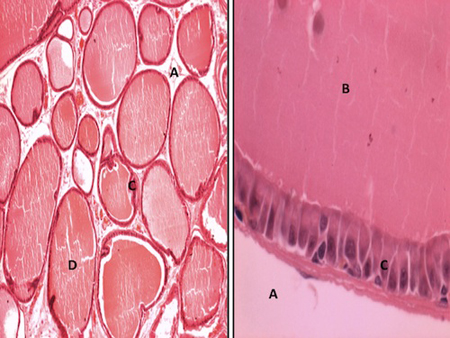
Figura 3. Cortes histológicos de próstata de rata. A) Estroma, B) Luz alveolar, C) Células epiteliales, D) alvéolos. Amplificación Izquierda (100 veces) Amplificación derecha (1000 veces) Técnica de tinción Hematoxilina-Eosina.
Además, se sabe que los andrógenos actúan en sinergismo con otras hormonas como la PRL, la cual potencia la acción de los andrógenos,28-30 ya que en algunos estudios se reporta la presencia de receptores a PRL en próstata.31,32 Se ha mostrado que niveles altos y sostenidos de esta hormona producen efectos estimulantes sobre el tracto reproductivo del macho, que incluyen acciones directas e indirectas sobre la próstata,33 favoreciendo su crecimiento y funcionamiento.34,35 Se ha sugerido que la PRL tiene función en la regulación del desarrollo prostático, crecimiento y diferenciación.31 A pesar de que el mecanismo por el cual la PRL afecta el crecimiento de la próstata no es del todo conocido, se sabe que en la próstata aumenta los niveles del RA, participa en la inflamación, aumenta la función secretora del epitelio e incrementa la producción de acido cítrico, de IGF-1 y de proteínas especificas en la próstata.36
El mecanismo de acción de PRL se lleva a cabo a través de su interacción con un receptor específico localizado en la membrana de las células diana el cual pertenece a las superfamilia de receptores de citocinas. Presenta diversas isoformas que difieren en la secuencia y longitud de su dominio citoplasmático, con lo cual se podría explicar las acciones pleiotrópicas de esta hormona en las células.37 Estos receptores al unirse con PRL forman el complejo PRL-RPRL, el cual activa vías de señalización intracelular como las STAT, las MAPK y las AKT que inducen proliferación, diferenciación o supervivencia celular,38 mismas que están implicadas en el cáncer de próstata y se ha demostrado que en tumores de próstata existe sobreexpresión de sus receptores.39
En un estudio reciente (datos sin publicar),40 se diseñó un modelo hormonal para la inducción de patologías prostáticas donde se exploró el efecto preventivo del licopeno sobre tejido prostático que desarrolló displasia o también conocida como neoplasia intraepitelial inducida por la adición de testosterona y prolactina que se considera una lesión premaligna en la próstata por lo que los cambios displásicos en este tejido son considerados como precursores del cáncer. Los resultados obtenidos mostraron que la adición de licopeno previene las alteraciones histológicas en los tratamientos de 3 meses con el antioxidante, pero a los 6 meses de tratamiento hormonal, la administración de licopeno no detiene el desarrollo de la displasia, aunque atenúa el efecto inducido hormonalmente. Esto corrobora que el licopeno es un eficaz antioxidante que puede prevenir la displasia prostática pero no curarla del todo.40
5. Mecanismo de prevención del licopeno
Dado que el cáncer de próstata es una lesión sumamente frecuente y con alto impacto en la población masculina, es deseable detectarlo en etapas tempranas donde puedan ofrecerse las mejores posibilidades de tratamiento, con el fin de mejorar el pronóstico de los pacientes afectados. Por ello, se ha buscado nuevas alternativas terapéuticas que han dado resultados prometedores, tal es el caso del licopeno. Estudios realizados en diferentes laboratorios nos dejan claro que el licopeno puede disminuir la expresión de andrógenos e IGF-1,41 inhibir vías de señalización implicadas en la proliferación, inflamación y antiapoptóticas (e.g IGF-1, IL-6, NFkB),41 así como disminuir los niveles del antígeno prostático especifico (PSA) en pacientes diagnosticados con HPB,42 factores implicados en el desarrollo del cáncer, entre otras acciones (Tabla 4).
6. Licopeno e IGF-I
La función del licopeno se ha vinculado principalmente a su potente efecto antioxidante; sin embargo, se conoce que el licopeno también inhibe la proliferación celular al interferir con la señalización de IGF-1,12,43 el cual ha sido implicado como un factor importante de riesgo de cáncer. Por ejemplo, se ha asociado que niveles sanguíneos altos de IGF-I incrementan el riesgo de cáncer de próstata, mama, colorrectal y pulmón.44-46
Tabla 4. Probables funciones biológicas del licopeno. Se muestra una tabla con las funciones que el licopeno puede tener en el organismo, actuando de manera importante en la prevención de enfermedades crónicas como el cáncer (tomado y modificado de Mein y colaboradores, 2008).12

El IGF-I también posee efectos mitogénicos y antiapoptóticos en las células epiteliales de próstata normales y transformadas. Se ha revelado que el incremento de IGF-I y bajas concentraciones en plasma de IGFBP-3 han sido asociados de manera independiente con un mayor riesgo de cáncer de próstata.47
El mecanismo propuesto por el cual el licopeno ejerce su efecto en IGF-I, es reduciendo la estimulación de la fosforilación en la tirosina del sustrato 1 del receptor de insulina y la capacidad de unión del ADN del factor de transcripción AP-1. También puede incrementar las concentraciones de IGFBP-1, la función de esta proteína ligadora es transportar a IGF-I desde el interior del espacio vascular al espacio extracelular, así como modular la actividad mitogénica IGF-I y retirar el exceso de esta en los tejidos, con ello atenuando su actividad y reduciendo el riesgo de cáncer de próstata.47
Las interacciones entre el estroma y las células epiteliales influyen en el funcionamiento de los tejidos sensibles a hormonas, por esto son reconocidas como un área importante en la investigación de diversas enfermedades, entre ellas el cáncer.41 Uno de los factores que median estas interacciones es el factor de crecimiento tipo insulina -1 (IGF-1), el cual participa en la proliferación y diferenciación celular a través de la unión con su receptor (IGF-1R). El 90% de IGF-I en plasma se encuentra asociado a proteínas de unión denominadas IGFB, sistema encargado del transporte y almacenamiento de este factor de crecimiento.48
Además de su potente efecto antioxidante, el licopeno ejerce su acción anticancerígena a través de diversos mecanismos que impiden los efectos mitogénicos y antiapoptóticos de IGF-1.43 Evita la unión del IGF-1 a su receptor, esto lo logra aumentando las concentraciones de IGFBP-1, el cual retira el exceso de este factor en los tejidos, interfiriendo con la señalización de IGF-1 y la activación de las vías PI3K/Akt y Ras/MAPK, ya que disminuye la fosforilación de varios mensajeros que participan en esta vía (Akt e IRS-1).49,50 Además, se ha visto que en tejido prostático de rata, tanto normal como maligno, el licopeno inhibe la señalización de andrógenos,51 ejerce efectos antiproliferativos en la próstata e induce apoptosis mitocondrial en células LNCaP.52
Los estudios realizados por Liu y colaboradores,41 en humanos muestran que la dihidrotestosterona (DHT) modula la expresión de IGF-I, IGFBP-2 y IGFBP-3 solo en células cancerígenas estromales prostáticas (6S) pero no en cultivos primarios de células estromales humanas (CALP). Asimismo, ellos encontraron que al administrar el licopeno, éste inhibe la señalización de DHT y disminuye la producción de IGF-I a través de la reducción de la localización nuclear de RA y β-catenina; e inhibe la estimulación del crecimiento a través IGF-I mediante la atenuación de sus efectos en la fosforilación de la serina AKT y GSK3B y la fosforilación de la tirosina.41
Por otra parte, estudios realizados por Siler y colaboradores,43 mostraron que el licopeno regula de forma más notoria el proceso antiinflamatorio en el tejido normal de próstata mientras que en el tejido tumoral reduce los efectos androgénicos. También afirman que el licopeno no interfiere con el crecimiento normal de la próstata. Además reduce la señalización local de andrógenos en la próstata, así como la expresión de IGF-I y las señales inflamatorias (IL-6, NFkB).43 Debido a que todos estos mecanismos son conocidos por ser importantes en el desarrollo del cáncer de próstata, su inhibición por el licopeno es una explicación creíble para la relación entre el alto el consumo de licopeno y la reducción de riesgo de cáncer de próstata.
7. Licopeno y vías de señalización
El licopeno puede participar en el bloqueo de vías de señalización que activan al factor nuclear kappa B (NFkB), el cual es un factor de transcripción que posee un papel fundamental en las respuestas celulares. Los factores de transcripción regulan la expresión de genes y su activación conlleva a la expresión de diversos genes que codifican para proteínas, enzimas, adhesinas, y citocinas entre otras.53 NFkB tiene un papel esencial en respuestas inflamatorias y de supervivencia celular.54 Está presente en el citoplasma de todas las células de los mamíferos de manera inactiva a través de la asociación con proteínas inhibitorias denominadas IkB que incluyen a IkBa, IkBb, IkBeard, IkBg.55 Las proteínas IkB intervienen en las funciones citoplasmáticas y nucleares de la vía de señalización de NFkB debido a que la función principal de IkBa es la de retener a NFkB en el citoplasma de células no estimuladas y retirarlo del núcleo.56
Existe una amplia gama de estímulos que derivan en la activación de NFkB tales como el factor de necrosis tumoral (TNF), interleucina 1 (IL-1), radiación ultravioleta, citocinas, radicales libres, productos virales y bacterianos,54 que conllevan a la fosforilación de proteínas IkB a través de la proteína IKK, una serina-treonina kinasa específica.54 El mecanismo por el cual las citocinas pueden activar el complejo IKK no es aun concreto, pero se ha propuesto que MAPKKK fosforila a IKK y con ello activan a NFkB. Con lo anterior pudiéramos decir que la PRL puede activar a NFkB a través de MAPK. Se sabe también que el NFkB puede ser activado por la vía de las AKT otra vía de señalización usada por PRL y que participa en la supervivencia celular. Se ha demostrado que la activación de NFkB contribuye en gran medida a la formación de tumores al proveer señales de vigilancia anti-apoptótica en las células epiteliales; y que este factor es fundamental en la relación de la inflamación crónica,57 y el desarrollo del cáncer.58 Aunque no se ha demostrado del todo la elevación constante o puntual de PRL, ésta promueve la activación de MAPK así como la alteración histológica de la próstata.59 Por lo tanto es posible suponer que bajo estas condiciones PRL esté mediando sus efectos mediante la activación de NFkB, hipótesis que se está trabajando en este momento, pero su importancia reside en la posible conexión que parece tener la acción estimulatoria de PRL y el efecto inhibitorio de licopeno sobre la acción de NFkB (Figura 4).60,61 Un análisis realizado por Hung y colaboradores,62 señala que el licopeno afecta de manera importante la vía de señalización de NFkB, atenuando la fosforilación de IkB inducida por TNFα así como la expresión de NFkB y su translocación del citoplasma al núcleo. Investigaciones realizadas por Siler y colaboradores,43 reportan que el licopeno, además de reducir la expresión de IGF-I en tejido de próstata, disminuye las citocinas inflamatorias como IL-1 y las quimiocinas (CXC), MIP-2 y LIX, sugiriendo un efecto antiinflamatorio del licopeno y posiblemente anti-cancerígeno.
Debido a que las citocinas antes mencionadas regulan la transcripción de IL-6 a través de la vía del factor nuclear NFkB, el cual se activa en procesos inflamatorios como la prostatitis crónica o relacionada con un riesgo mayor de cáncer de próstata, un efecto antiinflamatorio del licopeno puede contribuir de manera importante en la prevención del cáncer de próstata.43 Cabe señalar que NFkB controla muchos genes implicados en la inflamación, por lo tanto su bloqueo es un objetivo importante en la terapia contra el cáncer.58,63,64
8. Licopeno y PSA
El antígeno prostático específico (PSA por sus siglas en inglés) es una proteína producida por la próstata, que participa en la disolución del coágulo seminal.65 Su producción depende de la presencia de andrógenos y del tamaño de la próstata. Una pequeña parte de PSA pasa a la circulación sanguínea y se mide para el diagnóstico, pronóstico y seguimiento del cáncer de próstata. Los niveles plasmáticos de PSA en hombres sanos son muy bajos y se sitúan por debajo de 4ng/mL,66 pero existen situaciones que pueden modificar sus niveles como es la eyaculación o el ejercicio físico, la estimulación táctil o la biopsia de próstata.65
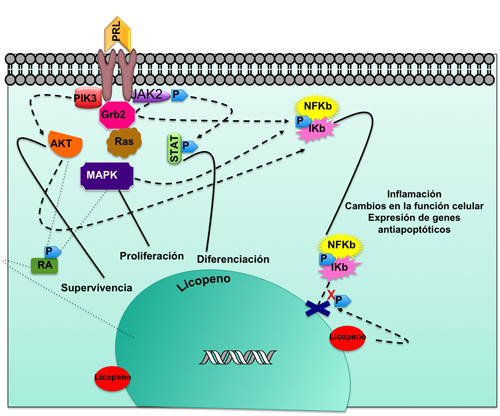
Figura 4. Rutas de señalización intracelular que participan en el cáncer. Mecanismo de prevención del licopeno (Tomado y modificado de Valdivia y Martínez, 2008; Pascual y colaboradores, 2009).60, 61
El PSA es considerado como un marcador tumoral de cáncer de próstata, de tal modo que cuanto más avanzado sea el proceso tumoral sus valores en sangre aumentan. No obstante, ciertos pacientes con cáncer de próstata tienen niveles de PSA normales y bajos en pacientes con hiperplasia o cáncer, por lo tanto el PSA no es una prueba específica en la detección cáncer de próstata,67,68 pero es de gran utilidad siempre y cuando se conjunte con otras pruebas como el tacto rectal, el ultrasonido, etc. Independientemente de las controversias que pueda tener como un marcador para poder determinar si el individuo presenta o no alguna enfermedad en la próstata, el PSA ha sido una herramienta útil para poder determinar el efecto del consumo de diversos compuestos que se sabe pueden detener el avance de la enfermedad como es el licopeno. Desde este punto de vista, se ha reportado que el consumo de una dieta rica en licopeno (pasta de tomate que contenía 13 mg de este caroteno) puede reducir los niveles de PSA a las 10 semanas de su ingesta en pacientes diagnosticados con HPB.42
Aunque no se sabe con exactitud cual es el mecanismo mediante el cual el licopeno reduce los niveles en sangre de PSA, uno de los mecanismos que se proponen es una acción anti andrógenica, ya que la síntesis de PSA es mediada por los andrógenos.42,69 Otro mecanismo que parece involucrar el efecto preventivo del licopeno es mediante la regulación de la conexina 43 (Cx43). La Cx43 es un miembro de la gran familia de proteínas que forman las uniones gap; estas uniones permiten el paso directo de iones y moléculas (Ca2+, AMPc, GMPc, IP3) menores a 1000 Daltons o 1kD, entre el citoplasma de células adyacentes. Su función no sólo es importante para la célula sino entre las células por lo que las mutaciones de los genes que expresan estas proteínas pueden generar anormalidades en la función de la célula y en casos más graves en la generación de enfermedades como el cáncer de próstata.70,71 Aunque no son muchos los trabajos que existen respecto a su papel en el inicio y progresión de la enfermedad, se ha encontrado que la expresión de múltiples conexinas puede dar lugar a la formación de canales disfuncionales en tumores o cáncer de próstata debido a una baja en la expresión de Cx43 y Cx32.47 Interesantemente, las hormonas esteroides restauran la comunicación célula-célula únicamente en enfermedades no tan avanzadas como son los tumores.72 Sin embargo, también está la posición que indica que los efectos del licopeno no son mediados de manera directa sino mediante la formación de metabolitos como los retinoides o los apo-12-licopenoles, sin que se altere la expresión de Cx43. En su lugar, estos autores proponen que su efecto es a través de la reducción de la proliferación celular al inhibir el ciclo celular;73 es decir, la expresión de Cx43 promueve el contacto célula-célula y aumenta la formación de uniones gap funcionales de tal manera que este mecanismo en conjunto inhibe la motilidad celular.74 También es de importancia señalar que se apoya la hipótesis que los compuestos rojos o amarillos contenidos en los tomates son los que realmente realizan el efecto de expresión de las Cx43 más que el propio licopeno.75 Independientemente de las hipótesis que actualmente se manejan en relación al licopeno y las conexinas, lo cierto es que este carotenoide guarda alguna relación con estas proteínas. Efectos que tendrán que seguir siendo evaluados en un futuro.
Los beneficios del licopeno por sí solo aún están siendo cuestionados y hasta se ha sugerido que otros componentes presentes en el tomate pudieran ejercer los efectos preventivos contra cáncer. Por ejemplo, en la década pasada Clinton y sus colaboradores,76,77 mostraron con un modelo de cáncer en ratas inducido por androgenos y NMU (N-methyl-N-nitrosourea) la ausencia de efecto anticáncer en el grupo que recibió licopeno en la dieta. Sin embargo, un grupo adicional de ratas que recibió suplemento alimenticio a base de polvo de tomate sí mostró una disminución de riesgo de muerte por el cáncer. Con esto los autores plantearon la posibilidad de que “otros” componentes presentes en el tomate pudieran ser los responsables del efecto anticáncer. Se conoce que en el tomate aparte de licopeno contiene agua (94%), hidratos de carbono (3.5%), proteínas (1%), grasas (0.11%) y fibra (1.4%); y en menor cantidad minerales (potasio, magnesio), vitaminas (B1, B2, B5, C) que pueden proteger al organismo de diversas enfermedades. Vale la pena mencionar que algunos trabajos que ponen en duda el papel del licopeno muestran concentraciones dietéticas que pudieran ser subóptimas para lograr un efecto anticáncer.78
Con los datos de esta revisión observamos que la prevención del cáncer de próstata esta asociado con el consumo en la ingesta de antioxidantes entre ellos el licopeno y se argumenta que el licopeno puede prevenirlo o disminuirlo. Por lo tanto, introducirlo a la nuestros hábitos alimenticios proporcionará un beneficio mayor para prevenir aquellas enfermedades que frecuentemente disminuyen nuestra calidad de vida. No obstante todos los beneficios mostrados en esta revisión nos dan una pauta para inclinarnos de manera favorable a que el consumo en la dieta de este carotenoide contribuye de forma considerable en la prevención del cáncer de próstata, sin embargo se necesitan más estudios para comprender mejor la función del licopeno en la salud humana.
Al consejo Nacional de Ciencia y Tecnología (CONACyT) por la beca de doctorado No. 205712 otorgada a DHC, proyecto CONACyT No. 106531 (MEH) y por el Cuerpo académico de Neuroquímica UV-CA-304.
- Halliwell B. Establishing the significance and optimal intake of dietary antioxidants: the biomarker concept. Nutr Rev 1999 57: 104-113.
- Stahl W, Sies H. Antioxidant activity of carotenoids. Mol Aspects Med 2003 24: 345-351.
- Céspedes M, Ela M. Enzimas que participan como barreras fisiológicas para eliminar radicales libres. Rev Cubana Invest Biomed 1996 15: 75-78.
- Vitale A, Bernatene E, Pomillo A. Carotenoids in chemoprevention: Lycopene. Acta Bioquím Clín Latinoam 2010 44: 195-238.
- Di Mascio P, Kaiser S, Sies H. Lycopene as the most efficient biological carotenoid singlet oxygen quencher. Arch Biochem Biophys 1989 274: 532-538.
- Carranco M, Calvo M, Pérez F. Carotenoides y su function antioxidante: Revisión. Arch Latinoam Nutr. 2011 61: 233-241.
- Giovannucci E, Rimm EB, Liu Y, Stampfer MJ, Willett WC. A prospective study of tomato products, lycopene, and prostate cancer risk. J Natl Cancer I 2002 94: 391-398.
- Romero I, Ferruelo A, Berenguer A. Diet and prostate cancer. Actas Urol Esp 2003 27: 399-409.
- Rao A, Agarwal S. Role of lycopene as antioxidante carotenoid in the prevention of chronic diseases: a review. Nutr Res 1999 19: 305-323.
- Melendez AJ, Vicario IM, Heredia FJ. Carotenoid pigments: structural and physicochemical considerations. Arch Latinoam Nutr 2007 57: 109-117.
- Giovannucci E, Ascherio A, Rimm EB, Stampfer MJ, Colditz GA, Willett WC. Intake of carotenoids and retinol in relation to risk of prostate cancer. J Natl Cancer I 1995 87: 1767-1776.
- Mein JR, Lian F, Wang XD. Biological activity of lycopene metabolites: implications for cancer prevention. Nutr Rev 2008 66: 667-683.
- Giovannucci E. Tomatoes, tomato-based products, lycopene, and cancer: review of the epidemiologic literature. J Natl Cancer I 1999 91: 317-331.
- Gann PH, Ma J, Giovannucci E, Willett W, Sacks FM, Hennekens CH, Stampfer MJ. Lower prostate cancer risk in men with elevated plasma lycopene levels: results of a prospective analysis. Cancer Res 1999 59: 1225-1230.
- Clinton SK, Emenhiser C, Schwartz SJ, Bostwick DG, Williams AW, Moore BJ, Erdman JW, Jr. cis-trans lycopene isomers, carotenoids, and retinol in the human prostate. Cancer Epidem Biomar 1996 5: 823-833.
- Liu A, Pajkovic N, Pang Y, Zhu D, Calamini B, Mesecar AL, van Breemen RB. Absorption and subcellular localization of lycopene in human prostate cancer cells. Mol Cancer Ther 2006 5: 2879-2885.
- Avello M, Suwalsky M. Radicales libres, estrés oxidativo y defensa antioxidante celular. Ciencia Ahora 2006 17: 8-13.
- INEGI. Estadísticas a propósito del día mundial contra el cáncer. 2013.
- Surh YJ. Cancer chemoprevention with dietary phytochemicals. Nat Rev Cancer 2003 3: 768-780.
- Foster CS. Predictive factors in prostatic hyperplasia and neoplasia. Hum Pathol 1990 21: 575-577.
- Rodríguez M, Baluja C, Bermúdez S. Patologías benignas de la próstata: prostatitis e hiperplasia benigna. Rev Biomed 2007 18: 47-59.
- Rodríguez S, Herrera D, Becerra P, Silva M, Locia J, Martínez M, González Z, Hernández ME. Prolactin and prostate cancer. Rev Med UV 2007 7: 26-31.
- Thompson TA, Wilding G. Androgen antagonist activity by the antioxidant moiety of vitamin E, 2,2,5,7,8-pentamethyl-6-chromanol in human prostate carcinoma cells. Mol Cancer Ther 2003 2: 797-803.
- Gonzalez S, Salcedo J, Martínez M. Últimos avances en el diagnóstico de la hiperplasia benigna de próstata. Acta Bioquím Clín Latinoam 2005 39: 171-185.
- So AI, Hurtado-Coll A, Gleave ME. Androgens and prostate cancer. World J Urol 2003 21: 325-337.
- Grossmann ME, Huang H, Tindall DJ. Androgen receptor signaling in androgen-refractory prostate cancer. J Natl Cancer I 2001 93: 1687-1697.
- Heinlein CA, Chang C. Androgen receptor in prostate cancer. Endocr Rev 2004 25: 276-308.
- Gilleran JP, Putz O, DeJong M, DeJong S, Birch L, Pu Y, Huang L, Prins GS. The role of prolactin in the prostatic inflammatory response to neonatal estrogen. Endocrinology 2003 144: 2046-2054.
- Van Coppenolle F, Slomianny C, Carpentier F, Le Bourhis X, Ahidouch A, Croix D, Legrand G, Dewailly E, Fournier S, Cousse H, Authie D, Raynaud JP, Beauvillain JC, Dupouy JP, Prevarskaya N. Effects of hyperprolactinemia on rat prostate growth: evidence of androgeno-dependence. Am J Physiol Endocrinol Metab 2001 280: E120-129.
- Nicoll C. Physiological Actions of Prolactin En: Field J, Magoun H, Hall V (Ed). Handbook of physiology. A critical, comprehensive presentation of physiological knowledge and concepts. 1994 pp 263-264.
- Nevalainen MT, Valve EM, Ingleton PM, Nurmi M, Martikainen PM, Harkonen PL. Prolactin and prolactin receptors are expressed and functioning in human prostate. J Clin Invest 1997 99: 618-627.
- Ouhtit A, Morel G, Kelly PA. Visualization of gene expression of short and long forms of prolactin receptor in rat reproductive tissues. Biol Reprod 1993 49: 528-536.
- Prins GS, Lee C. Biphasic response of the rat lateral prostate to increasing levels of serum prolactin. Biol Reprod 1983 29: 938-945.
- Costello LC, Franklin RB. Testosterone and prolactin regulation of metabolic genes and citrate metabolism of prostate epithelial cells. Horm Metab Res 2002 34: 417-424.
- Mena F, Aguayo D, Hummelt G, Morales M. Regulación y control de la secreción de prolactina en la rata. Rev Fac Med UNAM 1992 35: 115-123.
- Bole-Feysot C, Goffin V, Edery M, Binart N, Kelly PA. Prolactin (PRL) and its receptor: actions, signal transduction pathways and phenotypes observed in PRL receptor knockout mice. Endocr Rev 1998 19: 225-268.
- Villanueva LA, Garcia E. Prolactin and its role in the regulation of ovarian function. Ginecol Obstet Mex 1998 66: 512-516.
- Dominguez-Caceres MA, Garcia-Martinez JM, Calcabrini A, Gonzalez L, Porque PG, Leon J, Martin-Perez J. Prolactin induces c-Myc expression and cell survival through activation of Src/Akt pathway in lymphoid cells. Oncogene 2004 23: 7378-7390.
- Mendoza M, García E. Papel de la prolactina en el cáncer de próstata. Rev Mex Urol 2010 70: 55-60.
- Herrera D. Efecto del licopeno en los cambios histologicos de la próstata inducidos por prolactina y testosterona en la rata. Sin publicar Tesis de Doctorado, Universidad Veracruzana. 2013.
- Liu X, Allen JD, Arnold JT, Blackman MR. Lycopene inhibits IGF-I signal transduction and growth in normal prostate epithelial cells by decreasing DHT-modulated IGF-I production in co-cultured reactive stromal cells. Carcinogenesis 2008 29: 816-823.
- Edinger MS, Koff WJ. Effect of the consumption of tomato paste on plasma prostate-specific antigen levels in patients with benign prostate hyperplasia. Braz J Med Biol Res 2006 39: 1115-1119.
- Siler U, Herzog A, Spitzer V, Seifert N, Denelavas A, Hunziker PB, Barella L, Hunziker W, Lein M, Goralczyk R, Wertz K. Lycopene effects on rat normal prostate and prostate tumor tissue. J Nutr 2005 135: 2050S-2052S.
- Yu H, Spitz MR, Mistry J, Gu J, Hong WK, Wu X. Plasma levels of insulin-like growth factor-I and lung cancer risk: a case-control analysis. J Natl Cancer I 1999 91: 151-156.
- Mantzoros CS, Bolhke K, Moschos S, Cramer DW. Leptin in relation to carcinoma in situ of the breast: a study of pre-menopausal cases and controls. Int J Cancer 1999 80: 523-526.
- Hankinson SE, Willett WC, Colditz GA, Hunter DJ, Michaud DS, Deroo B, Rosner B, Speizer FE, Pollak M. Circulating concentrations of insulin-like growth factor-I and risk of breast cancer. Lancet 1998 351: 1393-1396.
- Kucuk O, Sarkar FH, Sakr W, Djuric Z, Pollak MN, Khachik F, Li YW, Banerjee M, Grignon D, Bertram JS, Crissman JD, Pontes EJ, Wood DP, Jr. Phase II randomized clinical trial of lycopene supplementation before radical prostatectomy. Cancer Epidem Biomar 2001 10: 861-868.
- Gunnell D, Oliver SE, Peters TJ, Donovan JL, Persad R, Maynard M, Gillatt D, Pearce A, Hamdy FC, Neal DE, Holly JM. Are diet-prostate cancer associations mediated by the IGF axis? A cross-sectional analysis of diet, IGF-I and IGFBP-3 in healthy middle-aged men. Brit J Cancer 2003 88: 1682-1686.
- Ivanov NI, Cowell SP, Brown P, Rennie PS, Guns ES, Cox ME. Lycopene differentially induces quiescence and apoptosis in androgen-responsive and -independent prostate cancer cell lines. Clin Nutr 2007 26: 252-263.
- Karas M, Amir H, Fishman D, Danilenko M, Segal S, Nahum A, Koifmann A, Giat Y, Levy J, Sharoni Y. Lycopene interferes with cell cycle progression and insulin-like growth factor I signaling in mammary cancer cells. Nutr Cancer 2000 36: 101-111.
- Siler U, Barella L, Spitzer V, Schnorr J, Lein M, Goralczyk R, Wertz K. Lycopene and vitamin E interfere with autocrine/paracrine loops in the Dunning prostate cancer model. FASEB J 2004 18: 1019-1021.
- Hantz HL, Young LF, Martin KR. Physiologically attainable concentrations of lycopene induce mitochondrial apoptosis in LNCaP human prostate cancer cells. Exp Biol Med 2005 230: 171-179.
- Egido J, Hernández P, Tuñón J, Blanco-Colio L, Ortego M, Suzuki Y, Plaza J, Guijarro C. El factor de transcripción kB (NFkB) y las enfermedades cardiovasculares. Cardiovasc Risk Fact 2000 9: 92-102.
- Baud V, Karin M. Is NF-kappaB a good target for cancer therapy? Hopes and pitfalls. Nat Rev Drug Discov 2009 8: 33-40.
- Shen HM, Tergaonkar V. NFkappaB signaling in carcinogenesis and as a potential molecular target for cancer therapy. Apoptosis 2009 14: 348-363.
- Luo JL, Maeda S, Hsu LC, Yagita H, Karin M. Inhibition of NF-kappaB in cancer cells converts inflammation- induced tumor growth mediated by TNFalpha to TRAIL-mediated tumor regression. Cancer Cell 2004 6: 297-305.
- Baud V, Karin M. Signal transduction by tumor necrosis factor and its relatives. Trends Cell Biol 2001 11: 372-377.
- Nakanishi C, Toi M. Nuclear factor-kappaB inhibitors as sensitizers to anticancer drugs. Nat Rev Cancer 2005 5: 297-309.
- Hernández ME, Pascual L, Rodriguez S, Aranda-Abreu G, Manzo J. Prolactin receptors and signal pathways in the rat prostate following the increase of systemic prolactin. Cartel presentado en Experimental Biology. Boston, Massachussets. 2013.
- Valdivia A, Martínez G. Foundations of the clinical use of erythropoietin as a neuroprotective agent. Rev Cubana Farm (On line) 2008 42.
- Pascual LI, Manzo J, Goffin G, Kessal K, Aranda-Abreu GE, Estudillo C, Hernández ME. Prolactina: mecanismos intracelulares involucrados en la function prostática. Rev Med UV 2009 9: 37-40.
- Hung CF, Huang TF, Chen BH, Shieh JM, Wu PH, Wu WB. Lycopene inhibits TNF-alpha-induced endothelial ICAM-1 expression and monocyte-endothelial adhesion. Eur J Pharmacol 2008 586: 275-282.
- Tabruyn SP, Griffioen AW. NF-kappa B: a new player in angiostatic therapy. Angiogenesis 2008 11: 101-106.
- Tabruyn SP, Griffioen AW. A new role for NF-kappaB in angiogenesis inhibition. Cell Death Differ 2007 14: 1393-1397.
- Inzunza J, Gorena M, Inostroza C, Velásquez C. Role of the prostate specific antigen as a marker of prostatic pathology. Clínica y ciencia. 2004 2: 49-54.
- Blanes M, Velázquez G, Cabral M. Valores de referencia del antígeno prostático especifico. Mem Inst Invest Cienc Salud 2005 3: 23-27.
- Partin AW, Carter HB, Chan DW, Epstein JI, Oesterling JE, Rock RC, Weber JP, Walsh PC. Prostate specific antigen in the staging of localized prostate cancer: influence of tumor differentiation, tumor volume and benign hyperplasia. J Urology 1990 143: 747-752.
- Brawn PN, Speights VO, Kuhl D, Riggs M, Spiekerman AM, McCord RG, Coffield KS, Stewart DT, Lind ML. Prostate-specific antigen levels from completely sectioned, clinically benign, whole prostates. Cancer 1991 68: 1592-1599.
- Chen L, Stacewicz M, Duncan C, Sharifi L, Ghosh L, Breemen R, Ashton D, Bowen P. Oxidative DNA damage in prostate cancer patients consuming tomato sauce-based entrees as a whole-food intervention. J Natl Cancer I 2001 93: 1872-1879.
- Saez JC, Berthoud VM, Branes MC, Martinez AD, Beyer EC. Plasma membrane channels formed by connexins: their regulation and functions. Physiol Rev 2003 83: 1359-1400.
- Plotkin LI, Manolagas SC, Bellido T. Transduction of cell survival signals by connexin-43 hemichannels. J Biol Chem 2002 277: 8648-8657.
- Carruba G, Stefano R, Cocciadiferro L, Saladino F, Di Cristina A, Tokar E, Quader ST, Webber MM, Castagnetta L. Intercellular communication and human prostate carcinogenesis. Ann NY Acad Sci 2002 963: 156-168.
- Ford NA, Elsen AC, Zuniga K, Lindshield BL, Erdman JW. Lycopene and apo-12'-lycopenal reduce cell proliferation and alter cell cycle progression in human prostate cancer cells. Nutr Cancer 2011 63: 256-263.
- Daniel-Wojcik A, Misztal K, Bechyne I, Sroka J, Miekus K, Madeja Z, Czyz J. Cell motility affects the intensity of gap junctional coupling in prostate carcinoma and melanoma cell populations. Int J Oncol 2008 33: 309-315.
- Gitenay D, Lyan B, Talvas J, Mazur A, George S, Caris-Veyrat C, Rock E. Serum from rats fed red or yellow tomatoes induces Connexin43 expression independently from lycopene in a prostate cancer cell line. Biochem Bioph Res Co 2007 364: 578-582.
- Boileau TW, Liao Z, Kim S, Lemeshow S, Erdman JW. Clinton SK. Prostate carcinogenesis in N-methyl-N-nitrosourea (NMU)-testosterone-treated rats fed tomato powder, lycopene, or energy-restricted diets. J Natl Cancer I 2003 95: 1578-1586.
- Clinton SK. Tomatoes or lycopene: a role in prostate carcinogenesis? J Nutr. 2005 135: 2057S-2059S.
- Imaida K, Tamano S, Kato K, Ikeda Y, Asamoto M, Takahashi S, Nir Z, Murakoshi M, Nishino H, Shirai T. Lack of chemopreventive effects of lycopene and curcumin on experimental rat prostate carcinogenesis. Carcinogenesis 2001 22: 467-472.
Correspondencia:
*Correspondencia: Laboratorio de Neuroquímica, Centro de Investigaciones Cerebrales (CICE), Universidad Veracruzana. Av. Dr. Luis Castelazo s/n, Col. Industrial Las Animas Xalapa, Ver. C.P. 91190 Teléfono: (228) 8418900 Ext. 13616 Correo electrónico: dherrera@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
