Efecto del estrés agudo prepuberal sobre la próstata: Histología y expresión de OB-R, PRL-R, IL-6 y NFkB en la rata
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Instituto de Investigaciones Cerebrales
Universidad Veracruzana
Deissy Herrera-Covarrubias1*, Carlos A. Pérez-León2*, Cynthia Fernández-Pomares1, Genaro A. Coria-Avila1, Viridiana Sánchez-Zavaleta3, Gonzalo E. Aranda-Abreu1, Jorge Suárez-Medellín1, Fausto Rojas-Durán1, María Elena Hernández1
1Instituto de Investigaciones Cerebrales; 2Facultad de Bioanálisis-Xalapa; 3Doctorado en Investigaciones Cerebrales; Universidad Veracruzana, Xalapa, Ver.
Abstract
Introducción
Materiales y métodos
Resultados
Discusión
Conclusiones
Conflicto de intereses
Referencias
Mail
Resumen: El estrés aumenta los niveles séricos de leptina y prolactina, lo cual puede facilitar la proliferación, diferenciación y supervivencia celular implicadas en el desarrollo del cáncer. Se exploró el efecto del estrés prepuberal agudo inducido por una inyección de lipopolisacárido de E. coli (LPS) sobre los cambios histológicos en la próstata dorsolateral (PDL) y ventral (PV) y sobre la expresión de receptores de leptina (OB-R), prolactina (PRL-R), factor nuclear kB (NF-kB) e interleucina 6 (IL-6). Previo al inicio de la pubertad en el día posnatal 35, un grupo experimental de machos recibió una única inyección de LPS (1.5 mg/kg) y el grupo control recibió solución salina. Para confirmar la eficacia del LPS se evaluó la presencia de ptosis, piloerección, letargia, acurrucamiento y cifosis en ambos grupos durante 48 h. En el día posnatal 90 las ratas se sacrificaron para determinar la histología de la próstata (tinción con hematoxilina y eosina) y los receptores se analizaron mediante la técnica de Western Blot. En el periodo prepuberal solo los animales tratados con LPS mostraron signos de enfermedad durante las primeras 24 h post inyección. En la edad adulta expresaron lesiones en la PDL y PV, así como un incremento del área alveolar en PV y un menor número de receptores para el PRL-R corto de 50 kD. Como conclusión se determinó que una única inyección de LPS durante el periodo prepuberal modifica las características histológicas y moleculares de la próstata de la rata, lo cual adiciona información para explicar el efecto del estrés sobre el desarrollo de patologías como el cáncer.
Palabras clave: Estrés, Próstata, Cáncer, Prolactina, Pubertad, LPS.
Stress can increase the serum levels of leptin and prolactin, which in turn, can facilitate cell proliferation, differentiation and survival, implicated in cancer development. Herein, we explored the main effects of exposure to a single event of acute prepuberal stress induced by the injection of E. coli lipopolysaccharide (LPS) on histological changes in the dorsolateral (DLP) and ventral (VP) prostate, and on the expression of receptors for leptin (OB-R), prolactin (PRL-R), nuclear factor kB (NF-kB), and interleukin 6 (IL-6). Before the start of puberty (PND 35) one group of experimental males received a single injection of lipopolysaccharide (LPS, 1.5 mg/kg) whereas the control group received saline. To confirm the efficacy of LPS rats were monitored for ptosis, piloerection, lethargy, cuddling and kyphosis during 48 h after injection. At PND 90 the rats were euthanized for prostate histology (hematoxylin and eosin stain) and receptors were analyzed by western blots. During the prepuberal test only LPS males expressed signs of sickness during 24 h. In adulthood, LPS males expressed histological prostatic lesions in DLP and VP, and larger alveoli area in VP. Those males also expressed less PRL-R 50 kD receptors in VP. One single exposure to LPS during the prepuberal period can modify histological and molecular features of the rat’s prostate, which in turn, can help explain the effects of stress on the development of prostatic pathologies such as cancer.
Keywords: Stress, Prostate, Cancer, Prolactin, Puberty, LPS.
La próstata es una glándula sexual exocrina masculina, susceptible a diferentes patologías. Por ejemplo, puede inflamarse como consecuencia de lesiones físicas o infecciones; también puede agrandarse paulatinamente con la edad resultando en hiperplasia benigna (BPH) o puede desarrollar alteraciones más severas como cáncer.1-3 El cáncer de próstata (CaP) es el segundo más común a nivel mundial, representando aproximadamente 15% de los casos de cáncer en hombres4 Cada año se detectan cientos de miles de casos nuevos y aproximadamente 6.6% son letales.4 Por lo tanto, múltiples estudios se enfocan en dilucidar los diferentes factores de riesgo y sus detonantes de desarrollo. Por ejemplo, se sabe que existe mayor susceptibilidad en aquellos individuos que presentan alguno de los siguientes factores: ser mayores de 65 años,5 tener ascendencia Africana,6 consumir dietas altas en grasas de origen animal,7 tener obesidad,8 o con ciertas adicciones como al tabaco.9 Sin embargo, las alteraciones hormonales parecen representar el factor principal, tanto para el desarrollo de CaP como para su tratamiento.10 Esto sugiere que aquellas condiciones que modifiquen los niveles sistémicos de hormonas o sus receptores en la próstata pudieran ser exploradas como factores de riesgo.
Se sabe que el estrés puede producir cambios sutiles en algunas hormonas y sus receptores. Las respuestas al estrés ocurren como mecanismos alostáticos para mantener o recuperar la homeostasis del organismo. Por ejemplo, animales estresados por restricción crónica de movimiento expresan niveles más altos de leptina sérica.11 Además, los receptores de leptina (OB-R) también están aumentados en la próstata de pacientes que han desarrollado CaP.12-14 De manera similar, el estrés por restricción de movimiento eleva los niveles séricos de prolactina (PRL)15 y altos niveles de prolactina elevan los niveles de receptores (PRL-R) en la próstata.16 La unión del ligando-receptor PRL/PRL-R activa vías de señalización como las tirosina cinasas JAK, STAT y MAPK,17 las cuales facilitan la proliferación, diferenciación y sobrevivencia celular. El estrés también se asocia con un estado de inflamación subclínica donde se incrementan la producción del factor NFkB e interleucinas proinflamatorias (IL-6).18,19 El factor NFkB e IL-6 son importantes porque forman parte de la cadena molecular necesaria para la expresión de metaloproteasas vinculadas al desarrollo y metástasis del CaP.20
Cabe señalar que el estrés durante etapas críticas del desarrollo puede tener efectos adversos a largo plazo. Por ejemplo, la pubertad se ha considerado como un periodo crítico con relevancia para el desarrollo de enfermedades a largo plazo, especialmente aquellas relacionadas con hormonas del eje hipotálamo-pituitaria-adrenal (HPA), el cual responde con más intensidad en la pubertad que en la edad adulta.21 Se ha mostrado que en la pubertad el estrés por restricción de movimiento durante 30 minutos de manera aguda resulta en picos más prolongados de hormona adrenocorticotrópica (ACTH) y corticosterona que en los adultos. Además, las ratas pubertas con restricción de movimiento crónico (30 minutos diarios) muestran picos más altos que regresan más rápido al nivel basal.22 Lo mismo se ha observado con los niveles de prolactina, los cuales incrementan más en ratas pubertas por estrés crónico que en adultas.23 Estas respuestas hormonales exageradas por estrés durante la pubertad parecen asociarse con mayor susceptibilidad al desarrollo de CaP en la edad adulta. En un estudio reciente se mostró que un solo evento de estrés agudo intenso durante la pubertad en ratas también producía niveles más altos de prolactina y corticosterona en suero, pero además se asociaba con mayor expresión de lesiones prostáticas precancerosas.24 Específicamente, ese estudio utilizó la inyección de la endotoxina lipopolisacárida (LPS) de la bacteria E. coli para inducir un reto inmunológico y una respuesta al estrés aguda. El tratamiento agudo con LPS resulta en una elevación de interleucinas, ciclooxigenasas (COX-2), prostaglandinas (PGE2), factor de necrosis tumoral (TNFγ), interferón gamma (INFγ)25-26 y factor NF-kB.27 Cuando las ratas que recibieron LPS en la pubertad llegaron a la edad adulta fueron sometidas a un análisis histológico de la próstata. Se observaron más casos de metaplasia y displasia epitelial en la próstata dorsolateral y ventral (30-60%), anisocitosis (80-100%), anisocariosis (40-80%), apolaridad del núcleo (40-80%), y una baja proporción del tamaño núcleo-citoplasma (45-70%).24 Tal evidencia muestra que el efecto del estrés durante la pubertad es relevante para entender posibles alteraciones neuroendócrinas a largo plazo. Por lo tanto, el presente trabajo se enfocó en explorar el efecto del estrés inducido por LPS durante el periodo prepuberal en la expresión de receptores para OB-R, PRL-R, NFkB, IL-6 y su relación con cambios histológicos de la próstata de la rata. Hipotetizamos que el estrés prepuberal eleva dichos receptores asociado a alteraciones histológicas en la edad adulta.
2.1. Animales
Se utilizaron 12 ratas macho Wistar (Rattus norvegicus albinus) obtenidas de un pie de cría procedente de un proveedor certificado (Circulo ADN). Las ratas se mantuvieron en grupos de 6 en cajas de plexiglás jumbo (50×30×20 cm) y se mantuvieron en la colonia del Instituto de Investigaciones Cerebrales, Universidad Veracruzana, México, en un ciclo de luz inverso 12–12 h (luces encendidas 8:00 h). Las ratas consumieron agua purificada y alimento comercial (Lab Diet 5001) ad libitum. Todos los procedimientos se realizaron de acuerdo con la Norma Oficial Mexicana (NOM-062-ZOO-1999) para el cuidado y uso de animales de laboratorio y fueron aprobados por el comité interno para cuidado y uso de animales de laboratorio del Instituto de Investigaciones Cerebrales (CICUAL-IICE).
2.2. Grupos y tratamientos
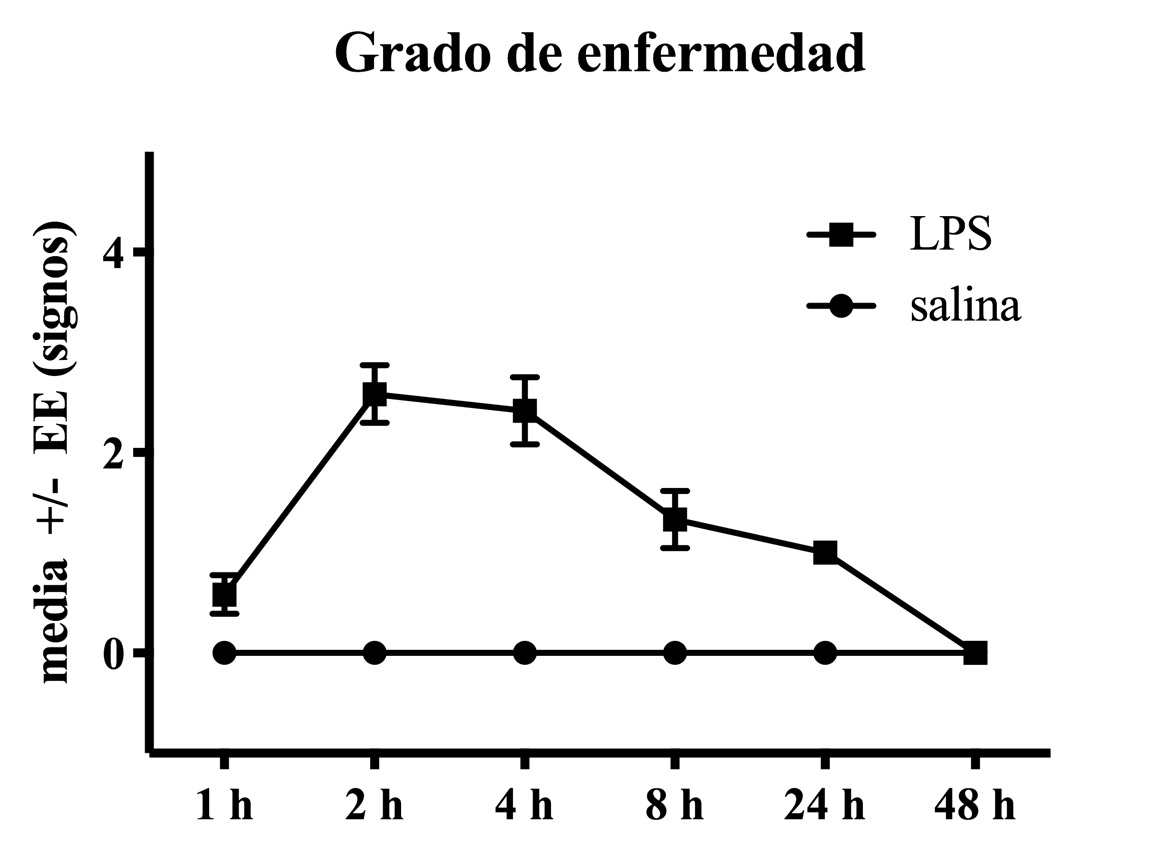
En el día posnatal (DPN) 21 las ratas fueron destetadas y se formaron dos grupos: Salina (n=6) y LPS (n=6). En el DPN 35 el grupo LPS recibió una inyección intraperitoneal (i.p.) de LPS (lipopolisacárido de E. coli, Sigma-Aldrich Cat. L3755) en una dosis de 1.5 mg/kg en un volumen de 1 ml de solución salina (0.9%). El grupo salina recibió exclusivamente la inyección de solución salina en el mismo volumen. Para confirmar que el LPS tuviera efectos, las ratas se monitorearon a las 2, 4, 8, 24 y 48 h después de la inyección y se evaluó su estado general de respuesta considerando 5 signos de enfermedad (ptosis, piloerección, letargia, acurrucamiento, cifosis) igual a trabajos previos.24,26,28 En cada evaluación las ratas recibieron un puntaje de 0 a 5, dependiendo del número de signos observados (Figura 1).
2.3. Muestras de próstata e histología
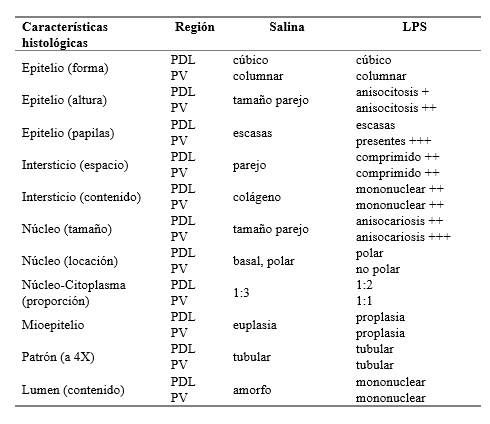
En el DPN 90 las ratas se sometieron a eutanasia con una sobredosis de pentobarbital sódico (120 mg/kg i.p.). Posteriormente se realizó una incisión abdominal y se removió cuidadosamente la próstata para colocarse en un recipiente con solución salina 0.9%. Se identificaron los lóbulos dorsolateral (PDL) y ventral (PV) con ayuda de un microscopio de disección (MEJI, EMZ-TR). La mitad izquierda de cada lóbulo se procesó para histología. El procedimiento consistió en inmersión en formol al 10% durante 24 h, deshidratación en alcohol al 70% y 80% (1 h cada uno), en alcohol 95% tres veces (2 h cada uno), alcohol al 100% toda la noche. Además, al día siguiente se realizaron dos cambios adicionales en alcohol, una hora cada uno. Después se colocaron en xileno 3 veces (1 hora cada uno) en agitación constante. El tejido se introdujo en cera parafina 2 veces (2 h cada vez). Se cortó a 5 μm de grosor con un microtomo (RM 2125RT Leica, Alemania), y se montó en laminillas de vidrio en baño maría a 52ºC (El baño contenía gelatina tipo A de piel porcina 2.5 mg/100 ml) para después procesarse con la tinción de hematoxilina y eosina (H&E) de acuerdo a la siguiente técnica: 1 h a 57ºC, desparafinización con tres baños en xileno (5 min cada uno), rehidratación en una mezcla de alcohol/xileno (1:1) por 5 min, en etanol 96% por 3 min, hematoxilina por 10 min, agua por 30 s, alcohol ácido (inmersión rápida), agua por 10 s, carbonato de litio por 30 s, agua por 10 s, eosina (4 inmersiones rápidas). Deshidratación en etanol 96% por 3 min, etanol 100% por 2 min, etanol/xileno 1:1 por 2 min, y xileno por 5 min. Después, las laminillas fueron cubiertas con permount (SP15-500 Fisher chemicals), secadas al aire y observadas bajo un microscopio de luz (Optisum®MIC990). Se tomaron fotomicrografías a 40x (y 100x para el diámetro del núcleo). El análisis histológico incluyó la altura epitelial, el área alveolar y el área del núcleo, así como la descripción histopatológica general (Tabla 1).
2.4. Análisis de receptores por Western blot
La mitad derecha de los lóbulos dorsolateral (PDL) y ventral (PV) se procesaron para analizar la expresión de proteínas por medio de la técnica Western blot. Después de la extracción de la próstata las dos porciones fueron separadas y almacenadas a -80ºC hasta su análisis. Para la extracción de proteína se utilizó buffer de lisis NP-40 (al 1% Nonidet P 40, Glicerol, NaCl 5 M, Tris 1 M, pH 8) y cOmplete™, tabletas Mini Protease Inhibitor (1 tableta/10 ml buffer de lisis; RocheDiagnostics, Indianapolis, Indiana, USA). La concentración de proteína se determinó por espectrofotometría con un kit de medición de proteína Pierce® BCA (ThermoScientific, Rockford, Illinois, USA). La electroforesis de proteína se hizo en geles al 10% SDS-PAGE para PRL-R, OB-R y al 12% para p-NFκB p50 e IL-6. Las muestras se trataron con un buffer Laemmli. Posteriormente, las proteínas se transfirieron a nitrocelulosa (Bio Rad, California, USA) (para PRL-R, OB-R y p-NFκB p50) y membranas PVDF (Immobilon-P, Millipore, Bedford, MA) (para IL-6), respectivamente; seguido de lavados con TBS-Tween 1% y bloqueo con TBS-Tween-leche 5% por 1 h a temperatura ambiente. Después del lavado se incubaron las membranas durante 18 h a 4° C con anticuerpos primarios: anti-PRL-R monoclonal de ratón (dilución 1:500, ab2772; Abcam, Cambridge, MA, USA), anti p-NFκB p50 monoclonal de ratón (dilución 1:1000, sc-271908; Santa Cruz Biotechnology, Inc., Dallas, Texas, USA), anti OB-R monoclonal de ratón (B-3) (dilución 1:200, sc-271908; Santa Cruz Biotechnology), anti IL-6 IgG2b monoclonal de ratón (dilución 1:200, sc-57315; Santa Cruz Biotechnology) y anti GAPDH policlonal de conejo (dilución 1:500, sc-25778; Santa Cruz Biotechnology). Después, las membranas se lavaron y se trataron con los anticuerpos secundarios correspondientes por 1 h a temperatura ambiente, AP cabra-anti ratón (IgG1, dilución 1:500, ab97020; Abcam) y AP cabra-anti conejo IgG1 (dilución 1:1000, sc: 2004, Santa Cruz Biotechnology). Finalmente, las proteínas se detectaron con solución 1-Step TM NBC/BCIP (ThermoScientific, Rockford, Illinois, USA). Las membranas se escanearon en un lector ChemiDoc XRS+ (Bio Rad, California, USA) y la densidad proteica se analizó con el software Image J 1.52n (Wayne Rasband, National Institutes of Health, USA). La expresión de GAPDH se usó como control de carga para PRL-R, OB-R y p-NFκB p50, y tinción con Coomassie para IL-6.29 La expresión de proteína se reportó como densidad normalizada al control de carga.
2.5. Análisis estadístico
Cada rata fue colocada en una caja de acrílico (27 × 17 × 15.5 cm), con un electrodo saliente de una de sus paredes (90 mm de longitud; 8 mm de diámetro) 2 cm por arriba de una capa de aserrín. El aserrín cubrió 5 cm de altura sobre la superficie de la caja. El electrodo fue conectado a un estimulador (Grass S-44 Quincy, Massachusetts, USA) acoplado en serie a una unidad de aislamiento (Grass Instruments SIU5) y luego a una unidad de corriente constante (Grass, Instruments CCU1A), proporcionando una corriente directa (0.3 mA). La prueba duró 10 minutos a partir de que la rata tocó el electrodo. Se evaluó la latencia al primer enterramiento, el tiempo acumulativo de enterramiento y el tiempo total de congelamiento. Las sesiones fueron videograbadas en un software Any-Maze (Stoelting Co., Canadá) y analizadas mediante un programa elaborado en lenguaje Pascal por uno de los autores CMC) que emplea tiempo real para permitir la captura de eventos en el tiempo. En el análisis estadístico solo se incluyeron los datos en los que los dos observadores independientes concordaron.
2.5.1. Signos de la enfermedad
Solo se realizó una descripción del promedio de la intensidad (0-5) y la duración (0–48 h) de los signos después del tratamiento con LPS.
2.5.2. Histología
Se realizó una descripción histopatológica del tejido prostático y de manera adicional se tomaron medidas de la altura epitelial (μm), el área alveolar (μm2) y el área nuclear (μm2), las cuales se evaluaron con una t-student (de una cola) para grupos independientes.
2.5.3. Western Blot
Para el análisis de densidad de OB-R, PRL-R, IL-6, y p-NFκB se utilizó una t-student (de una cola) para grupos independientes. Para OB-R y p-NFκB 130 kD la densidad normalizada se transformó a logaritmo 10. Todos los análisis estadísticos se realizaron con el software Prism GraphPad versión 8.00 para Mac, GraphPad Software, La Jolla California USA, www.graphpad.com y el nivel alfa se consideró cuando p< 0.05.
3.1. Signos de enfermedad
De las 12 ratas que recibieron LPS previo a la pubertad (DPN 35) todas expresaron signos de enfermedad 2 horas después de la inyección. Esto indicó que las ratas LPS respondieron al reto inmunológico y presentaron una respuesta al estrés. La frecuencia de los signos en orden descendente fueron letargia, acurrucamiento, ptosis, piloerección y cifosis. El pico máximo ocurrió a las 2 h y duró menos de 48 h. De las 12 ratas que recibieron solución salina ninguna expresó signos de enfermedad después de la inyección (Figura 1).
3.2. Histología y expresión de receptores
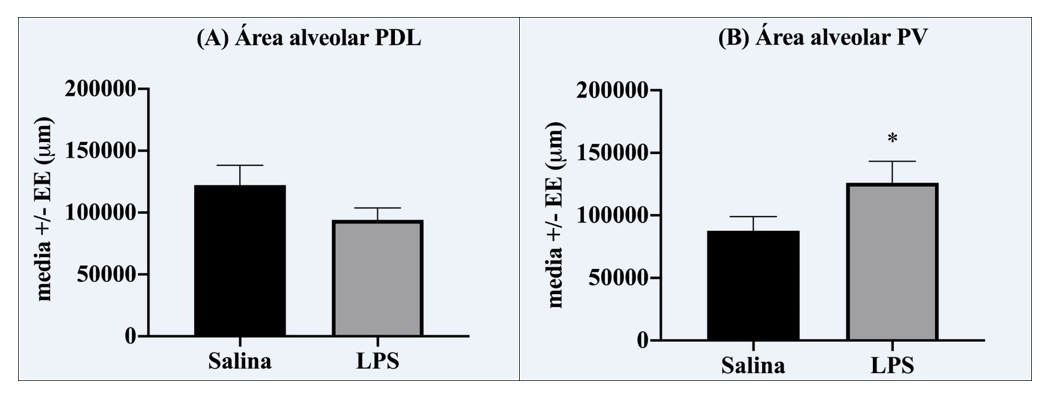
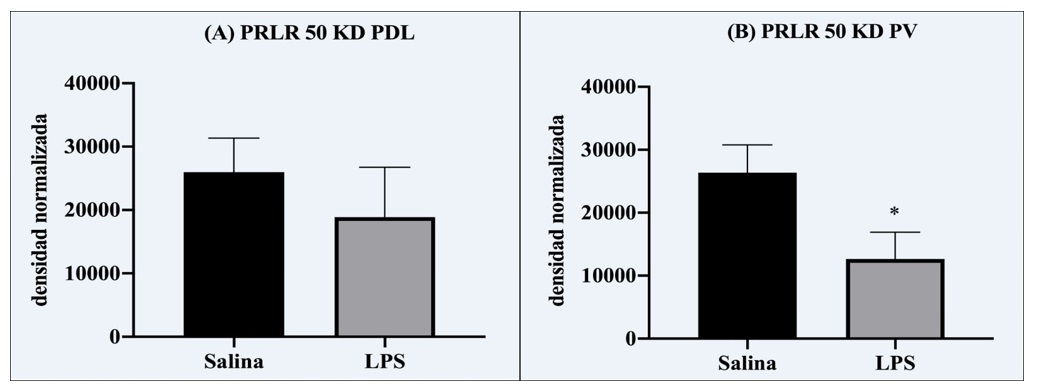
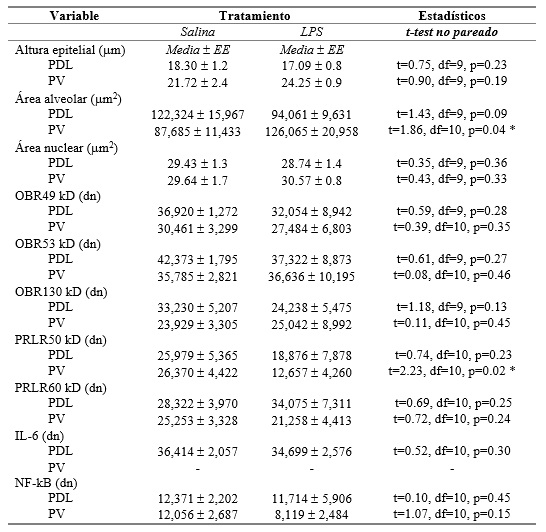
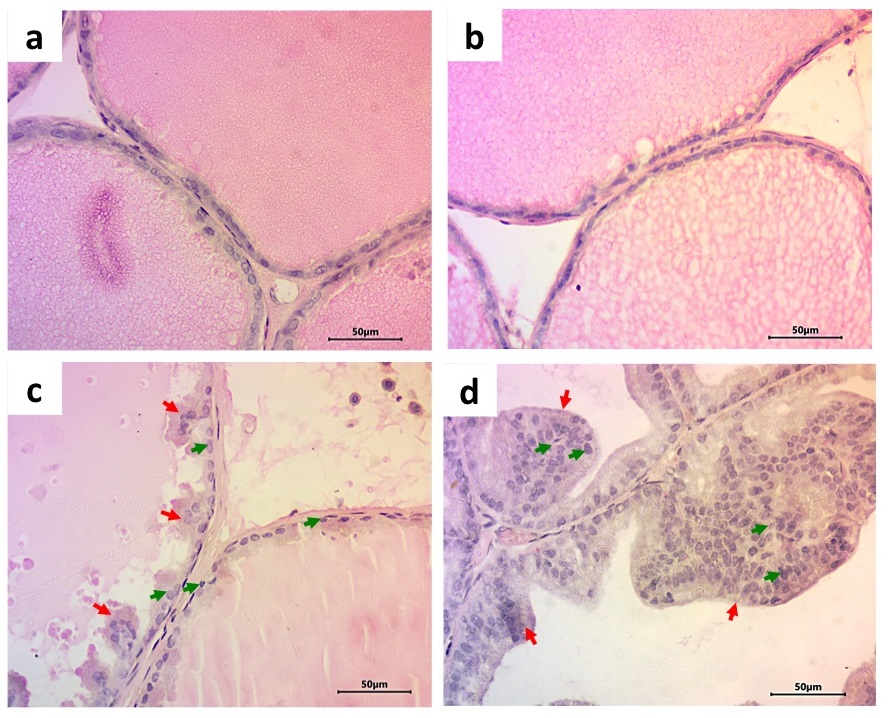
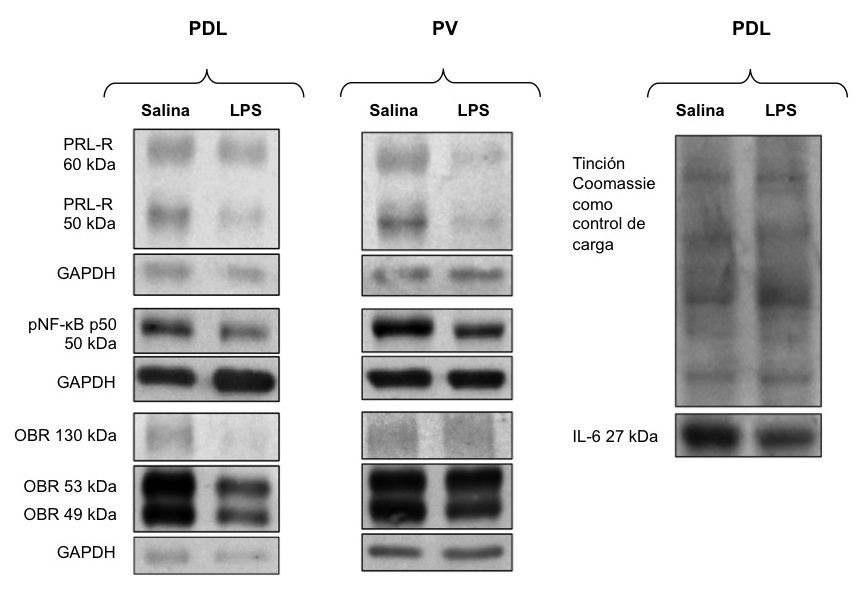
El análisis de la próstata mostró que el tratamiento con LPS previo a la pubertad resultó en alteraciones histológicas y moleculares en la edad adulta principalmente en la próstata ventral. Por ejemplo, el epitelio mostró anisocitosis (células con tamaño variado de altura epitelial), anisocariosis (células con tamaño variado de núcleo), espacio intersticial comprimido, con contenido de células mononucleares (indicadoras de un proceso inflamatorio) y gran presencia de papilas. Las células mostraban núcleos apolares con una proporción núcleo-citoplasma anormal (1:1), proplasia del mioepitelio y contenido amorfo en el lumen (Tabla 1, Figura 4). Los animales LPS también mostraron un aumento en el tamaño de área alveolar en el lóbulo ventral con respecto al grupo salina (aproximadamente del 143%) (Figura 2-B, 4), pero no en el lóbulo dorsolateral (Figuras 2-A, 4). Respecto a los cambios moleculares, los receptores PRL-R cortos de 50 kD estuvieron disminuidos a un 47% en la próstata ventral comparados con el grupo salina (Figura 3-B), pero no en la porción dorsolateral (Figura 3-A, 5). No se encontraron otros efectos del LPS en la altura epitelial o en el área nuclear, ni en la expresión de OB-R (49, 53, 130 kD), en PRL-R (60 kD), IL-6 o NFkB (Tabla 2). Además, no se encontró expresión de IL-6 en el lóbulo ventral.
Figura 1. Evaluación de signos de enfermedad después del tratamiento con LPS. Solo las ratas tratadas con LPS mostraron signos 1 h después de la inyección.
Tabla 1. Resultados del análisis descriptivo histopatológico en la próstata de ratas adultas (13 semanas de edad) que recibieron solución salina o LPS en la pubertad (5 semanas de edad).
Figura 2. Área alveolar de la próstata dorsolateral (A) y ventral (B). Se aprecia que el tratamiento con LPS en la pubertad incrementó el área exclusivamente en la región ventral.
Figura 3. Expresión del receptor de prolactina (PRL-R) en la próstata dorsolateral (A) y ventral (B). Se aprecia que el tratamiento con LPS en la pubertad disminuyó la expresión exclusivamente en la región ventral.
Tabla 2. Resultados estadísticos del análisis histológico y molecular.
El presente trabajo fue diseñado para evaluar el efecto del estrés agudo prepuberal sobre las características histológicas de la próstata de la rata y la expresión de receptores para las hormonas leptina y prolactina, así como para marcadores moleculares de inflamación como el NFkB e IL-6. Los resultados indicaron que una inyección sistémica con LPS en el DPN 35 provocó signos de enfermedad a 2 h después de la inyección y hasta por 24 h. La expresión de dichos signos indicó que el LPS funcionó para producir un reto inmunológico y una respuesta al estrés de manera aguda (Figura 1). Como resultado hubo efectos adversos en la próstata que se observaron a largo plazo hasta la edad adulta (DPN 90). Los hallazgos principales indicaron cambios histopatológicos, además de un claro aumento en el tamaño alveolar. A nivel molecular se encontró menor expresión de receptores de prolactina (PRL-R 50 kD) en la porción ventral. No se observó evidencia de que el LPS incrementara la expresión de OB-R, PRL-R, NFkB o IL-6.
Figura 4. Fotomicrografía de próstata de rata. Imagen capturada a 40X. Cortes teñidos con hematoxilina-eosina. Se muestran imágenes representativas de los epitelios de animales control en los lóbulos dorsolateral (A) y ventral (B), o tratados experimentalmente con LPS en la próstata dorsolateral (C) y ventral (D). Las flechas rojas muestran las papilas en los animales con LPS. Las flechas verdes muestran las células con anisocitosis (tamaño celular diferente) y anisocariosis (tamaño nuclear diferente). Se observa tejido displásico, pérdida de la polaridad en los animales con LPS, así como una disminución en la relación núcleo-citoplasma (1:1) y mioepitelio proplásico.
De manera general las alteraciones histopatológicas encontradas indican una displasia leve. Es decir, un cambio ligero en la forma y madurez de las células que sugiere una alteración funcional. Comúnmente las displasias leves suelen considerarse como reversibles.30 Sin embargo, es probable que estas lesiones observadas en la adultez sean permanentes, o que empeoren de manera incipiente hasta convertirse en displasias severas o cáncer (CaP).31 Lo anterior pudiera ocurrir por alteraciones neuroendocrinas de larga duración como consecuencia del LPS. Se sabe que el tratamiento agudo con LPS resulta en una elevación de interleucinas, ciclooxigenasas (COX-2), prostaglandinas (PGE2), factor de necrosis tumoral (TNFγ), interferón gamma (INFγ)25-26 y NF-kB.27 Las interleucinas y la COX-2 pueden activar el eje HPA, lo cual parece sensibilizarlo a largo plazo, además de otras alteraciones neuroendocrinas permanentes. Por ejemplo, se ha observado que ratones hembra de 6 semanas de edad (puberales) inyectadas con LPS tienden a expresar menos receptividad sexual en la edad adulta. Esto no sucede si el LPS es inyectado durante las semanas 3, 7, 8 ó 10,32 lo cual indica que las alteraciones a largo plazo aparecen únicamente cuando el reto inmunológico y la respuesta intensa al estrés ocurren en el periodo sensible de desarrollo neuroendocrino, es decir durante la pubertad (5-6 semanas de edad). Otras alteraciones que se observan son un pobre efecto del estradiol para reducir las conductas tipo ansiedad o depresión.28,33-34
Previamente se reportó que la misma dosis de LPS (1.5 mg/kg) en el DPN 35 resultaba en displasia severa de la próstata en el DPN 112 (16 semanas de edad).24 En el presente trabajo se evaluó la próstata en el DPN 90 (semana 13), corroborando la presencia de lesiones, aunque aparentemente de menor intensidad (displasia leve). Esta evidencia sugiere que la aparición de lesiones es incipiente y van en aumento paulatino, explicando así porqué el estrés y la edad son factores de riesgo para la incidencia del CaP.
Las alteraciones neuroendocrinas ocasionadas por el estrés en periodos críticos de desarrollo pudieran interactuar con otros factores de riesgo conocidos, como por ejemplo, el sobrepeso y la obesidad.8,24 Esto es particularmente relevante considerando que en algunos países (i.e. EE.UU.) los índices de obesidad sobrepasan el 40% de la población,35 aunado a una alta percepción de estrés diario. De igual forma, el estrés pudiera adicionar complejidad a las alteraciones causadas por el tipo de alimento consumido (e.g. dietas altas en grasas de origen animal) lo que puede causar progresión más rápida de las lesiones prostáticas, así como una reducción de los antioxidantes naturales como el glutatión peroxidasa.7
Figura 5. Se muestra la expresión de los receptores en la próstata dorsolateral (PDL) y ventral (PV) para prolactina (PRL-R), Factor nuclear kB (NF-kB), leptina (OB-R) e interleucina (IL-6) y controles a través de Wester Blot.
4.1. Histología y cambios moleculares
Como se mencionó anteriormente el LPS prepuberal resultó en lesiones histopatológicas, un claro aumento en el tamaño alveolar y una menor expresión de receptores de prolactina (PRL-R 50 kD) en la porción ventral. El incremento del área alveolar pudiera ser consecuencia de un aumento de la producción de líquido prostático, aunque también pudiera obedecer a la presencia de más células de tipo mononuclear que subyacen un estado inflamatorio subclínico o más papilas representando cambios estructurales del epitelio. Se ha mostrado que el incremento de prolactina sérica se relaciona con un aumento en la expresión de PRL-R y alteraciones en el área alveolar y estructura epitelial.16 Vale la pena mencionar que el nivel de expresión de receptores representa un mecanismo celular de respuesta a un estímulo determinado. Por lo tanto, la regulación a la baja de los receptores PRL-R pudiera representar un mecanismo celular para limitar la magnitud y duración de señales de transducción celular. Por ser un receptor transmembranal, el PRL-R tiende a regularse a la baja por mecanismos de endocitosis generados por estimulación del mismo ligando (PRL), con lo cual la célula restringe la reacción a PRL.36 De hecho, un trabajo previo mostró que el tratamiento con LPS no altera los niveles séricos de prolactina,24 sugiriendo que la disminución de PRL-R pudiera ser un mecanismo compensatorio celular de la próstata para retardar los efectos generados por LPS en la pubertad. Además, indica que la vía de prolactina no es la única responsable en la generación de alteraciones prostáticas. El receptor PRL-R participa en la señalización de las tirosina cinasas JAK y MAPK.17 Se sabe que la regulación de la actividad de estas vías puede inhibir el desarrollo del cáncer a través de la facilitación de respuestas inmunes y que es la activación no regulada la que promueve el desarrollo del cáncer al activar genes de transcripción relacionados con la diferenciación y proliferación celular. Paradójicamente, la expresión de PRL-R puede también reducirse en casos de CaP altamente maligno, probablemente como consecuencia de la pobre diferenciación celular en casos avanzados.37
Nuestros resultados mostraron que el tratamiento con LPS no alteró la expresión de NFkB o IL-6. Esto fue contrario a lo esperado, pues el NFkB induce la expresión de varios genes proinflamatorios incluyendo aquellos que codifican la producción de IL-6, regulando con ello la supervivencia, activación y diferenciación de células del sistema inmune como los linfocitos T. Con esta evidencia descartamos la idea de que el LPS en la pubertad genere una predisposición de la próstata para activar IL-6 y otras moléculas proinflamatorias (e.g. TNF-α, IL-1β, IL-12p40 y ciclooxigenasa-2) lo cual facilitaría un proceso inflamatorio crónico (prostatitis).24,38
Nuestros resultados muestran que una inyección de LPS en el periodo prepuberal produce una displasia leve, incrementa el área alveolar y disminuye la expresión de receptores cortos de prolactina (PRL-R), pero no modifica la expresión del receptor para leptina, ni marcadores moleculares de inflamación como NFkB o IL-6. Tales cambios pudieran representar un proceso patológico y al mismo tiempo ser mecanismos compensatorios celulares para reducir el daño prostático.
Los autores declaran que no tiene conflictos de interés.
1. Boehm BJ, Colopy SA, Jerde TJ, Loftus CJ, Bushman W. Acute bacterial inflammation of the mouse prostate. Prostate 2012 72: 307-17.
2. Elkahwaji JE, Hauke RJ, Brawner CM. Chronic bacterial inflammation induces prostatic intraepithelial neoplasia in mouse prostate. Br J Cancer 2009 101: 1740-8.
3. King H, Diamond E, Lilieneld AM. Some epidemiological aspects of cancer of the prostate. J Chronic Dis 1963 16: 117-53.
4. Ferlay J, et al., Cancer incidence and mortality worldwide: IARC Cancer Base No. 11. 2013, GLOBOCAN: International Agency for Research on Cancer. Lyon, France.
5. Williams TH. Occult carcinoma and benign hypertrophy of the prostate in men over fifty years of age. Treat Serv Bull 1954 9: 201-16.
6. Allott EH, Howard LE, Song HJ, Sourbeer KN, Koontz BF, Salama JK, Freedland SJ. Racial differences in adipose tissue distribution and risk of aggressive prostate cancer among men undergoing radiation therapy. Cancer Epidemiol Biomarkers Prev 2014.
7. Chang SN, Han J, Abdelkader TS, Kim TH, Lee JM, Song J, Kim KS, Park JH, Park JH. High animal fat intake enhances prostate cancer progression and reduces glutathione peroxidase 3 expression in early stages of TRAMP mice. Prostate 2014 74: 1266-77.
8. Haque R, Van Den Eeden SK, Wallner LP, Richert-Boe K, Kallakury B, Wang R, Weinmann S. Association of body mass index and prostate cancer mortality. Obes Res Clin Pract 2014 8: e374-81.
9. Roman MD, Niclis C, Tumas N, Diaz Mdel P, Osella AR, Munoz SE. Tobacco smoking patterns and differential food effects on prostate and breast cancers among smokers and nonsmokers in Cordoba, Argentina. Eur J Cancer Prev 2014 23: 310-8.
10. Sartor O, Silberstein J. Prostate cancer: primary ADT monotherapy not suitable for localized disease. Nat Rev Urol 2014 11: 309-10.
11. Macedo IC, et al. Cafeteria diet-induced obesity plus chronic stress alter serum leptin levels. Peptides 2012 38: 189-96.
12. Colli S, Silveira Cavalcante F, Peixoto Martins M, Sampaio FJ, da Fonte Ramos C. Leptin role in the rat prostate ventral lobe. Fertil Steril 2011 95: 1490-3 e1.
13. Garofalo C, Surmacz E. Leptin and cancer. J Cell Physiol 2006 207: 12-22.
14. Herrera-Covarrubias D, Coria-Avila GA, Fernandez-Pomares C, Aranda-Abreu GE, Manzo Denes J, Hernandez ME. [Obesity as a risk factor in the development of cancer]. Rev Peru Med Exp Salud Publica 2015 32: 766-76.
15. Gala RR. The physiology and mechanisms of the stress-induced changes in prolactin secretion in the rat. Life Sci 1990 46: 1407-20.
16. Pascual-Mathey LI, Rojas-Duran F, Aranda-Abreu GE, Manzo J, Herrera-Covarrubias D, Munoz-Zavaleta DA, Garcia LI, Hernandez ME. Effect of hyperprolactinemia on PRL-receptor expression and activation of Stat and Mapk cell signaling in the prostate of long-term sexually-active rats. Physiol Behav 2016 157: 170-7.
17. Freeman M, Kanyicska B, Lerant A, Nagy G. Prolactin: Structure, Function, and Regulation of Secretion. Physiol Rev 2000 80: 1523-1631.
18. Ajuwon KM, Spurlock ME. Adiponectin inhibits LPS-induced NF-kappaB activation and IL-6 production and increases PPARgamma2 expression in adipocytes. Am J Physiol Regul Integr Comp Physiol 2005 288: R1220-5.
19. Kim F, Pham M, Luttrell I, Bannerman DD, Tupper J, Thaler J, Hawn TR, Raines EW, Schwartz MW. Toll-like receptor-4 mediates vascular inflammation and insulin resistance in diet-induced obesity. Circ Res 2007 100: 1589-96.
20. Maliner-Stratton MS, Klein RD, Udayakumar TS, Nagle RB, Bowden GT. Interleukin-1beta-induced promatrilysin expression is mediated by NFkappaB-regulated synthesis of interleukin-6 in the prostate carcinoma cell line, LNCaP. Neoplasia 2001 3: 509-20.
21. McCormick CM, Mathews IZ, Thomas C, Waters P. Investigations of HPA function and the enduring consequences of stressors in adolescence in animal models. Brain Cogn 2010 72: 73-85.
22. Romeo RD, Bellani R, Karatsoreos IN, Chhua N, Vernov M, Conrad CD, McEwen BS. Stress history and pubertal development interact to shape hypothalamic-pituitary-adrenal axis plasticity. Endocrinology 2006 147: 1664-74.
23. Freeman ME, Kanyicska B, Lerant A, Nagy G. Prolactin: structure, function, and regulation of secretion. Physiol Rev 2000 80: 1523-631.
24. Herrera-Covarrubias D, Coria-Avila GA, Aranda-Abreu GE, Manzo J, Hernandez ME. Prepuberal stress and obesity: effects on serum corticosterone, prolactin, testosterone and precancerous prostate lesions in adult rats. Exp Oncol 2019 41: 130-137.
25. 25. Hackett RA, Hamer M, Endrighi R, Brydon L, Steptoe A. Loneliness and stress-related inflammatory and neuroendocrine responses in older men and women. Psychoneuroendocrinology 2012 37: 1801-9.
26. Cai KC, van Mil S, Murray E, Mallet JF, Matar C, Ismail N. Age and sex differences in immune response following LPS treatment in mice. Brain Behav Immun 2016 58: 327-337.
27. Bierhaus A, et al. A mechanism converting psychosocial stress into mononuclear cell activation. Proc Natl Acad Sci U S A 2003 100: 1920.
28. Ismail N, Kumlin AM, Blaustein JD. A pubertal immune challenge alters the antidepressant-like effects of chronic estradiol treatment in inbred and outbred adult female mice. Neuroscience 2013 249: 43-52.
29. Goldman A, Harper S, Speicher D. Detection of Proteins on Blot Membranes. Curr. Protoc. Protein Sci. 2016 86.
30. Kumar V, Abbas AK, Fausto N, Aster JC. Patología estructural y funcional. Elsevier. Barcelona España. 2010.
31. Herrera-Covarrubias D, Coria-Avila G, Hernandez ME, Ismail N. Stress during puberty facilitates precancerous prostate lesions in adult rats. Exp Oncol 2017 39: 269-275.
32. Laroche J, Gasbarro L, Herman JP, Blaustein JD. Enduring influences of peripubertal/adolescent stressors on behavioral response to estradiol and progesterone in adult female mice. Endocrinology 2009 150: 3717-25.
33. Olesen KM, Ismail N, Merchasin ED, Blaustein JD. Long-term alteration of anxiolytic effects of ovarian hormones in female mice by a peripubertal immune challenge. Horm Behav 2011 60: 318-26.
34. Ismail N, Blaustein JD. Pubertal immune challenge blocks the ability of estradiol to enhance performance on cognitive tasks in adult female mice. Psychoneuroendocrinology 2013 38: 1170-7.
35. Hales CM, Carroll MD, Fryar CD, Ogden CL, Prevalence of Obesity and Severe Obesity Among Adults: United States, 2017–2018, in NCHS Data Brief. 2020, National Center For Health Statistics: Hyattsville, MD. p. 1-8.
36. Varghese BJ, Mechanisms of the downregulation of prolactin receptor and their role in cell proliferation, in Biology. 2010, University of Pennsilvanya.
37. Leav I, Merk FB, Lee KF, Loda M, Mandoki M, McNeal JE, Ho SM. Prolactin receptor expression in the developing human prostate and in hyperplastic, dysplastic, and neoplastic lesions. Am J Pathol 1999 154: 863-70.
38. Liu T, Zhang L, Joo D, Sun S. NF-κB signaling in inflammation. Signal Transduct Target Ther 2017 2: 17023.
| Recibido: 28 de enero, 2021 | Aceptado: 16 de febrero, 2021 |
*Corresponding Author at: Dra. Deissy Herrera-Covarrubias. Instituto de Investigaciones Cerebrales. Avenida Luis Castelazo Ayala s/n. Colonia Industrial Las Animas, Xalapa, Ver. C.P. 91190. Teléfono: (228) 8418900 Ext. 13065. E-mail: dherrera@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creamasal@unam.mxtivecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.