Neurofisiología de la hipersexualidad secundaria al tratamiento de enfermedad de Parkinson
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Deissy Herrera-Covarrubias1, Nafissa Ismail1, Genaro A. Coria-Avila2
1School of Psychology, University of Ottawa, Ontario Canada.2Centro de Investigaciones Cerebrales, Universidad Veracruzana, México.
Resumen/Abstract
Introducción
Metodología
Conclusión
Agradecimientos
Referencias
Correspondencia
La hipersexualidad puede ser un síntoma secundario al tratamiento de la enfermedad de Parkinson (EP) y forma parte de algunos desórdenes en el control de impulsos en una proporción que va del 20-50% de los pacientes. En esta revisión analizamos las evidencias neurobiológicas que explican el incremento de la hipersexualidad durante el tratamiento con L-DOPA o agonistas dopaminergicos. Se llevó a cabo una búsqueda de información con los términos “Parkinson”, “Hypersexuality”, “Dopamine”, “Noradrenaline”, “L-DOPA”, “Brain”, “Impulse Control Disorders”, “Neurobiology”, buscadas en las bases de datos de PubMed, sciELO y Science Direct. La EP se caracteriza por la pérdida progresiva de neuronas dopaminérgicas de la parte compacta de la sustancia nigra y que proyectan al estriado, produciendo un desbalance en la capacidad motora. Al igual que hace 50 años el tratamiento actual para la EP redunda en el uso de agentes que eleven la disponibilidad de dopamina y otras aminas como la noradrenalina. El tratamiento con L-DOPA o agonistas específicos incrementa los niveles de actividad de dichas aminas incluso en estructuras cerebrales no claramente afectadas por la EP, como las proyecciones tubero-infundibulares y mesolímbicas. El incremento de actividad dopaminérgica en áreas específicas como el núcleo accumbens y el área preóptica/hipotálamo anterior puede explicar la hipersexualidad observada con el incremento súbito en los niveles de motivación y excitación sexual en pacientes tratados para la EP.
Palabras clave: Hipersexualidad, Parkinson, Dopamina, Noradrenalina, Accumbens, Área preóptica.
Hypersexuality may be a symptom secondary to the treatment of Parkinson Disease (PD) and it is part of the disturbances of impulse control reported, ranging from 20-50% of the patients under PD treatment. Herein we review the neurobiological evidence behind the hypersexuality observed during treatment with L-DOPA or dopaminergic agonists. A search was performed with the terms “Parkinson”, “Hypersexuality”, “Dopamine”, “Noradrenaline”, “L-DOPA”, “Brain”, “Impulse Control Disorders”, “Neurobiology”, in the scientific data bases PubMed, sciELO and Science Direct. PD is characterized by a progressive loss of dopaminergic neurons in the compact part of the substantia nigra projecting to the striatum, which disrupts the motor ability. Like 50 years ago the current treatment for PD includes the use of drugs that increase the availability of dopamine and other amines such as noradrenaline. Systemic treatment with L-DOPA or specific agonists increase the activity of these amines even in brain structures not clearly affected by the PD, such as the tubero-infundibular and mesolimbic projections. The increase in dopaminergic activity inspecific areas such as the nucleus accumbens and in the medial preoptic/anterior hypothalamus may explain the hypersexuality that is observed by sudden increase in the levels of sexual motivation and arousal in patients treated for PD.
Key words: Hypersexuality, Parkinson, Dopamine, Noradrenaline, Accumbens, Preoptic area.
La enfermedad de Parkinson (EP) es un problema de salud pública a nivel mundial. Su incidencia anual es de 19 nuevos casos por cada 100,000 habitantes, con una prevalencia de hasta 328 por cada 100,000.1 Fue descrita por primera vez en 1817 por el médico inglés James Parkinson.2 En su trabajo titulado “An Assay On The Shaking Palsy” (Un Ensayo Sobre la Parálisis Agitante) describió múltiples casos clínicos que involucraban pacientes con movimientos involuntarios de carácter tembloroso, con disminución de la fuerza muscular en partes del cuerpo en reposo y una tendencia a la inclinación del cuerpo hacia adelante, lo cual producía una forma de caminar a pasos cortos y rápidos. Actualmente, la Organización Mundial de la Salud (OMS) considera a la EP como un desorden neurodegenerativo motor que inicia en la mayoría de los pacientes de manera insidiosa.1 Por tal razón, la OMS reconoce que en la EP también existen síntomas no motores que pueden aparecer incluso antes de los síntomas motores clásicos. Por ejemplo, la hiposmia, alteraciones del sueño, parestesias, depresión, desórdenes urológicos, hipotensión ortostática y alteraciones neuropsiquiátricas como la demencia, las alucinaciones y cambios en la personalidad.
Con la evidencia en los años 50´s de que en el cerebro había catecolaminas como la dopamina,3 diversos estudios en Austria y Canadá demostraron en los años 60´s que estas tenían un metabolismo anormal en la EP.4-7 A partir de entonces múltiples estudios mostraron que los síntomas motores y no motores son consecuencia de la disminución de la disponibilidad de algunas aminas en el cerebro, principalmente por la pérdida progresiva de neuronas dopaminérgicas de la parte compacta de la sustancia nigra y que proyectan al estriado. Con ello se produce un desbalance en las conexiones estriado-pálido y pálido-tálamo, las cuales modulan principalmente la función motora.1 El bajo contenido de dopamina en los ganglios basales y en la orina de pacientes con EP contribuyó lógicamente a utilizar el precursor L-DOPA como un tratamiento prometedor. Entre 1961 y 1966 se utilizaron dosis bajas por vía oral e intravenosa con lo que se logró ver algunos efectos positivos, pero leves, en la acinesia y rigidez. Posteriormente, con el uso de dosis más altas de L-DOPA se comprobó que el uso de agentes dopaminérgicos contribuyen a la mejoría de los síntomas de la enfermedad.4 Sin embargo, con la elevación de la disponibilidad de aminas biogénicas también aparecen algunos efectos secundarios inesperados que pocos pacientes reportan a su médico, tales como la hipersexualidad.
En esta revisión se analizan las evidencias neurobiológicas que explican los posibles mecanismos de la hipersexualidad secundaria al tratamiento de la EP, específicamente como consecuencia de la elevación en los niveles de dopamina y noradrenalina cerebral. La revisión bibliográfica se basó en artículos originales y/o revisiones referentes o vinculadas a la enfermedad de Parkinson, hipersexualidad y neurobiología. Se hicieron búsquedas en las bases de datos de PubMed, sciELO y Science Direct utilizando las palabras clave: Parkinson, Hypersexuality, Dopamine, Noradrenaline, L-DOPA, Brain, Impulse Control Disorders and Neurobiology. Se obtuvieron 61 referencias bibliográficas desde 1817 hasta 2015 en español e inglés, en las que se incluyen ensayos, artículos originales, revisiones y bases de datos en internet.
3. Tratamiento clásico de la enfermedad de Parkinson
Al igual que hace 50 años el tratamiento actual para la EP redunda en el uso de agentes que eleven la disponibilidad de dopamina y otras aminas en el cerebro. Los medicamentos de inicio pueden incluir el precursor L-DOPA8 (Figura 1), o los agonistas de los receptores D2, D3, y D4 como el pramipexol o ropinirol.8 En algunos casos el tratamiento se acompaña con inhibidores de la monoaminooxidasa tipo B (IMAO-B), tales como la selegilina o la rasagilina.9 Estos últimos disminuyen el catabolismo de la dopamina y otras aminas en el cerebro, lo cual hace que mayores niveles del neurotransmisor estén disponibles en las sinapsis. Así mismo, se ha reportado el uso de anticolinérgicos y amantadina en pacientes con temblor severo. El primero para reducir el exceso de transmisión colinérgica a nivel del cuerpo estriado, y el segundo presuntamente para aumentar la disponibilidad de aminas biogénicas.
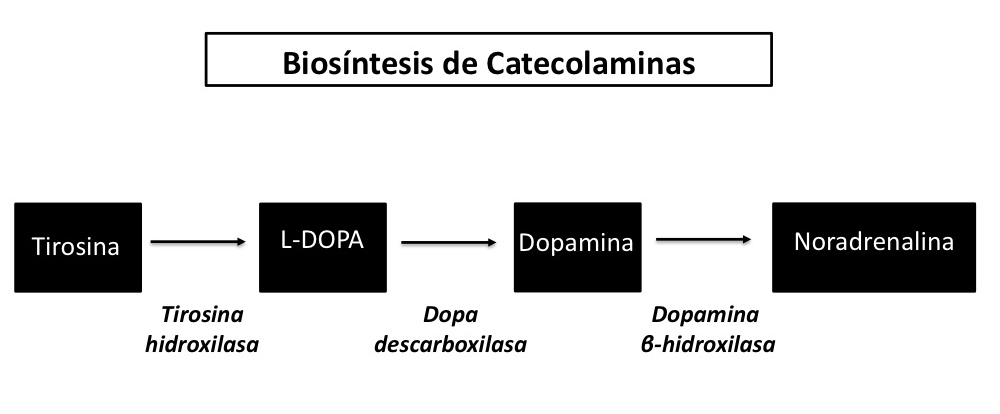
Figura 1.En condiciones normales el aminoácido L-tirosina se hidroxila para formar el precursor L-DOPA, que a su vez es convertida a dopamina por la L-DOPA descarboxilasa. La dopamina es transformada a noradrenalina por la dopamina b-hidroxilasa. De este modo el uso del precursor L-DOPA incrementa la disponibilidad de dopamina y noradrenalina en el cerebro de los pacientes con EP (Hadjiconstantinou et al., 2008 10).
4. Trastornos del control de impulsos e hipersexualidad
Cada vez se describe con mayor frecuencia que la EP puede acompañarse de desórdenes en el control de impulsos (DCI). Los DCI pueden aparecer con el uso de fármacos que funcionan como agonistas dopaminérgicos como el pramipexol y el ropinirol, o también con el uso de IMAO-B como la resagilina, la cual incrementa la disponibilidad cerebral de otras aminas como la noradrenalina.11 El incremento en estas aminas puede alterar la asociación y atención a estímulos y resultar en una falsa capacidad de predicción de recompensa.12,13 Esto incluye conductas compulsivas como las apuestas exageradas e incontroladas en juegos de azar. También puede haber incremento de la libido, masturbación excesiva, búsqueda de pornografía, o distintas parafilias.11 Comúnmente estos problemas no son diagnosticados en la clínica, probablemente porque parecieran un problema menor en los pacientes que han sufrido la parálisis agitante, o quizá porque reportar tales efectos es embarazoso para el paciente.
Vázquez-Sánchez y colaboradores,14 reportaron que los síntomas de hipersexualidad pueden afectar hasta el 22% de los pacientes tratados con medicamentos para EP. Sin embargo, otros autores han sugerido que la hipersexualidad pudiera observarse en el 50% de los casos (i.e. varones jóvenes con EP bajo tratamiento),15 aunque suele ser temporal y es dependiente de la dosis del fármaco. Un caso conocido de hipersexualidad secundaria al tratamiento de EP fue el del Francés Didier Jambart en 2003,16 quien demandó a la empresa farmacéutica GlaxoSmithKline argumentando que sufrió un cambio en su conducta sexual como consecuencia del consumo de Requip™ (un medicamento antiparkinson a base de ropinirol). De acuerdo al reporte, Jambart era un respetable hombre de familia a quien el Requip convirtió en un adicto a las apuestas y al sexo homosexual. La corte Francesa dictó a favor del paciente, quien ganó el juicio y una compensanción por 197,000 Euros.
5. Neurofisiología de la excitación sexual
Casos como el de Didier Jambart hacen pensar en los posibles mecanismos involucrados en la hipersexualidad secundaria a la EP. Se sabe bien que la capacidad fisiológica de experimentar excitación sexual depende de la funcionalidad de las gónadas. Sin embargo, poco se sabe sobre el papel modulador que producen las hormonas esteroides en la síntesis de enzimas y receptores para algunas aminas biogénicas en el cerebro, como la dopamina y la noradrenalina. Estos neuromoduladores (y otros como la oxitocina y las melanocortinas) actúan principalmente en el hipotálamo, pero también en regiones extrahipotalámicas para producir excitación, atención, y conductas sexuales dirigidas.17,18 A continuación se describen en detalle los efectos de dopamina y noradrenalina en la conducta sexual.
5.1. Dopamina
Es sin duda el principal neuromodulador involucrado en la excitación sexual.19 La dopamina y sus receptores se encuentran en el cerebro en regiones olfativas,20,21 mesolímbicas, nigro-estriatales e hipotalámicas.22 Los somas de las neuronas dopaminérgicas del sistema mesolímbico se originan en el área tegmental ventral (ATV) del mesencéfalo,23 cuyas eferencias llegan a diferentes estructuras del sistema límbico y corticales,24 incluyendo núcleos de la amígdala,25 el núcleo accumbens (NAc), el tubérculo olfatorio, la corteza piriforme, el septum lateral26 y el cíngulo anterior.24
Algunas proyecciones llegan a la corteza prefrontal medial (CPFm), la cual participa en el control ejecutivo de la conducta o en su inhibición.27 Los somas dopaminérgicos del sistema nigro-estriatal están en la sustancia nigra del mesencéfalo y tiene eferencias hacia el estriado dorsal. Los somas hipotalámicos dopaminérgicos se originan de la zona incerta y proyectan al área preóptica media (APOm)28 (Figura 2). Existe amplia evidencia que indica que las alteraciones en la funcionalidad de la dopamina en cualquiera de estas regiones afectan la motivación y la conducta sexual. Por ejemplo, las lesiones experimentales de vías dopaminérgicas en el APOm disminuyen la motivación sexual en ratas de ambos sexos.29,30 Lo mismo ocurre con lesiones en el NAc, en cuyo caso los animales dejan de responder a los incentivos sexuales que normalmente les motivarían.31,32 Por el contrario, el aumento en la actividad dopaminérgica con el tratamiento con L-DOPA incrementa la libido en ratas, estimulando los comportamientos sexuales apetitivos y copulatorios incluso en machos gonadectomizados.22,33 Así mismo, las ratas macho catalogadas como “sexualmente flojos” incrementan su libido a niveles normales con el tratamiento de L-DOPA,34,35 lo cual también ocurre en humanos.36 Otro agonista dopaminérgico como la apomorfina incrementa las erecciones en ratas sanas37 y en humanos con disfunción eréctil37,38 y los efectos sobre la libido y las erecciones se bloquean con los antagonistas dopaminérgicos.
De manera general algunos antagonistas dopaminérgicos se usan clínicamente como antipsicóticos, los cuales tienen el efecto secundario de inhibir las conductas sexuales apetitivas.39,40
El efecto que tienen las hormonas gonadales sobre la excitación sexual es explicado por su efecto sobre la actividad de los sistemas dopaminérgicos cerebrales. Por ejemplo, la presencia de estradiol facilita la liberación de dopamina en el cerebro y la testosterona aumenta la síntesis de óxido nítrico que a su vez controla la liberación de dopamina.41,42 El aumento en los niveles de estrógenos durante la fase ovulatoria del ciclo estral en las hembras también produce un incremento en la actividad dopaminérgica mesolímbica, lo cual se asocia a más atención y respuesta a estímulos que tienen un valor sexual. Las ratas hembra tratadas con estrógenos y progesterona expresan altos niveles de conductas proceptivas y receptivas. Esto no ocurre si se tratan únicamente con estrógenos, a menos que se acompañe de una dosis sistémica moderada de agonistas dopaminérgicos.19 Lo mismo ocurre con la inyección de agonistas dopaminérgicos en regiones específicas del sistema mesolímbico. Por ejemplo, cuando la región basolateral de la amígdala se lesiona experimentalmente en ratas macho, estas pierden la motivación sexual. Sin embargo, la inyección de un agente dopaminérgico como la anfetamina en el NAc hace que la recuperen inmediatamente.43 Se ha discutido que la dopamina mesolímbica es crítica para la expresión de la conducta y su motivación, y sugiere que las proyecciones glutamatérgicas de la amígdala al NAc modulan la liberación de dopamina en NAc.19
Se ha observado en ratas que durante las fases apetitivas y copulatorias del sexo los niveles de dopamina incrementan en el APOm, NAc y estriado en machos y hembras. Cuando un macho eyacula se observa una disminución abrupta en su motivación sexual por la hembra, lo cual se correlaciona con un decremento en los niveles de dopamina en el APOm y NAc, aunque no en el estriado dorsal.44 Cuando los machos han pasado por un tiempo suficiente post-eyaculatorio comienzan a mostrar interés en la hembra receptiva, lo cual se correlaciona también con un incremento de los niveles dopaminérgicos en esas estructuras.45 Lo mismo vuelve a ocurrir con cada eyaculación. Si el macho alcanza la saciedad sexual por múltiples eyaculaciones entonces sus niveles de dopamina en el NAc son tan bajos como en los niveles precopulatorios.46 Un macho saciado sexualmente dejará de interesarse por la hembra con la cual acaba de copular. Sin embargo, la presencia de una hembra nueva es suficiente para elevar los niveles de dopamina en el NAc y reiniciar la cópula, fenómeno denominado el efecto Coolidge.46
Los agonistas dopaminérgicos no solo actúan sobre la motivación sexual, sino que también pueden ejercer efectos sobre los neurocircuitos responsables de la formación de vínculos sociales afectivos. Algunos estudios han mostrado que el incremento en la actividad de los receptores dopaminérgicos de tipo D2 facilita el desarrollo de los vínculos afectivos heterosexuales en roedores, aun en ausencia de apareamiento.47-49 Otros estudios recientes han mostrado que el incremento en la actividad de los receptores D2 facilita el condicionamiento de preferencias de tipo homosexual en las ratas macho.50-52 En dichos estudios, ratas macho fueron tratados con quinpirole (agonista de receptores D2) y fueron puestos a cohabitar con otro macho durante 24 hrs, a intervalos de 4 días por un total de 3 condicionamientos. Cuatro días después del último condicionamiento se llevó a cabo una prueba de preferencia de pareja sin tratamiento farmacológico alguno. Los machos tenían que elegir entre una hembra receptiva y el macho compañero con el que cohabitaron bajo los efectos del agonista D2. Los resultados mostraron que los machos tratados con quinpirole pasaban más tiempo con el macho (70% del tiempo), ejecutaban y recibían más montas con él, y tenían más erecciones psicogénicas frente al macho. Esto no ocurría con los machos del grupo control, los cuales prefirieron todo el tiempo a la hembra receptiva.50,51 Estos hallazgos sugieren efectos de los agonistas dopaminérgicos que previamente no han sido considerados. Es decir, que cuando el cerebro tiene mayor disponibilidad de dopamina se modifica su capacidad de formar asociaciones y aprendizaje de las preferencias de pareja sexual, facilitando incluso el aprendizaje de preferencias hacia el mismo sexo. Esto ocurre mucho antes de que se logren observar conductas de tipo compulsivo.
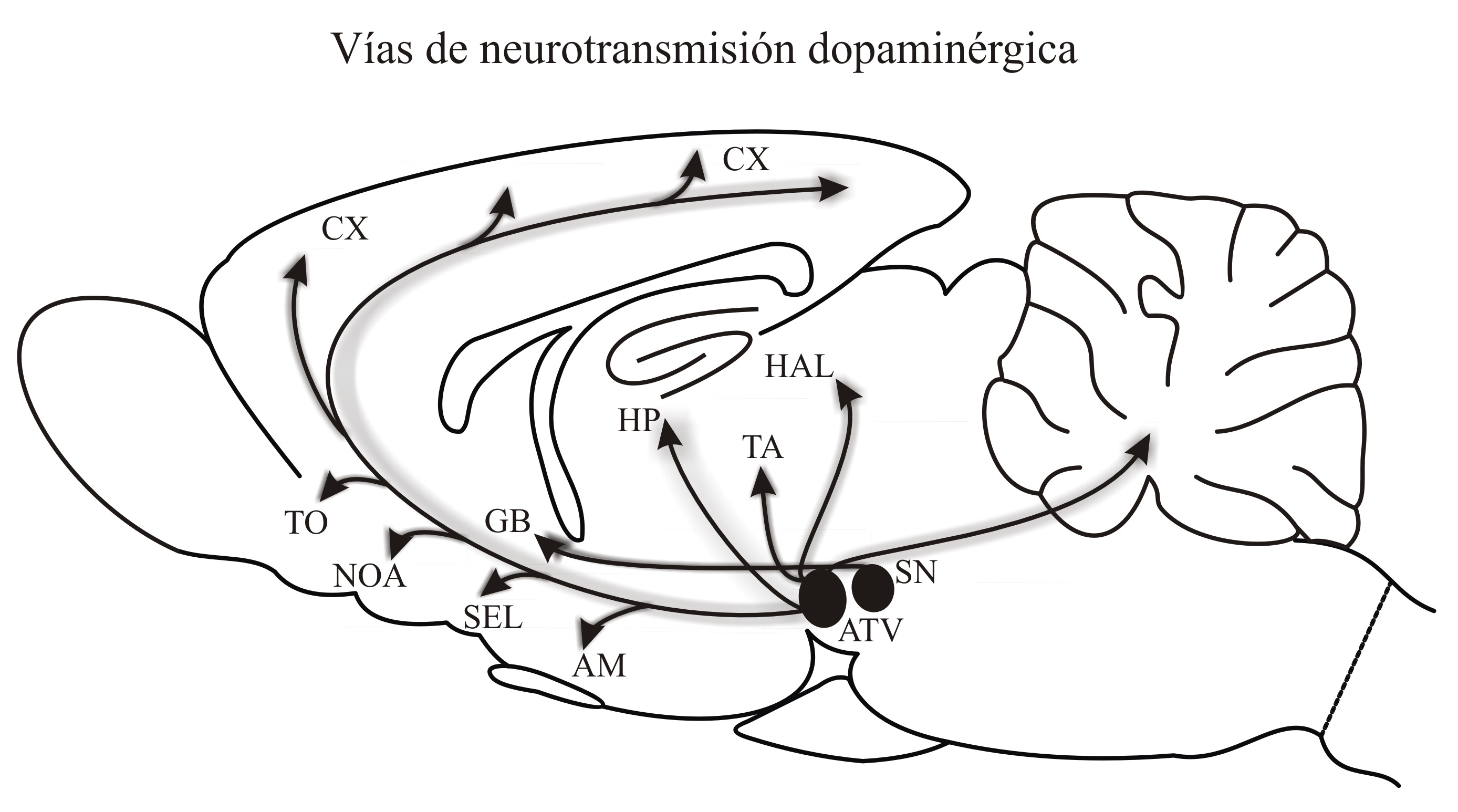
Figura 2. Ilustración de un corte sagital del encéfalo de una rata que muestra el origen y la localización de los principales grupos de neuronas dopaminérgicas: ATV= área tegmental ventral, SN= sustancia nigra (óvalos en negro), así como de los núcleos donde proyectan sus axones: CX= corteza cerebral, TO= tubérculo olfatorio, NOA= núcleo olfatorio anterior, GB= ganglios basales, SEL= septum lateral, AM= amígdala, HP= hipocampo, TA= tálamo, HAL= habénula lateral. Tomado con autorización.53
5.2. Noradrenalina
Las neuronas que dan origen al sistema noradrenérgico se originan en núcleos localizados entre el mesencéfalo y el tallo cerebral. Estas neuronas proyectan eferencias al hipotálamo, al sistema límbico y la corteza cerebral54 (Figura 3). La noradrenalina también es una amina importante en el tratamiento de la EP y su aumento puede tener efectos en la conducta sexual y en su motivación. Tales efectos siguen una curva en forma de U invertida. Esto quiere decir que un incremento leve en los niveles de noradrenalina facilitan la motivación sexual, pero incrementos fuertes pueden resultar en terror y conductas de pánico55 (e.g. los individuos se paralizan y/o huyen). La noradrenalina tiene receptores tipo a> y b. La actividad de los a2 (de tipo presináptico) reduce la liberación de noradrenalina. Drogas como la clonidina actúan a este nivel con lo que se produce menos tono simpático y la sedación correspondiente. Tratamientos con un agonista a2 disminuyen la proporción de ratas que responden sexualmente.56 Drogas como la yumbina (yohimbine en inglés) actúan como antagonistas a nivel de los receptores a2 y su uso resulta en un tono noradrenérgico incrementado,57 con lo cual se facilita la excitación sexual. Los antagonistas a2 estimulan las erecciones espontáneas en ratas y humanos58 e incluso revierten la inhibición sexual de machos saciados.57 Los receptores tipo b también participan facilitando la excitación y eyaculación. Por ejemplo, se ha observado que antagonistas b-adrenérgicos como el propranolol y el pindolol (normalmente usados como antihipertensivos) inhiben la conducta de eyaculación en ratas macho y afectan la conducta sexual en humanos.59 En las hembras, el incremento de estradiol durante el ciclo estral también produce un aumento en la síntesis de noradrenalina en el cerebro60 con lo cual se logra un tono simpático mayor que facilita la conducta sexual. Por ejemplo, cuando la noradrenalina se aumenta de manera experimental en el hipotálamo de ratas hembra estas muestran lordosis más intensas.17,61 En base a lo anterior, es probable que un tono noradrenérgico aumentado con el uso de IMAO-B en pacientes con EP pudiera ser causante del aumento en la excitación sexual.
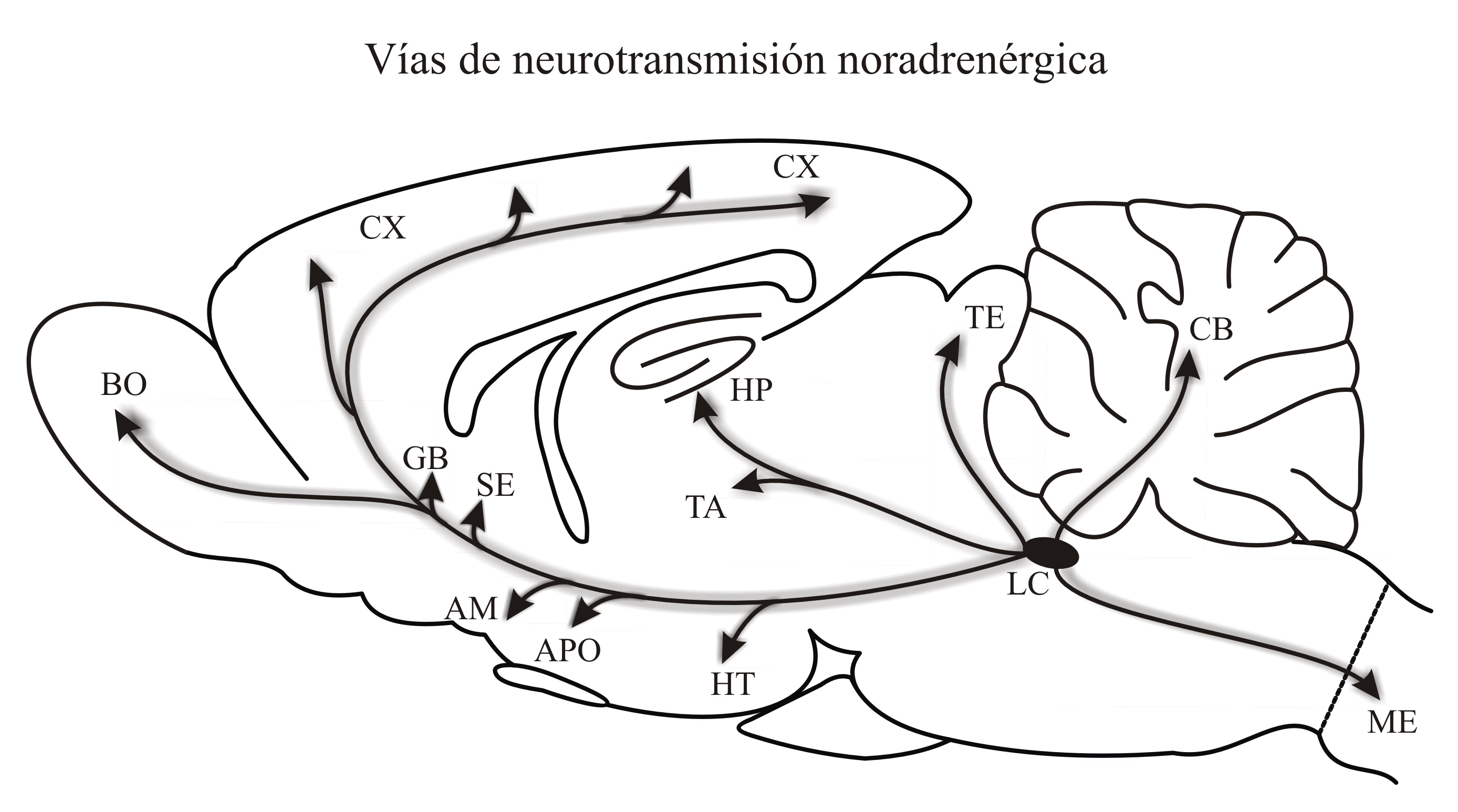
Figura 3. Ilustración de un corte sagital medial del encéfalo de una rata que muestra el origen y la localización de las principales neuronas noradrenérgicas: LC= locus coeruleus (óvalo en negro); así como los núcleos de proyección de sus axones. BO= bulbo olfatorio, CX= corteza cerebral, GB= ganglios basales, SE= septum, AM= amígdala, APO= área preóptica, HP= hipocampo, TA= tálamo, HT= hipotálamo, TE= téctum, CB= cerebelo, ME= médula espinal. Tomado con autorización.53
Los tratamientos actuales contra la EP enfocados a elevar los niveles de dopamina y noradrenalina ejercen su efecto no solo en los núcleos cerebrales afectados por la EP, sino también en aquellos que regulan el comportamiento sexual donde existan descarboxilasas y conviertan la L-DOPA en dopamina, o donde haya receptores donde actúen los agonistas dopaminergicos empleados en el tratamiento de la EP. Esto implica que el tratamiento conlleva de manera secundaria a expresar niveles suprafisiológicos de ciertas aminas en áreas cerebrales involucradas en la motivación y excitación sexual. Si bien el tratamiento clásico ha funcionado bien para los síntomas motores de la EP, aún queda por resolver muchos de los síntomas no motores; los cuales en algunos casos, son la primera y última causa de consulta médica.
Este trabajo de revisión se realizó mientras se contaba con un apoyo para investigación de Ciencia Básica SEP-CONACYT de México a (GACA-167773) y una beca postdoctoral (DHC 250561).
8. Conflicto de intereses
Los autores de éste artículo declaran no tener ningún conflicto de intereses.
- WHO. Neurological disorders Public health challenges. 2006 [cited 2015 01/05/2015]; Available from: http://www.who.int/mental_health/neurology/neurological_disorders_report_web.pdf?ua=1
- Parkinson J. An essay on the shaking palsy. Whittingham & Rowland for Sherwood, Neely and Jones. London. 1817 88.
- Carlsson A, Lindqvist M, Magnusson T, Waldeck B. On the presence of 3-hydroxytyramine in brain. Science 1958 127: 471.
- Barbeau A. L-dopa therapy in Parkinson's disease: a critical review of nine years' experience. Can Med Assoc J 1969 101: 59-68.
- Ehringer H, Hornykiewicz O. [Distribution of noradrenaline and dopamine (3-hydroxytyramine) in the human brain and their behavior in diseases of the extrapyramidal system]. Klin Wochenschr 1960 38: 1236-9.
- Barbeau A. Preliminary observations on abnormal catecholamine metabolism in basal ganglia diseases. Neurology 1960 10: 446-51.
- Barbeau A, Murphy GF, Sourkes TL. Excretion of dopamine in diseases of basal ganglia. Science 1961 133: 1706-7.
- Miyasaki JM, Martin W, Suchowersky O, Weiner WJ, Lang AE. Practice parameter: initiation of treatment for Parkinson's disease: an evidence-based review: report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2002 58: 11-7.
- Ives NJ, Stowe RL, Marro J, Counsell C, Macleod A, Clarke CE, Gray R, Wheatley K. Monoamine oxidase type B inhibitors in early Parkinson's disease: meta-analysis of 17 randomised trials involving 3525 patients. BMJ 2004 329: 593.
- Hadjiconstantinou M, Neff NH. Enhancing aromatic L-amino acid decarboxylase activity: implications for L-DOPA treatment in Parkinson's disease. CNS Neurosci Ther 2008 14: 340-51.
- Reyes D, Kurako K, Galvez-Jimenez N. Rasagiline induced hypersexuality in Parkinson's disease. J Clin Neurosci 2014 21: 507-8.
- Berridge KC, Robinson TE. What is the role of dopamine in reward: hedonic impact, reward learning, or incentive salience? Brain Res Brain Res Rev 1998 28: 309-69.
- Schultz W. Predictive reward signal of dopamine neurons. J Neurophysiol 1998 80: 1-27.
- Vazquez-Saanchez F, Rodriguez-Martinez E, Ares-Luque A. [Urinary disorders, sexual dysfunction and hypersexuality in Parkinson's disease]. Rev Neurol 2010 50 Suppl 2: S27-31.
- Chunghtai B, Sciullo D, Hhan S, Rehman H, Mohan E, Rehman J. Etiology, diagnosis and management of hypersexuality: a review. The Internet Journal of Urology 2009 6.
- Hsu C. Parkinson's Medication Turned Respected Family Man into "Gay Sex and Gambling Addict". 2012 [cited 2015 28/04/2015]; Available from: http://www.medicaldaily.com/parkinsons-medication-turned-respected-family-man-gay-sex-and-gambling-addict-243707.
- Kow LM, Pfaff DW. Transmitter and peptide actions on hypothalamic neurons in vitro: implications for lordosis. Brain Res Bull 1988 20: 857-61.
- Pfaff DW. Drive: Neurobiological and molecular mechanisms of sexual motivation. MIT press. 1999.
- Pfaus JG. Pathways of sexual desire. J Sex Med 2009 6: 1506-33.
- Berkowicz DA, Trombley PQ. Dopaminergic modulation at the olfactory nerve synapse. Brain Res 2000 855: 90-9.
- Brunig I, Sommer M, Hatt H, Bormann J. Dopamine receptor subtypes modulate olfactory bulb gamma-aminobutyric acid type A receptors. Proc Natl Acad Sci USA 1999 96: 2456-60.
- Hull EM, Lorrain DS, Du J, Matuszewich L, Lumley LA, Putnam SK, Moses J. Hormone-neurotransmitter interactions in the control of sexual behavior. Behav Brain Res 1999 105: 105-16.
- Fluxe K, Hokfelt T, Johansson O, Jonsson G, Lidbrink P, Ljungdahl A. The origin of the dopamine nerve terminals in limbic and frontal cortex. Evidence for meso-cortico dopamine neurons. Brain Res 1974 82: 349-55.
- Lindvall O, Bjorklund A, Moore RY, Stenevi U. Mesencephalic dopamine neurons projecting to neocortex. Brain Res 1974 81: 325-31.
- Yim CY, Mogenson GJ. Response of nucleus accumbens neurons to amygdala stimulation and its modification by dopamine. Brain Res 1982 239: 401-15.
- Lindvall O. Mesencephalic dopaminergic afferents to the lateral septal nucleus of the rat. Brain Res 1975 87: 89-95.
- Roth RH, Elsworth JD. Biochemical pharmacology of midbrain dopamine neurons. En: Bloom FE and DJ Kupfer, Psychopharmacology: The fourth generation of progress. Raven 1995 227-244.
- Moore KE, Looklingand KJ. Dopaminergic neuronal systems in the hypothalamus. En: Bloom FE and DJ Kupfer, Psychopharmacology: The fourth generation of progress. Raven 1995 245-256.
- Hoshina Y, Takeo T, Nakano K, Sato T, Sakuma Y. Axon-sparing lesion of the preoptic area enhances receptivity and diminishes proceptivity among components of female rat sexual behavior. Behav Brain Res 1994 61: 197-204.
- Paredes RG. Medial preoptic area/anterior hypothalamus and sexual motivation. Scand J Psychol 2003 44: 203-12.
- Liu YC, Sachs BD, Salamone JD. Sexual behavior in male rats after radiofrequency or dopamine-depleting lesions in nucleus accumbens. Pharmacol Biochem Behav 1998 60: 585-92.
- Guarraci FA, Megroz AB, Clark AS. Effects of ibotenic acid lesions of the nucleus accumbens on paced mating behavior in the female rat. Behav Neurosci 2002 116: 568-76.
- Hull EM, Du J, Lorrain DS, Matuszewich L. Testosterone, preoptic dopamine, and copulation in male rats. Brain Res Bull 1997 44: 327-33.
- Malmnas CO. Dopaminergic reversal of the decline after castration of rat copulatory behaviour. J Endocrinol 1977 73: 187-8.
- Malmnas CO. The significance of dopamine, versus other catecholamines, for L-dopa induced facilitation of sexual behavior in the castrated male rat. Pharmacol Biochem Behav 1976 4: 521-6.
- Hyyppa M, Rinne UK, Sonninen V. The activating effect of L-dopa treatment on sexual functions and its experimental background. Acta Neurol Scand 1970 46: Suppl 43:223+.
- Heaton JP, Varrin SJ, Morales A. The characterization of a bio-assay of erectile function in a rat model. J Urol 1991 145: 1099-102.
- Lal S, Ackman D, Thavundayil JX, Kiely ME, Etienne P. Effect of apomorphine, a dopamine receptor agonist, on penile tumescence in normal subjects. Prog Neuropsychopharmacol Biol Psychiatry 1984 8: 695-9.
- McIntosh TK, Barfield RJ. Brain monoaminergic control of male reproductive behavior. II. Dopamine and the post-ejaculatory refractory period. Behav Brain Res 1984 12: 267-73.
- Pfaus JG, Phillips AG. Role of dopamine in anticipatory and consummatory aspects of sexual behavior in the male rat. Behav Neurosci 1991 105: 727-43.
- Becker JB. Direct effect of 17 beta-estradiol on striatum: sex differences in dopamine release. Synapse 1990 5: 157-64.
- Sato S, Braham CS, Putnam SK, Hull EM. Neuronal nitric oxide synthase and gonadal steroid interaction in the MPOA of male rats: co-localization and testosterone-induced restoration of copulation and nNOS-immunoreactivity. Brain Res 2005 1043: 205-13.
- Everitt BJ, Cador M, Robbins TW. Interactions between the amygdala and ventral striatum in stimulus-reward associations: studies using a second-order schedule of sexual reinforcement. Neuroscience 1989 30: 63-75.
- Blackburn JR, Pfaus JG, Phillips AG. Dopamine functions in appetitive and defensive behaviours. Prog Neurobiol 1992 39: 247-79.
- Meisel RL, Sachs BD. The physiology of male reproduction. En: Knobil E and JD Neil, The physiology of reproduction. Raven Press 1994 3-105.
- Fiorino DF, Coury A, Phillips AG. Dynamic changes in nucleus accumbens dopamine efflux during the Coolidge effect in male rats. J Neurosci 1997 17: 4849-55.
- Aragona BJ, Liu Y, Curtis JT, Stephan FK, Wang Z. A critical role for nucleus accumbens dopamine in partner-preference formation in male prairie voles. J Neurosci 2003 23: 3483-90.
- Gingrich B, Liu Y, Cascio C, Wang Z, Insel TR. Dopamine D2 receptors in the nucleus accumbens are important for social attachment in female prairie voles (Microtus ochrogaster). Behav Neurosci 2000 114: 173-83.
- Williams JR, Catania KC, Carter CS. Development of partner preferences in female prairie voles (Microtus ochrogaster): the role of social and sexual experience. Horm Behav 1992 26: 339-49.
- Triana-Del Rio R, Tecamachaltzi-Silvaran MB, Diaz-Estrada VX, Herrera-Covarrubias D, Corona-Morales AA, Pfaus JG, Coria-Avila GA. Conditioned same-sex partner preference in male rats is facilitated by oxytocin and dopamine: effect on sexually dimorphic brain nuclei. Behav Brain Res 2015 283: 69-77.
- Cibrian-Llanderal T, Rosas-Aguilar V, Triana-Del Rio R, Perez CA, Manzo J, Garcia LI, Coria-Avila GA. Enhaced D2-type receptor activity facilitates the development of conditioned same-sex partner preference in male rats. Pharmacol Biochem Behav 2012 102: 177-83.
- Triana-Del Rio R, Montero-Dominguez F, Cibrian-Llanderal T, Tecamachaltzi-Silvaran MB, Garcia LI, Manzo J, Hernandez ME, Coria-Avila GA. Same-sex cohabitation under the effects of quinpirole induces a conditioned socio-sexual partner preference in males, but not in female rats. Pharmacol Biochem Behav 2011 99: 604-13.
- Manzo J, Carrillo P, Pérez-Pouchoulen M. lenguaje químico del sistema nervioso. En: CoriaAvila GA, Neurofisiología de la conducta. Universidad Veracruzana 2012 44-60.
- Moore RY, Bloom FE. Central catecholamine neuron systems: anatomy and physiology of the norepinephrine and epinephrine systems. Annu Rev Neurosci 1979 2: 113-68.
- Green JD, Clemente CD, De Groot J. Rhinencephalic lesions and behavior in cats: an analysis of the Kluver-Bucy syndrome with particular reference to normal and abnormal sexual behavior. J Comp Neurol 1957 108: 505-45.
- Clark JT, Smith ER. Clonidine suppresses copulatory behavior and erectile reflexes in male rats: lack of effect of naloxone pretreatment. Neuroendocrinology 1990 51: 357-64.
- Rodriguez-Manzo G, Fernandez-Guasti A. Reversal of sexual exhaustion by serotonergic and noradrenergic agents. Behav Brain Res 1994 62: 127-34.
- Allard J, Giuliano F. Central nervous system agents in the treatment of erectile dysfunction: how do they work? Curr Urol Rep 2001 2: 488-94.
- Smith ER, Maurice J, Richardson R, Walter T, Davidson JM. Effects of four beta-adrenergic receptor antagonists on male rat sexual behavior. Pharmacol Biochem Behav 1990 36: 713-7.
- Ramirez OA, Carrer HF. Effect of estrogen and progesterone priming on the uptake and release of serotonin and noradrenaline from the ventromedial hypothalamus. Acta Physiol Lat Am 1982 32: 313-9. 61.
- Fernandez-Guasti A, Larsson K, Beyer C. Potentiative action of alpha- and beta-adrenergic receptor stimulation in inducing lordosis behavior. Pharmacol Biochem Behav 1985 22: 613-7.
| Recibido: 07 de octubre de 2015 | Aceptado: 08 de noviembre de 2015 |
Centro de Investigaciones Cerebrales. Universidad Veracruzana. Av. Luis Castelazo Ayala s/n, carr. Xalapa-Veracruz, km 3.5, C.P. 91190, Col. Industrial Ánimas. Xalapa, Veracruz, México. Teléfono: +52-228-8418900 Ext. 13609. e-mail: gcoria@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
