Dimorfismo cerebral y preferencia sexual en una rata pseudohermafrodita
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Comunicación Breve
Coria-Avila GA1*, Herrera-Covarrubias D1, Paredes-Ramos P1, Alvarez-Croda DM1, Tecamachaltzi-Silvarán MB1, Rosales-Raya JB2, Soto-Cid AH1, Ismail N3, Manzo J,1
1Centro de Investigaciones Cerebrales, Universidad Veracruzana. Xalapa, Ver., México 2Laboratorio Clínico Veterinario. Xalapa, Ver., México. 3Ottawa University, School of Psychology. Ottawa, OT., Canada.
Resumen/Abstract
Introducción
Material y métodos
Resultados
Discusión
Conclusiones
Agradecimientos
Referencias
Correspondencia
Introducción: El cerebro es sexualmente dimórfico pues los machos tienen algunos núcleos cerebrales de mayor tamaño que las hembras. Tal dimorfismo ocurre en el periodo perinatal, mucho después de que se han formado los genitales y órganos accesorios. En general, es aceptada la idea de que la preferencia sexual de un individuo correlaciona con el dimorfismo cerebral y no con el fenotipo genital. Método: En el presente trabajo describimos a una rata macho pseudohermafrodita, la cual fenotípicamente parecía hembra. Se evaluó su preferencia de pareja sexual frente a machos y hembras en dos pruebas diferentes, y posteriormente se analizó el dimorfismo de algunos núcleos cerebrales y se describió la histología de genitales y algunos órganos accesorios. Resultados: mostraron que la preferencia de pareja fue bisexual y su cerebro también tenía una organización bisexual. Se discute el papel organizacional de las hormonas en el dimorfismo cerebral y el papel de los núcleos cerebrales en relación a la preferencia de pareja. Conclusión: El cerebro de un pseudohermafrodita puede tener un dimorfismo intermedio y correlacionar con conducta bisexual.
Palabras clave: Dimorfismo cerebral, Pseudohermafrodita, Preferencia de pareja, Homosexual.
Introduction: The brain is sexually dimorphic because males express bigger nuclei in certain regions as compared to females. Brain dimorphism occurs during the perinatal period, much later than the period when genitals and accesory organs are formed. In general, it is well accepted the idea that sexual preference correlates with brain dimorphism, and not with genital phenotype. Method: In the present study we describe a male pseudohermaphrodite rat, which looked like female. We assessed its sexual partner preference before males and females in two separate tests and then its brain dimorphism and histology of genitals and accesory organs were analyzed. Results: they indicated that its partner preference was bisexual and its brain was also organized bisexually. We discuss the role of hormones in the organization of the brain and also the role of some brain nuclei with regard to sexual partner preference. Conclusion: A pseudohermaphrodite brain may express an intermediate dimorphism and correlate with bisexual partner preference.
Key words: Brain dimorphism, Pseudohermaphrodite, Partner preference, Homosexual.
Hermafrodito fue un personaje de la mitología griega, llamado así por la combinación de los nombres de sus padres Hermes y Afrodita.1 Se dice que una ninfa enamorada de nombre Salmácide forcejeó con él en el fondo de un lago, mientras rogaba a los dioses que nunca se separaran. Su deseo fue concedido y ambos cuerpos se fusionaron, resultando en un individuo con la belleza y delicadeza de una mujer y la fuerza y vigor de un hombre. Actualmente el término hermafrodita se utiliza para referirse a individuos intersexuales, cuyas características fenotípicas no permiten identificarles claramente como masculinos o femeninos, de modo tal que se pueden clasificar únicamente de acuerdo a la histología de sus gónadas. Los verdaderos hermafroditas son raros de encontrar y tienen una o ambas gónadas con tejido ovárico y testicular (ovotestis), o también pueden tener un testículo y un ovario. Por el contrario, los pseudohermafroditas son más comunes y sólo tienen gónadas de un sexo, pero órganos reproductivos accesorios del sexo opuesto. Por ejemplo, un macho pseudohermafrodita tiene testículos y órganos accesorios femeninos, mientras que una hembra pseudohermafrodita tiene ovarios y órganos accesorios masculinos.2
Al momento del nacimiento se puede identificar el sexo de un individuo. Sin embargo, es imposible predecir el tipo de preferencia sexual que tendrá en la edad adulta. La preferencia sexual hacia una pareja no se puede predecir por el sexo genético, gonadal o por la apariencia de órganos accesorios, y un buen ejemplo de esto se observa en los individuos con preferencia homosexual o bisexual. Desde hace muchos años se conoce que el dimorfismo sexual cerebral ocurre en las últimas etapas de gestación y en el periodo postnatal temprano.3 Esto significa que los neurocircuitos presuntamente responsables de la preferencia sexual se forman mucho después de que se han formado las gónadas y los órganos sexuales accesorios.4-7 Por lo tanto, la preferencia sexual no necesariamente corresponde al sexo genético, gonadal o genital.
Hasta ahora, múltiples estudios sugieren que la preferencia sexual de un individuo correlaciona en una proporción suficiente con el dimorfismo sexual del cerebro. Así, en el encéfalo de machos heterosexuales algunos núcleos cerebrales hipotalámicos y amigdalinos son de tamaño mayor que los núcleos equivalentes en las hembras heterosexuales, y machos homosexuales.8-13 En el presente trabajo se describe la preferencia sexual de una rata pseudohermafrodita, la cual se analizó frente a machos y hembras. Además, se evaluó detalladamente la histología de la gónada encontrada y órganos accesorios, y se midió el tamaño de núcleos hipotalámicos y amigdalinos para determiar su dimorfismo sexual cerebral. Hasta donde sabemos, este es el primer reporte publicado que incluye dichos analisis.
Sujeto experimental
Se estudió a una rata de la cepa Wistar, nacida y criada en el bioterio del Centro de Investigaciones Cerebrales, Universidad Veracruzana, México. Esta rata permaneció desapercibida con el resto de la camada. En el día postnatal 21 (p21) las crías fueron separadas por sexo. Debido al fenotipo al destete, la rata se agrupó junto con 4 hembras más en una caja mediana de acrílico con una pequeña base de aserrín como cama. Todas las ratas fueron mantenidas a temperatura ambiente en un ciclo inverso 12:12 h luz/oscuridad (Luz se prendía a las 20:00 h), y se les proporcionó agua purificada y alimento de roedor (Rismart) ad libitum.
La rata, originalmente clasificada como hembra, participó en un estudio de conducta entre los días postnatales P31-P41. Posteriormente el día P45 todas las hembras de su grupo se sometieron a una ovariectomía como parte del experimento. Fue durante la cirugía que se detectó el pseudohermafroditismo de este animal. Al no encontrarse los ovarios fue suturada. Con la rata anestesiada se procedió a realizar una riguroza exploración de sus órganos sexuales externos. En términos generales se descubrió que los genitales externos eran anormales al compararla con un macho o con una hembra de su misma edad (Figura 1 A, B, C). No presentaba testículos, pero tampoco tenía una vagina bien formada. Una protuberancia en la región más anterior de los genitales semejaba un pene muy pequeño, cubierto por pliegues que parecían labios vaginales (a pesar de que las ratas hembra normales no presentan labios). En la descripción macroscópica la rata parecía una hembra con alteraciones de vagina y vulva. Para aprovechar este interesante hallazgo, se decidió evaluar su conducta sexual y su preferencia de pareja frente a un macho y una hembra, respectivamente; y a establecer el dimorfismo sexual del cerebro a través de la relación con el tamaño de los núcleos hipotalámicos y amigdalinos.
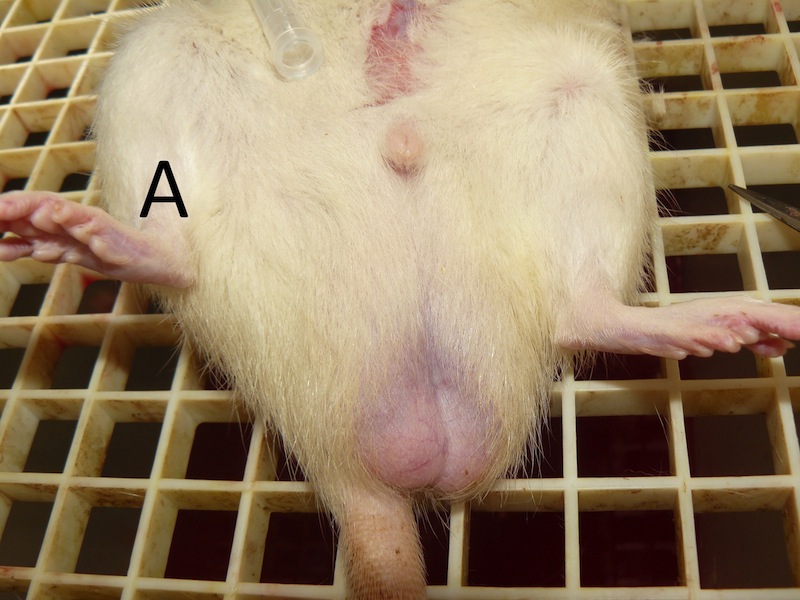
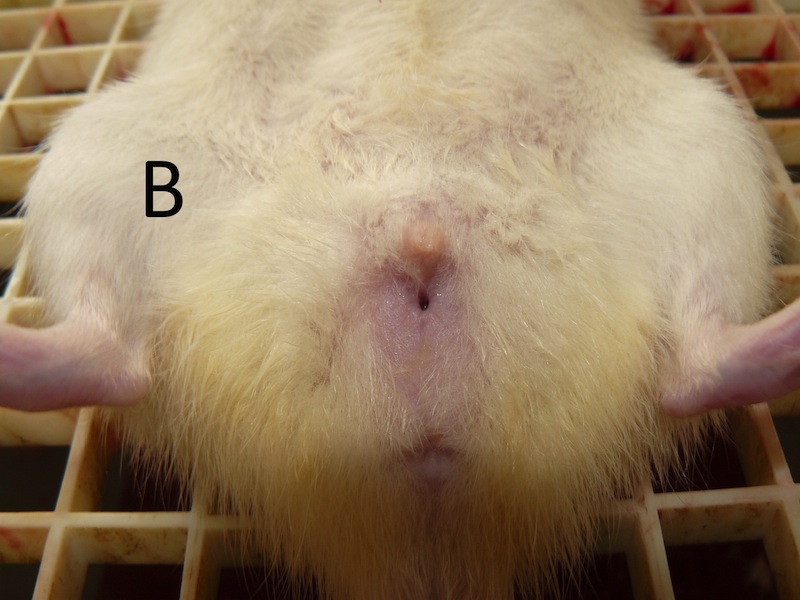
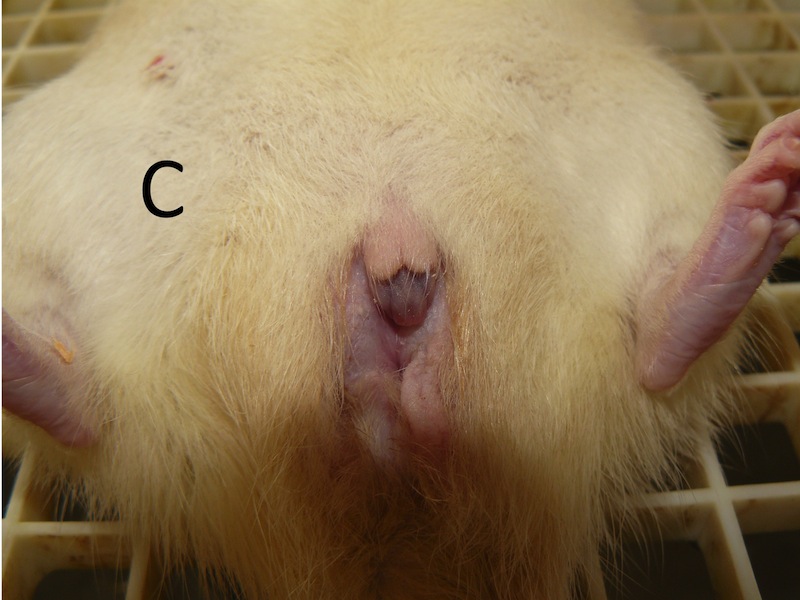
Figure 1. Path of the signal: from the nerve recording to the virtual instrument. The electrical signal from hypoglossal nerve is acquired using a suction electrode, an analog amplifier and a digitizer. Data in .abf format are loaded to the virtual instrument. Filtering, rectification and integration of the signal are performed by the virtual instrument.
2.1 Pruebas de conducta sexual
Prueba de pareja 1
Debido a que la rata fue inicialmente sexada fenotípicamente como hembra, fue sometida junto con las demás hembras de su grupo (ya ovaeriectomizadas) a tratamiento hormonal. El día P53 recibió una inyección subcutanea (sc) de benzoato de estradiol (10 μg) y por la mañana del día P55 recibió progesterona (500 μg) 4 h antes de la prueba sexual. La rata se colocó en una arena cilíndrica transparente (50 cm de altura X 60 cm de diámetro) por 5 minutos y posteriormente se introdujo un macho considerado sexualmente experto (con al menos 10 sesiones de cópula en semanas anteriores). La conducta se videograbó y se registró por 20 minutos. Posteriormente se retiró el macho de la arena y 5 minutos después de se introdujo una hembra sexualmente receptiva (sometida al mismo esquema hormonal). La conducta también se videograbó y se registró.
Prueba de pareja 2
Un mes después (p85), la rata se sometió a una segunda prueba de preferencia de pareja en la cual se le permitió elegir entre un macho y una hembra simultáneamente. La rata (fenotípicamente hembra) se inyectó con benzoato de estradiol (p79) y progesterona (p81) como en la prueba de pareja 1, y esto se repitió una vez más (estradiol p83 y progesterona p85). Al día p85 la rata se colocó en una area de tres compartimentos que tenía una delgada capa de aserrín como cama. El compartimento medio (20cm ´ 30cm ´ 45cm) estaba conectado a dos compartimentos laterales a través de un tunel transparente en forma de T de 20 cm de longitud. En un compartimento lateral (de las mismas dimensiones) se colocó a un macho y en el otro compartimento se colocó una hembra. Las dos parejas potenciales (macho y hembra) se mantuvieron en sus respectivos compartimentos con la ayuda de chalecos atados a un elastico de 20 cm de longitud, el cual les permitía moverse dentro de su area pero sin poder salir. Por lo tanto, la rata experimental pudo interactuar líbremente con las dos parejas y elegirlas durante un periodo de 20 minutos.
3.1. Resultados de conducta
En la Prueba de Pareja 1, se observó que la rata experimental se comportó mayoritariamente femenina. Específicamente, la rata recibió un mayor número de persecuciónes, olfateos en la regíon genito-anal y montas, las cuales incluso provocaron que la rata respondiera con lordosis. En complemento, cuando minutos después fue expuesta a una hembra sexualmente receptiva, la rata experimental solo desplegó olfateos en la regíon genito-anal, pero no hizo ningún intento de monta hacia la hembra (Tabla 1). Durante el análisis de la Prueba de Pareja 2 (macho y hembra de manera simultanea) se observó una respuesta conductual mayoritariamente masculina. Específicamente, la rata desplegó más montas hacia la hembra y con menor latencia, y más investigaciones olfativas genitales con menor latencia. Sin embargo, la frecuencia de visitas y de conductas proceptivas como los brincos y carreras cortas ocurrieron de manera similar hacia el macho y hacia la hembra. La rata respondió con lordosis cuando el macho o la hembra le tocaban los flancos (Tabla 1).
3.2. Histología de gónadas y órganos accesorios
Una semana posterior al análisis conductual, la rata pseudohermafrodita se sacrificó con una sobredosis de pentobarbital sódico (120 mg/kg, i.p.). Las gónadas y órganos sexuales accesorios se retiraron con una cuidadosa disección y se procesaron para su análisis histológico con Hematoxilina y Eosina. Basado en el análisis histológico y su comparación con un macho normal de su misma edad se determinó que se trataba de un macho pseudohermafrodita al describir las siguientes estructuras: 1) gónada, 2) epidídimo, 3) próstata, 4) vesículas seminales, 5) glande, y 6) región bulboesponjosa.
Tabla 1. Pruebas de preferencia de pareja. Resultados de preferencia de pareja en la rata pseudohermafrodita expuesta a macho y hembra en dos pruebas diferentes (separados vs. simultaneamente). ª= Hops&Darts en inglés. b= algunos interpretan el boxeo como conducta de juego. NA= no aplica.
Conductas |
Prueba de Pareja 1 |
Prueba de Pareja 2 |
||
Sexuales |
Macho |
Hembra |
Macho |
Hembra |
Montas ejecutadas (frecuencia) |
0 |
0 |
1 |
4 |
Latencia a primer monta ejecutada (seg) |
NA |
NA |
963 |
190 |
Brincos y carreras cortas (frecuencia)ª |
0 |
0 |
3 |
3 |
Brincos y carreras cortas latencia (seg)ª |
NA |
NA |
141 |
186 |
Montas recibidas (frecuencia) |
5 |
0 |
0 |
0 |
Latencia a primer monta recibida (seg) |
10 |
NA |
NA |
NA |
Olfaciones genitales (frecuencia) |
15 |
45 |
23 |
42 |
Latencia a primer olfación (seg) |
15 |
10 |
35 |
13 |
Lordosis (frecuencia) |
3 |
0 |
1 |
1 |
Sociales |
||||
Visitas (frecuencia) |
NA |
NA |
33 |
32 |
Latencia a primer visita (seg) |
NA |
NA |
31 |
12 |
Tiempo pasado en compartimento (%) |
NA |
NA |
19 |
81 |
Defensa |
||||
Boxeo (frecuencia)b |
10 |
0 |
23 |
14 |
Patadas (frecuencia) |
8 |
0 |
0 |
1 |
3.3 Resultados de Histología
Gónada
En macho pseudohermafrodita. La estructura básica estuvo bien diferenciada como un testículo (Figura 2A): se observó túnica albugínea, lobulaciones y septos, aunque el tejido intersticial estromal fue escaso. Había presencia de células intersticiales bien diferenciadas. En los lóbulos estaban presentes las células sustentaculares y la línea gametogénica. Se observaron acrosomas, pero no se observó rete testis.
En macho control. Se observó túnica albugínea visceral como adventicia. En el interior se observó el típico acomodo parenquimatoso testicular, con lobulaciones por la formación de los túbulos seminíferos contorneados (Figura 2B). Tampoco se identificaron los vasa recta ni la rete testis. Se observaron células intersticiales y dentro de los lóbulos se observó el resto de la unidad gametogénica: células sustentaculares y la línea de la gametogonia, la cual estaba activa con presencia de gametos en alta magnificación.
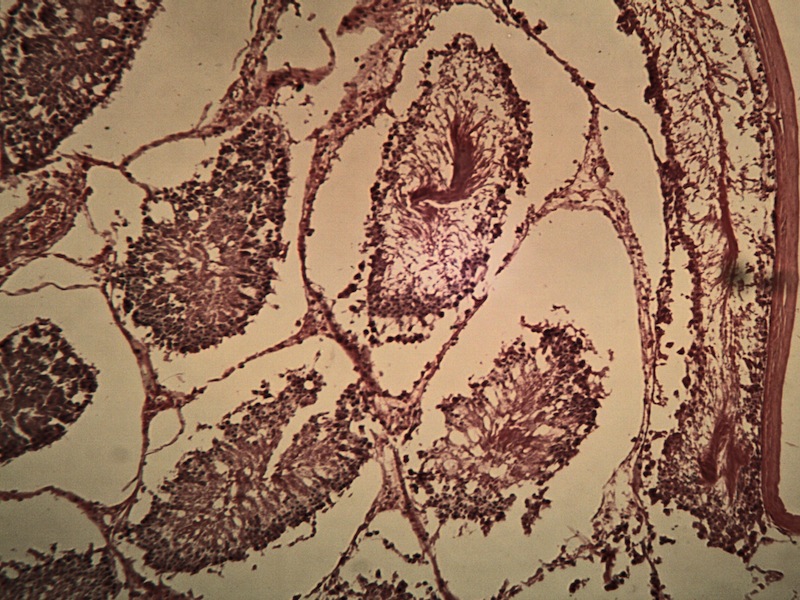
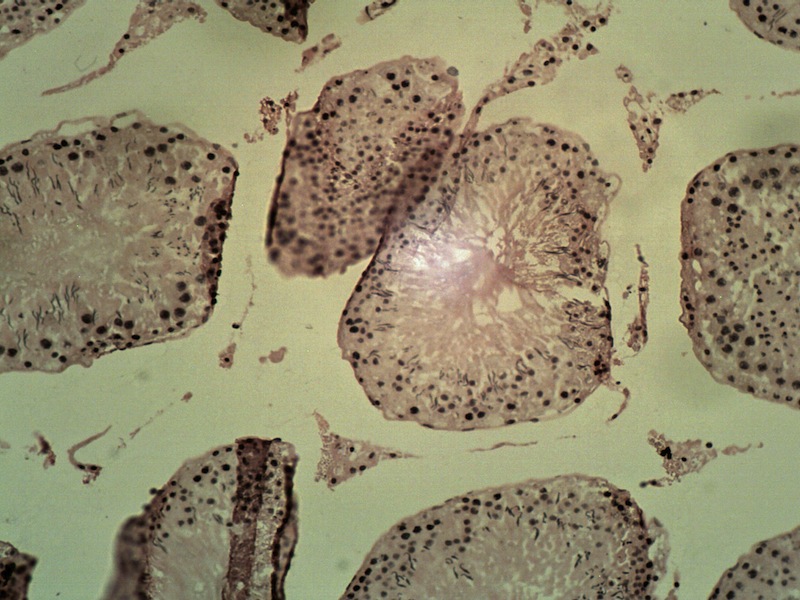
Figure 1. Path of the signal: from the nerve recording to the virtual instrument. The electrical signal from hypoglossal nerve is acquired using a suction electrode, an analog amplifier and a digitizer. Data in .abf format are loaded to the virtual instrument. Filtering, rectification and integration of the signal are performed by the virtual instrument. Epidídimo En macho control. Hubo presencia de cápsula de tejido conectivo delgado y gran cantidad de adiposo unilocular. Bajo éste se observó la túnica albugínea con sus proyecciones fibrosas al centro que dan lugar a los septos que separan los ductos epididimarios. El epitelio era cilíndrico simple no ciliado. Abundantes gametos en el lumen de la ducta. Próstata En macho control. Con patrón glandular acinoso. Lobulillos limitados por mioepitelio con tejido conectivo escaso en los intersticios. Epitelio glandular propio de próstata, con abundantes lacunae de licor prostático y corpora amilacea que mimetizaba sangre en bajos aumentos. Próstata ventral izquierda: Se observaron zonas simétricas lobulares de tejido típicamente protático con su acomodo tubuloalveolar compuesto, limitados por epitelio cilíndrico simple y lacunae. En la periferia del corte se observó tejido alveolar compuesto pero con acomodo menos denso, mayor tejido mioepitelial y epitelio cúbico simple, así como corpora amilacea en lugar de lacunae. Próstata dorsolateral izquierda: Tenía un acomodo muy semejante a próstata ventral izquierda, solo que la orientación del corte es ligeramente oblicua. Vesículas seminales En macho control. Presencia de adventicia de epitelio plano simple, posiblemente seroso. Debajo de este se encontró una gruesa capa de músculo liso. Hacia la túnica íntima de encontraron proyecciones de tejido conectivo y mioepitelio que daban aspecto de trabeculaciones. Epitelio glandular abundante. Presencia de secreciones azurófilas tipo lacunae.
En macho pseudohermafrodita. El epitelio fue cilíndrico ciliado, pero en su mayoría estaba degenerado por vacuolas intracitoplasmáticas dando un aspecto de incipiente degeneración balonoide. Se observaron espermatozoides en el lumen de los ductos.
En macho pseudohermafrodita. El tejido prostático no estaba bien organizado, siendo evidente la presencia de zonas hiperplásicas de tejido epitelioglandular, mientras que en otras áreas se observaron los patrones tubuloalveolares con epitelio cúbico y lagunas de corpora amilacea.
En macho pseudohermafrodita. La estructura fue lobular trabecular. La cápsula era miofibrosa con proyecciones centrales que contenían septos trabeculares limitados de epitelio transicional. Se encontró infiltrados inflamatorios transmurales y luminales de tipo mixto: neutrofílico, eosinofílico, linfoplasmocítico e histiocítico. También había ectasia ductal con presencia de corpora arenaceae
Glande
En macho pseudohermafrodita. En un corte longitudinal. El epitelio fue plano estratificado queratinizado que formaba papilas o plicas córneas dispuestas craneocaudalmente. Se observó poca o nula presencia de tejido glandular. En el extremo libre se observó una depresión semejante a una fóvea, totalmente revestida del mismo epitelio estratificado plano queratinizado, incluyendo las plicas. Había presencia de uretra peneana, y se encontraron algunas fibras y tejido eréctil en el centro del pene. El centro del glande y pene es de tejido conectivo laxo. Hacia la base se observó musculatura estriada y un centro de tejido especialidado: hueso formando un verdadero os penis. Se observó prepucio y el fórnix prepucial que es identificado exactamente en la zona donde el epitelio peneano se diferencia en epitelio mucosal prepucial. Sobre la cara externa o cutánea del prepucio es diferenciable parte de la fascia dartoica y las glándulas anexas de piel orientadas hacia ésta última. Se aprecia un saco o divertículo que aparenta ser un divertículo prepucial.
En macho control. Prepucio limitado de epitelio plano estratificado queratinizado por la cara mucosal. Se observaron glándulas de tipo sebáceo, posiblemente prepuciales. El endotelio prepucial estaba altamente queratinizado, incluso cornificado con depresiones o fosas que coincidían perfectamente con las plicas cornificadas del glande. Por la forma que se observó, se identificó que las plicas no eran perpendiculares al cuerpo del glande, sino oblicuas, ya que se orientaban de forma inclinada. El cuerpo del glande presentó tejido conectivo, colágena y vasos sanguíneos con una estructura eréctil. En la cara ventral del glande se observó la uretra, la cual estaba limitada por epitelio plano estratificado queratinizado. Ventral a ésta, se encuentró tejido conjuntivo diferenciado en hueso verdadero, el cual mostró matriz osteoide, osteocitos y osteoblastos, aunque no fue identificable la presencia de osteonas. Esta estructura ósea se ubicó totalmente ventral al cuerpo del pene y tenía acomodo concéntrico centrífugo hacia la porción dorsal, siendo bien diferenciado en hueso hacia ventral y poco diferenciado como mesenquimatoso hacia dorsal, para realizar colindancia con la uretra. El hueso peneano podría tener en realidad dos ramas divergentes o convergentes, o incluso hasta podría ser un hueso dorsal y uno ventral, ya que en algunos cortes se observaron dos huesos en acomodo dorsal y ventral divididos por tejido conjuntivo no diferenciado.
Región Bulboespojosa
En macho pseudohermafrodita. Se observó un corte transverso de estructuras tubulares. El perfil del espécimen fue semielíptico rodeado casi en su totalidad de tejido muscular estriado. Al centro de la elipse se observaron estructuras tubulares. Alineadas en el ecuador del huso de corte se observó en un lado, una estructura tubular rodeada de músculo estriado, teniendo fibras longitudinales hacia el lumen, mientras que otra capa adventicia a la anterior las tiene transversas. El interior de este tubo se encuentra formado por tejido epitelial transicional en acomodo papilar y distribución trabecular. Supone ser la uretra. Al centro del huso, dorsal tubo anterior, existen dos tubos cortados transversalmente, los cuales están divididos por un septo de tejido conectivo denso y rodeado cada tubo por tejido conectivo laxo y miofibras lisas. El interior de cada tubo contiene epitelio glandular y se aprecian cúmulos semejantes a corpora amilacea. Este supone ser la desembocadura de los colículos seminales, justo antes de anastomosar a la uretra. En el otro extremo del polo del corte se observaron estructuras tubulares dispersas más o menos simétricas. Todas tienen epitelio glandular e infiltrados inflamatorios luminales. Se observó mucha corpora amilacea en el lumen de estas estructuras. También se observó congestión vascular, cristales de hemosiderina y hemosiderófagos en el tejido intersticial a los ductos. Coinciden con tejido glandular prostático.
En macho control. Estructura eminentemente muscular y cavernosa eréctil. El tejido muscular fue de tipo estriado esquelético en diversas direcciones, pero sin mezclar las fibras. Se observaron cuerpos esponjosos vasculares y un centro de conducto uretral limitado de epitelio de transición. Se observó una zona glandular en una de las paredes de dicho conducto. Posiblemente tejido glandular uretral diseminado en el dorso de la misma. Se encontraron dos glándulas periféricas, posiblemente dorsolaterales de tipo tubuloalveolar que emanan una secreción azurófila, posiblemente proteinácea, hacia la luz de sus respectivos tubos, los cuales están delimitados de epitelio cúbico simple. Muy parecidas a glándulas bulbouretrales.
3.4. Dimorfismo sexual cerebral
El cerebro de la rata experimental (macho pseudohermafrodita) y los cerebros de un macho normal y una hembra normal se procesaron para ser teñidos con la técnica de Nissl. Primero se pinzó la aorta descendente y se administró transcardialmente (ventrículo izquierdo) una solución 500 ml al 0.9% con heparina (0.010 mg/L) como anticoagulante a temperatura de 4°C, posteriormente se administró 500 ml de la solución fijadora compuesta de paraformaldehido al 4%, disuelta en un amortiguador de fosfato de sodio 0.1 M (pH=7.4) a temperatura de 4°C. Terminada la perfusión se decapitó al animal, se extrajo el cerebro y el tejido se dejó 12 h en post fijación en la misma solución fijadora. Para la crioprotección, el tejido se colocó cada 24 h en solución de sacarosa al 10, 20 y 30% hecha en solución amortiguadora de fosfato de sodio 0.1 M. durante 24 h en cada solución y se mantuvo en refrigeración (4° C). Se obtuvieron cortes coronales de 40 micras de grosor, usando un crióstato LEICA 1850 a una temperatura de -25 °C para proteger el tejido. Los cortes se montaron y los portaobjetos fueron sumergidos en las soluciones siguientes: agua destilada (1 minuto), violeta de cresilo (15 min), alcohol etílico al 70% (30 segundos), alcohol etílico al 95% (15 seg), alcohol etílico al 100 % (5 seg) y xileno (30 seg). Después de secarse se colocó permount y un cubreobjetos sobre las laminillas. Se tomaron imágenes digitales por medio de un microscopio de luz con objetivo 4X y se analizó el área en micras cuadradas de dichas estructuras con ayuda del programa Sigma SCAN Pro 4. Se incluyeron estructuras previamente reportadas como sexualmente dimórficas, las cuales fueron identificadas de acuerdo a los planos de un atlas del cerebro de rata14: Núcleo sexualmente dimórfico del área preóptica media (SDN-MPOA por sus siglas en inglés) plano 22,7 Núcleo ventromedial del hipotálamo (VMH) con sus tres subdivisiones dorsomedial, central y ventrolateral, plano 29 y 30,15 amígdala medial posterodorsal (MePD) plano 31 y 32.16 Así mismo, para corroborar nuestras medición se incluyeron algunas estructuras que no son sexualmente dimórficas: Núcleo supraquiasmático (SCN) plano 22 y 23 y Núcleo supraóptico (SON) plano 23 y 24.7,17 Se tomaron de 3-5 fotos de cada estructura, las cuales se midieron tres veces por un investigador que desconocía el origen de la imagen para evitar subjetividad en los resultados. Se obtuvo el promedio de todas las imágenes para cada estructura y se convirtieron en porcentaje relativo al valor obtenido en el macho normal. Debido a que sólo se midieron 3 animales (un macho, una hembra y el macho pseudohermafrodita) los resultados no se sometieron a ninguna prueba estadística inferencial, por lo tanto solamente se discuten en relación a la estadística descriptiva.
3.5. Resultados dimorfismo cerebral
Los resultados de las estructuras sexualmente dimórficas se muestran en la Figura 3 y en la Tabla 2. Como era de esperarse la hembra tuvo valores inferiores al macho en NSD-MPOA, VMH, y MePD, las cuales fueron previamente reportadas como sexualmente dimórficas. El macho pseudohermafrodita tuvo valores inferiores solo en NSD-MPOA y MePD, pero no en el VMH (Figura 3 A, B, C). Cuando se evaluaron las subregiones del VMH se observó que el macho pseudohermafrodita tuvo valores por arriba del macho normal en la región central y ventrolateral. Como era también de esperarse, en las estructuras que no han sido reportadas como sexualmente dimórficas (SQN y SON) no se observaron diferencias con valores porcentuales mayores a 4% entre los tres animales.
La Figura 3, muestra las estructuras cerebrales relacionadas con el dimorfismo sexual en el macho (Figura 3A), en la hembra (Figura 3B) y en el macho pseudohermafrodita (Figura 3C). Las imágenes de la izquierda (A1, B1, C1) muestran el área preóptica medial con el núcleo sexualmente dimórfico (flecha negra) y el núcleo supraquiasmático (flecha blanca). Las imágenes de la derecha (A2, B2, C2) muestran el hipotálamo ventromedial (flecha punteada). Las áreas de los diferentes núcleos se muestran en la Tabla 2. En la hembra las áreas de los núcleos considerados sexualmente dimórficos: núcleo sexualmente dimórfico del área preóptica media (NSD-MPOA), hipotálamo ventromedial (VHM) y la amígdala medial postero dorsal (MePD) fueron menores un 49.5%, 25.8% y 14.9% con respecto al macho control. El macho pseudohermafrodita tuvo valores inferiores solo en NSD-MPOA (31.6%) y MePD (16.2%), pero no en el VMH (Figura 3 A, B, C y Tabla 2). En relación con las áreas de las subregiones hipotalámicas del núcleo ventromedial (central y ventrolateral) se encontró que en el macho pseudohermafrodita las áreas fueron ligeramente más grandes que las del macho control. Las áreas de las estructuras que no han sido reportadas como sexualmente dimórficas (núcleos supraquiasmáticos y supraópticos fueron semejantes en los tres animales.
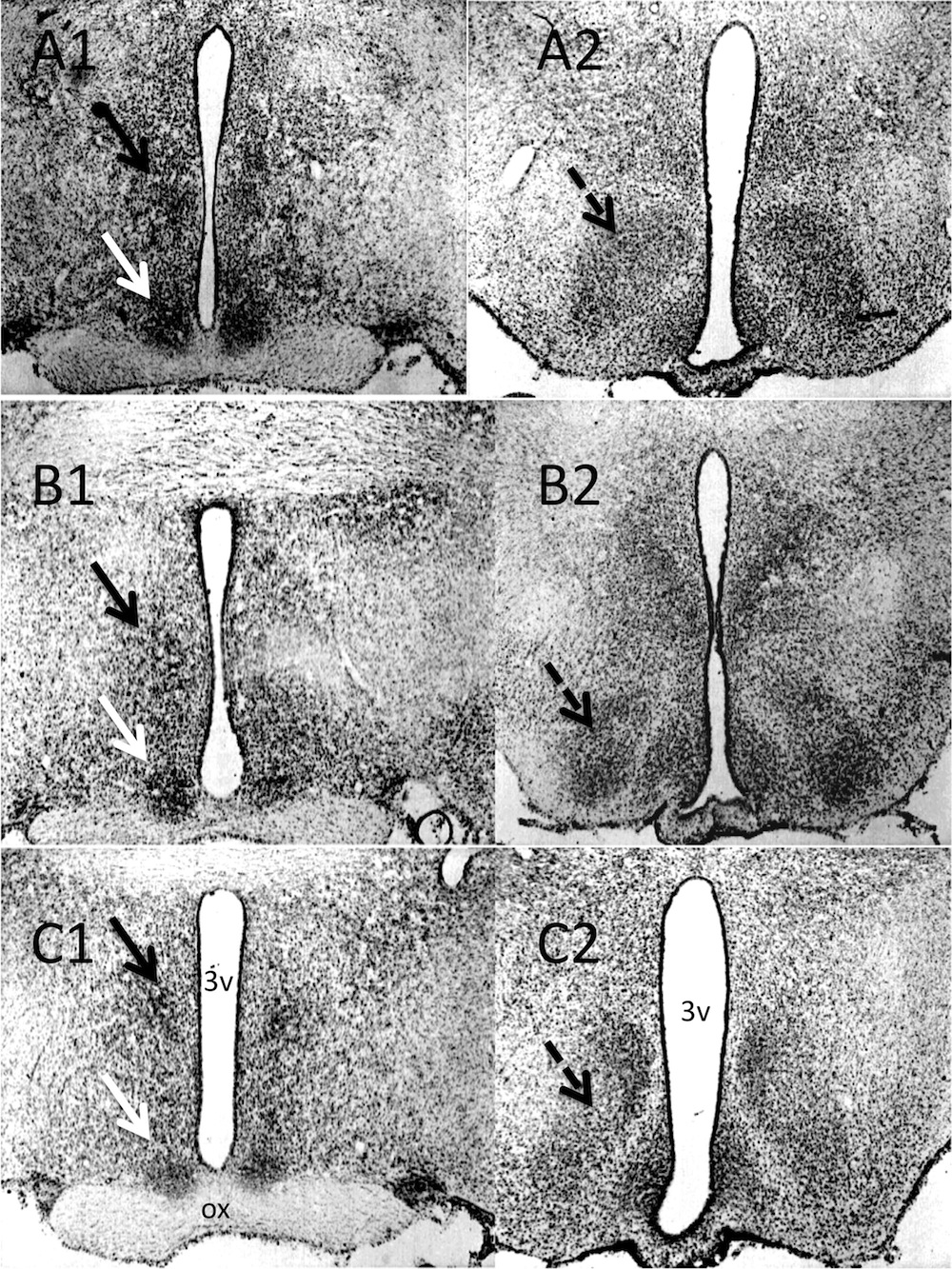
Figura 3. Cortes coronales de cerebros de un macho (A), una hembra (B) y el macho pseudohermafrodita (C), teñidos con Nissl. Las imágenes de la izquierda (A1, B1, C1) muestran el área preóptica media con el núcleo sexualmente dimórfico (flecha negra) y el núcleo supraquiasmático (flecha blanca). Las imágenes de la derecha (A2, B2, C2) muestran el hipotálamo ventromedial (flecha punteada). 3v (tercer ventrículo), ox (quiasma óptico).
Tabla 2. Dimorfismo cerebral. Área en micras cuadradas de diferentes estructuras sexualmente dimórficas: NSD-MPOA= núcleo sexualmente dimórfico del área preóptica media; VMH= hipotálamo ventromedial; MePD= amígdala medial posterodorsal, y otras estructuras no sexualmente dimórficas: SON= núcleo supraóptico del hipotálamo, SQN= núcleo supraquiasmático. Los valores obtenidos en el macho normal se consideraron el 100% y en relación a ese valor se obtuvieron los porcentajes de hembra y macho pseudohermafrodita
Estructura cerebral |
Macho |
% vs. Macho Normal |
Hembra |
% vs. Macho Normal |
Macho Pseudo- |
% vs. Macho Normal |
Sexualmente dimórficas |
|
|
|
|
|
|
NSD-MPOA |
19626 |
100% |
9918 |
50.5% |
13425 |
68.4% |
VMH (área total) |
50288 |
100% |
37625 |
74.8% |
50734 |
100.8% |
Región dorsomedial |
20683 |
100% |
13719 |
66.3% |
22747 |
109.9 |
Región central |
12158 |
100% |
8594 |
70.6% |
15413 |
126% |
Región ventrolateral |
14704 |
100% |
13406 |
91.1% |
16485 |
112% |
MeApd |
471741 |
100% |
401665 |
85.1% |
395540 |
83.8% |
Sexualmente NO dimórficas |
|
|
|
|
|
|
SON |
2082 |
100% |
2000 |
96% |
2001 |
96.1% |
SQN |
2044 |
100% |
2025 |
99% |
2024 |
99% |
En el presente estudio evaluó la preferencia de pareja sexual de una rata macho con pseudohermafroditismo, la histología de los órganos sexuales y accesorios y el tamaño de los núcleos cerebrales relacionados con el dimorfismo sexual.
Preferencia sexual
Los datos conductuales indicaron que la preferencia sexual del macho pseudohermafrodita puede considerarse como bisexual, en función de la presencia de un macho o una hembra de manera individual, o de la presencia simultánea de un macho y una hembra. En la Prueba de Pareja 1, cuando la exposición ocurrió de manera separada a un macho y a una hembra, la rata pseudohermafrodita se comportó mayoritariamente femenina al aceptar montas del macho y responder con lordosis. En la Prueba de Pareja 2, con exposición a un macho y una hembra simultáneamente, la rata pseudohermafrodita se comportó mayoritariamente masculina al realizar montas a la hembra, pero también desplegó conductas de proceptividad femenina (i.e. brincos y carreras cortas) y receptividad (i.e. lordosis) hacia el macho y la hembra, es decir, de manera bisexual, auque su conducta sexual en general fue deficiente, comparada con animales normales.
En estudios previos con machos pseudohermafroditas insensibles a andrógenos (testicular feminization mutant, tfm) se ha observado que actúan como hembras normales, aunque a veces no muestran preferencia sexual a pesar de haber sido tratados con estrógenos.18 Además, cuando esos machos pseudohermafroditas fueron expuestos a orina de machos normales, respondieron al igual que las hembras con mayor inmunoreactividad a c-Fos en el área preóptica media del hipotálamo, lo cual sugiere que al igual que ellas se motivan con la presencia de señales masculinas, es decir, presentaban un cerebro feminizado. Otro estudio mostró que machos tfm castrados neonatalmente mostraron un incremento en la lordosis, comparados con machos tfm intactos,19 lo cual indica que la ausencia de andrógenos perinatales aunado a la insensibilidad a estos en la edad adulta facilita el despliegue de conductas femeninas. Dichas conductas pueden observarse en machos normales que fueron gonadectomizados en el periodo perinatal temprano y posteriormente tratados con estrógenos en la edad adulta.20 Para que un macho realice lordosis se requiere que en el periodo crítico perinatal su cerebro no haya sido expuesto a andrógenos o estrógenos, lo cual facilita la organización de un cerebro femenino. En la edad adulta el tratamiento hormonal activará conductas que dependen de neurocircuitos organizados perinatalmente. En caso de presencia perinatal de andrógenos el cerebro se organiza como masculino y dichas hormonas activarán conductas masculinas en la edad adulta.3
Histología de los órganos sexuales
Los hallazgos histológicos corresponden a un macho pseudohermafrodita. Fenotípicamente la rata parecía tener vagina y clítoris (Figura 1C). Sin embargo, la histología gonadal mostró ser de un macho (Figura 2B) con presencia de epidídimo, próstata, vesículas seminales, glande, y pene, aunque este último de aspecto macroscópico anormal. Además, se encontraron espermatozoides en túbulos seminíferos y epidídimo.
Dimorfismo Cerebral
Los resultados de tres estructuras sexualmente dimórficas indicaron que la rata pseudohermafrodita tenía un cerebro más parecido al de una hembra que al de un macho. Los valores encontrados en NSD-MPOA y MePD fueron inferiores al macho control, pero el VMH fue mayor. Como era de esperarse la hembra tuvo valores inferiores al macho control en las tres áreas. Cuando se evaluaron las subregiones del VMH del macho pseudohermafrodita se observó que tuvo valores porcentuales por arriba del macho normal en la región central y ventrolateral, pero no en la región dorsomedial. En base a estos hallazgos podemos sugerir que el dimorfismo cerebral del macho pseudohermafrodita pudiera reportarse como intermedio o intersexual en su organización, es decir, con algunas estructuras cerebrales más parecidas a las que presentan comúnmente los machos y otras más similares a las de una hembra promedio. Un dimorfismo intermedio pudiera explicar la conducta bisexual observada en las dos pruebas de preferencia de pareja.
El NSD-MPOA y la MePD controlan la conducta sexual masculina, así como el reconocimiento y la motivación social.21,22 Se cree que la conducta masculina y la preferencia hacia las hembras pudiera ocurrir por la acción de un NSD-MPOA de gran tamaño (8 veces más grande en machos que en hembras)5 y una MePD 1.5 veces mayor.23 Sin embargo, estas estructuras también controlan la conducta femenina24-26 y los mecanismos de recompensa sexual por las intromisiones peneanas y por estimulación del clítoris.27 Hasta ahora se especula que el volumen de dichas áreas afecta las aferencias y eferencias con otras regiones cerebrales, las cuales en conjunto facilitan la motivación por una pareja. En base a esa hipótesis reduccionista, es comprensible que en un macho pseudohermafrodita con un NSD-MPOA del 68% de tamaño y una MePD del 83% (en relación a un macho promedio) desplegara conducta bisexual. También es probable que el tamaño original de la MePD en el macho pseudohermafrodita fuera mucho menor al 83% en relación al macho normal, pues machos insensibles a andrógenos también tienen el volumen de la MePD de menor tamaño y los somas se observan parcialmente desmasculinizados.28 Sin embargo, el tratamiento hormonal que recibió con estrógenos y progesterona pudieron haber incrementado el tamaño de la MePD, lo cual en teoría resultaría en un dimorfismo menos marcado. De acuerdo al efecto reportado por Cooke y colaboradores29 es probable que el tratamiento exógeno con estrógenos aumente el volumen y el tamaño de los somas de la MePD. Así mismo, es importante discutir el efecto de las hormonas inyectadas en el despliegue de la conducta sexual en general del macho pseudohermafrodita. Es probable que sin el tratamiento hormonal la conducta sexual hubiera sido más deficiente o no se observara preferencia de pareja alguna.
El tamaño del VMH fue semejante en el macho normal y la rata pseudohermafrodita, mientras que en la hembra fue 25% más pequeño. Por el contrario, la región central y ventrolateral del macho pseudohermafrodita fueron 126% y 112% respectivamente mayores que en el macho normal. El VMH de un macho normal contiene una alta concentración de receptores a andrógenos comparado con hembras.30 Además, regiones como la anterior (VMHa), dorsomedial (VMHdm), central (VMHc), y ventrolateral (VMHvl) expresan diferentes patrones de conexión hacia otras regiones cerebrales que pueden afectar diferentes funciones en la conducta.31 La región ventrolateral contiene muchas neuronas que expresan receptores a estrógenos, las cuales están involucradas en la respuesta de lordosis en las hembras. En algunos estudios con machos tfm se ha reportado un VMH de tamaño intermedio, por lo que se ha argumentado que el tamaño de dicha estructura depende de los receptores a andrógenos durante el desarrollo. En términos generales, podemos decir que el tamaño del VMH en el macho pseudohermafrodita conservó un tamaño masculino. Sin embargo, podemos especular que el incremento anormal en las porciones centrales y ventrolaterales, junto con el decremento anormal de SDN-MPOA y MePD fueron las responsables de la conducta de lordosis, y el comportamiento bisexual en general.
Los resultados de este estudio indican que la rata macho pseudohermafrodita desplegó preferencia de pareja bisexual. Además, el análisis de las estructuras sexualmente dimórficas reveló que el SDN-MPOA y MePD tuvo organización femenina, pero en el VMH tuvo organización masculina. Estos hallazgos indican una organización cerebral bisexual, la cual concuerda con la preferencia sexual observada.
Apoyo SEP-CONACYT ciencia básica (167773) a GACA. Beca de doctorado (353271) a MBTS.
- Androutsos G. Hermaphroditism in Greek and Roman antiquity. Hormones 2006 5: 214-7.
- McEntee K. Reproductive pathology of domestic mammals. Academic Press, San Diego. 1990 pp 8-30.
- Phoenix CH, Goy RW, Gerall AA, Young WC. Organizing action of prenatally administered testosterone propionate on the tissues mediating mating behavior in the female guinea pig. Endocrinology 1959 65: 369-82.
- Davis EC, Shryne JE, Gorski RA. A revised critical period for the sexual differentiation of the sexually dimorphic nucleus of the preoptic area in the rat. Neuroendocrinology 1995 62: 579-85.
- Gorski RA. Sexual differentiation of the brain. Hosp Pract 1978 13: 55-62.
- Gorski RA. Sexual differenciation of the nervous system. En: Kandel ER y Jessell TM. (Ed.). Principles of Neural Science. 2000 pp 1131-1148.
- Gorski RA, Gordon JH, Shryne JE, Southam AM. Evidence for a morphological sex difference within the medial preoptic area of the rat brain. Brain Res 1978 148: 333-46.
- Gulia KK y Mallick HN. Homosexuality: a dilemma in discourse!. Indian J Physiol Pharmacol 2010 54: 5-20.
- LeVay S. A difference in hypothalamic structure between heterosexual and homosexual men. Science 1991 253: 1034-7.
- Roselli CE, Reddy RC, Kaufman KR. The development of male-oriented behavior in rams. Front Neuroendocrin 2011 32: 1034-1037.
- Savic I, Berglund H, Lindstrom P. Brain response to putative pheromones in homosexual men. Proc Natl Acad Sci U S A 2005 102: 7356-61.
- Swaab DF, Gooren LJ, Hofman MA. Brain research, gender and sexual orientation. J Homosexual 1995 28: 283-301.
- Weinrich JD. Is homosexuality natural?. En: Paul W, Weinrich JD, Gonsiorek JC, Hotver ME (Ed.). Homosexuality: social, psychological and biological issues. Beverley Hills. 1982 pp 203.
- Paxinos G y Watson C. The rat brain in stereotaxic coordinates. Academic Press, San Diego. 1998 pp 9-34.
- Dugger BN, Morris JA, Jordan CL, Breedlove SM. Androgen receptors are required for full masculinization of the ventromedial hypothalamus (VMH) in rats. Horm Behav 2007 51: 195-201.
- Zuloaga DG, Puts DA, Jordan CL, Breedlove SM. The role of androgen receptors in the masculinization of brain and behavior: what we've learned from the testicular feminization mutation. Horm Behav 2008 53: 613-26.
- Bloch GJ y Gorski RA. Estrogen/progesterone treatment in adulthood affects the size of several components of the medial preoptic area in the male rat. J Comp Neurol 1988 275: 613-22.
- Bodo C y Rissman EF. Androgen receptor is essential for sexual differentiation of responses to olfactory cues in mice. Eur J Neurosci 2007 25: 2182-90.
- Olsen KL. Induction of male mating behavior in androgen-insensitive (tfm) and Normal (King-Holtzman) male rats: effect of testosterone propionate, estradiol benzoate, and dihydrotestosterone. Horm Behav 1979 13: 66-84.
- Segovia S, Garcia-Falgueras A, Perez-Laso C, Pinos H, Carrillo B, Collado P, Claro F, Guillamon A. The effects of partial and complete masculinization on the sexual differentiation of nuclei that control lordotic behavior in the male rat. Behav Brain Res 2009 196: 261-7.
- Paredes RG. Medial preoptic area/anterior hypothalamus and sexual motivation. Scand J Psychol 2003 44: 203-12.
- Bielsky IF y Young LJ. Oxytocin, vasopressin, and social recognition in mammals. Peptides 2004 25: 1565-74.
- Cooke BM, Tabibnia G, Breedlove SM. A brain sexual dimorphism controlled by adult circulating androgens. Proc Natl Acad Sci U S A, 1999 96: 7538-40.
- Coopersmith C, Gans SE, Rowe DW, Erskine MS. Infusions of lidocaine into the amygdala, but not the preoptic area, block pseudopregnancy in the rat. J Neuroendocrinol 1996 8: 259-66.
- Erskine MS. Mating-induced increases in FOS protein in preoptic area and medial amygdala of cycling female rats. Brain Res Bull 1993 32: 447-51.
- Polston EK y Erskine MS. Excitotoxic lesions of the medial amygdala differentially disrupt prolactin secretory responses in cycling and mated female rats. J Neuroendocrinol 2001 13: 3-21.
- Parada M, Chamas L, Censi S, Coria-Avila G, Pfaus JG. Clitoral stimulation induces conditioned place preference and Fos activation in the rat. Horm Behav 2010 57: 112-8.
- Morris JA, Jordan CL, Dugger BN, Breedlove SM. Partial demasculinization of several brain regions in adult male (XY) rats with a dysfunctional androgen receptor gene. J Comp Neurol 2005 487: 217-26.
- Cooke BM, Breedlove SM, Jordan CL. Both estrogen receptors and androgen receptors contribute to testosterone-induced changes in the morphology of the medial amygdala and sexual arousal in male rats. Horm Behav 2003 43: 336-46.
- Matsumoto A y Arai Y. Sex difference in volume of the ventromedial nucleus of the hypothalamus in the rat. Endocrinol Jpn 1983 30: 277-80.
- McClellan KM, Parker KL, Tobet S. Development of the ventromedial nucleus of the hypothalamus. Front Neuroendocrinol 2006 27: 193-209.
Correspondencia:
*Centro de Investigaciones Cerebrales, Universidad Veracruzana, Av. Luis Castelazo Ayala s/n. Col Industrial Las Animas, Xalapa, Veracruz. Mexico: tel +52(228) 8418900 Ext 16309 email: gcoria@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
