Cómo aprender a comportarse… sexualmente
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Artículo de Revisión
How to learn to behave… sexually
Genaro A. Coria-Avila*1,2, James G. Pfaus4, Tamara Cibrian-Llanderal1, Miriam Tecamachaltzi-Silvarán1, Rodrigo Triana-Del Rio1, Félix Montero-Domínguez1, Pedro Paredes-Ramos1, Leonor López-Meraz1,3, Jorge Manzo1,2, Luis I. García1,2.
1Programa de Neurobiología, Universidad Veracruzana, Xalapa, Ver. México., 2Cuerpo Académico de Neurociencias, 3Cuerpo Académico de Neuroquímica. 4Center for Studies in Behavioral Neurobiology, Concordia University.
Resumen/Abstract
Introducción
Conclusión
Agradecimientos
Bibliografía
Correspondencia
A través del aprendizaje, los individuos pueden incrementar o disminuir de manera eficiente sus respuestas a estímulos internos (como las hormonas) o externos (señales del ambiente) que pueden desencadenar el deseo sexual e indicar quién es una pareja potencial para aparearse. Así mismo, el aprendizaje modifica el valor incentivo de las características de los individuos que se consideran atractivos o no. Esto ocurre principalmente a través de dos mecanismos: el condicionamiento Pavloviano y el Instrumental (operante). En el primero, los individuos aprenden a asociar estímulos neutros con respuestas incondicionadas, los cuales eventualmente se convierten en estímulos condicionados que predicen el evento sexual, y de manera inconsciente guían nuestras preferencias. En el segundo, los individuos aprenden a comportarse y a obtener una respuesta condicionada, lo cual pudiera explicar muchos rituales de cortejo en animales y humanos. En este artículo detallamos los efectos del aprendizaje desde la etapa perinatal hasta la edad adulta, haciendo énfasis en las etapas críticas en las cuales los individuos aprenden a comportarse sexualmente.
Palabras clave: Aprendizaje, Condicionamiento, Pavlov, Skinner, Comportamiento sexual, Recompensa.
Learning can affect many aspects of sexual behavior. Learning may increase or decrease an animal´s sensitivity to respond to internal and external stimuli which trigger its own sexual desire and indicate who is a potencial mate and what a sexual incentive is. This occurs as a result of two learning mechanisms, Pavlovian Conditioning and Instrumental (operant) conditioning. With the former, individuals learn to associate neutral stimuli with unconditioned responses, and therefore the stimuli may become conditioned, with the potential to predict sex and unconsciously may guide our sexual preferences. With Instrumental conditioning, an individual learns how to behave to obtain a certain response, which may help explain how non-sexual behavior may become so if they predict sex. In this paper we discuss the effects of learning in critical periods of life when individuals are more sensitive to become conditioned, and therefore learn to behave sexually.
Key words: learning, conditioning, Pavlov, Skinner, sexual behavior, reward.
El aprendizaje puede afectar muchos aspectos del comportamiento sexual de humanos y animales en general. Esto incluye la expresión y modulación de la excitación sexual, la capacidad de reconocer una pareja potencial, el despliegue de comportamiento de cortejo, y la ejecución de parámetros copulatorios. Además, de manera directa o indirecta también puede afectar la expresión de las preferencias de pareja.1 A través de lo que aprendemos se puede incrementar o disminuir la sensibilidad para responder a estímulos internos (p.e. hormonas, neurotransmisores) y externos (señales), los cuales pueden desencadenar el deseo sexual e indicar quién es una pareja potencial para aparearse, así como también el valor incentivo de las características de los individuos. Esto ocurre principalmente a través de dos mecanismos de aprendizaje, el condicionamiento Pavloviano y el Instrumental (operante).
Influencia del condicionamiento Pavloviano en el comportamiento sexual
El condicionamiento Pavloviano (o Clásico) se refiere a la asociación que se forma entre dos estímulos.2 Por ejemplo, bajo circunstancias normales los estímulos incondicionados (EI) producen respuestas incondicionadas fisiológicas (RI). Las RI son todas aquellas respuestas que no necesitan haber sido aprendidas para llevarse a cabo, y que están presentes en el repertorio natural de un animal. Los EI son estímulos naturales que producen una RI por posibles conexiones neurales innatas. Por el contrario, un estímulo neutral, no desencadenará ninguna RI, pero si es apropiadamente asociado en tiempo con un EI, los animales pueden hacer una asociación predictiva entre el estímulo neutral y el EI, lo cual desencadena una respuesta. Cuando un estímulo neutral es capaz de desencadenar una respuesta que no estaba presente antes del aprendizaje, se le conoce como estímulo condicionado (EC), y la respuesta se conoce como respuesta condicionada (RC). Cuando esto ocurre se cree que el EC produce una representación del EI a un nivel neural.
Hay diversas vías por las cuales el condicionamiento Pavloviano puede afectar el comportamiento sexual, y finalmente la expresión de la preferencia de pareja. En primer lugar, una pareja potencial puede ser vista como un conjunto de estímulos; algunos de ellos son EI, que desencadenan RI, pero muchos otros no lo son.3 Los estímulos que originalmente son neutrales o inefectivos pueden condicionarse si son asociados en contingencia con un EI. Además, ciertos ambientes o contextos pueden ser condicionados a EI sexualmente relevantes, y por lo tanto ser capaces de evocar RC. Esta asociación en la que ocurre el condicionamiento al sexo parece ocurrir durante varios periodos críticos del desarrollo: durante la fase temprana posnatal, durante la infancia justo antes de la madurez sexual, y otro después de la pubertad, durante los primeros encuentros sexuales.
El periodo posnatal temprano (improntas)
Algunos estímulos que son percibidos durante periodos críticos en la edad temprana, se asocian a través del condicionamiento Pavloviano con las recompensas innatas (cuidado maternal, ingesta de nutrientes, etc.). Este tipo de condicionamiento se denomina impronta y puede afectar fuertemente las preferencias sexuales en la edad adulta.4 Esta es una forma especial de condicionamiento en la cual el cerebro es especialmente sensible durante el periodo crítico para hacer la asociación. Las improntas usualmente ocurren hacia las características de los padres y la propia especie, y son consideradas como el primer fenómeno involucrado en el apareamiento asortativo, en las cuales los animales eligen aparearse selectivamente con miembros de su propia cepa y especie, y muestran menos preferencia hacia cepas diferentes (evitan especies distintas que son genéticamente muy diferentes). Se cree que el apareamiento asortativo mantiene la homocigosidad en una cepa, y por lo tanto, evita que las características de una cepa se desvanezcan con el apareamiento entre animales diferentes.
En los humanos, el apareamiento asortativo se observa en las preferencias de pareja por características fenotípicas (p.e. preferencia entre razas, tipos de cara), sociales (p.e. cultura, creencias religiosas), y características de personalidad (p.e. introversión, extroversión) que de alguna forma sean parecidas a las de uno mismo.5-7
Existe evidencia indicando que machos de diferentes especies pueden desarrollar improntas por parejas que tienen características asociadas con la hembra que los crió (aunque no sea la madre) o características asociadas al periodo de amamantamiento per se. En un estudio, por ejemplo, ratas recién nacidas fueron amamantadas por su madre biológica, a la cual se le aplicó un olor neutral (limón) en el abdomen. Las crías fueron destetadas a los 21 días y nunca más fueron expuestas al olor. Cuando las crías cumplieron 100 días de edad se colocaron en una arena de cópula con dos hembras sexualmente receptivas, una con olor a limón y la otra sin olor. Los resultados mostraron que los machos que en la infancia fueron expuestos a la esencia de limón desplegaron latencias de eyaculación más cortas con la hembra que olía a limón, en relación a la latencia con la hembra sin olor.8 Ese experimento fue uno de los primeros en mostrar que olores neutrales que se perciben durante periodos tempranos de vida pueden incrementar la excitación sexual en encuentros sexuales futuros. En este caso, se observó más excitación sexual inferida de un menor tiempo para eyacular con la hembra que tenía olor a limón. Otros experimentos con improntas en ratas macho se han enfocado más en la preferencia de pareja, la cual puede depender de los estímulos recompensantes que las madres dan a las camadas durante periodos críticos de vida. Por ejemplo, el efecto positivo del acicalamiento materno a las crías durante los primeros 10 días de edad, puede condicionarse a estímulos olfativos. En un estudio, ratas macho recién nacidas se retiraron de la madre durante 15 minutos cada día. Durante ese tiempo los machos de un grupo fueron expuestos a aserrín con olor a limón en una caja y recibieron estimulación táctil en todo su cuerpo con un pincel a modo de imitar el acicalamiento materno. Los machos en el grupo control fueron expuestos a aserrín sin olor. Ambos grupos se destetaron a los 21 días de edad y no volvieron a ser expuestos al olor. Después de dos meses los machos ya adultos se colocaron en una arena de campo abierto y se les permitió copular con dos hembras al mismo tiempo, una impregnada con olor de limón y la otra sin olor extra. Los resultados mostraron que más del 75% de los machos del grupo experimental (limón) desplegaron una preferencia eyaculatoria por la hembra con olor a limón, mientras que el grupo control no mostró preferencia de pareja.9 Ese estudio mostró que los olores neutrales asociados con estímulos recompensantes similares al cuidado materno durante periodos tempranos de vida pueden ser aprendidos y consecuentemente dirigir la preferencia de pareja en encuentros sexuales futuros. En conjunto, con los estudios de Fillion y Blass,8 estos hallazgos indican que los estímulos olfativos percibidos en periodos críticos tempranos de vida pueden producir improntas y por lo tanto incrementar la excitación sexual y la motivación para dirigir las preferencias de pareja, incluso en animales sin experiencia sexual previa.
Contrario a los datos anteriores, existen estudios en los cuales pareciera que las improntas no afectan las preferencias de pareja en la edad adulta. Específicamente, el trabajo de Moore y colaboradores,10 mostró que ratas criadas por madres impregnadas de olor a limón no discriminaban entre hembras con olor o sin olor al momento de aproximarse por primera vez en encuentros sexuales al ser adultos. Asimismo, no encontraron diferencias en el comportamiento sexual en general durante cópulas sucesivas, incluyendo las latencias de eyaculación. Cabe mencionar que en experimentos de dos hembras y un macho, Moore y colaboradores10 mostraron que machos criados por hembras olor a limón ejecutaban su primera monta más rápido hacia hembras con olor a limón, pero machos criados por hembras sin olor también mostraban dicha latencia hacia hembras olor a limón.10 Hay muchas diferencias metodológicas que pudieron haber contribuido a los hallazgos distintos. Por ejemplo, Menard y colaboradores9 analizaron la proporción de machos que preferían eyacular con la hembra como una evidencia de preferencia condicionada por improntas, mientras que Fillion y Blass8 y Moore y colaboradores10 usaron medidas de frecuencia y latencia del comportamiento sexual como variables dependientes. Es posible que las preferencias condicionadas de eyaculación inducidas por improntas olfativas en los machos, sean principalmente observadas como una elección en la estrategia de apareamiento y no con diferencias grandes en la frecuencia y latencia de comportamientos sexuales. Esto pudiera indicar que en ratas polígamas se desarrollaría la preferencia eyaculatoria como resultado de improntas, aunque el comportamiento sexual en general no sea dirigido con exclusividad hacia una pareja preferida.
Otros estímulos diferentes a los olores también pueden ser improntados y dirigir las preferencias de pareja. Burley11 mostró que las aves pueden ser imprentadas por señales visuales. En su estudio, pinzones cebra criados por padres que portaban crestas blancas con una raya negra vertical, desarrollaron preferencia sexual hacia aves del sexo opuesto que portaban este tipo de cresta; mientras que aves que fueron criadas en otra colonia por padres que tenían una raya negra horizontal desarrollaron preferencia hacia parejas con este tipo de cresta.11 Algunos experimentos han mostrado que los efectos de las improntas son tan poderosos que pueden inducir preferencias sexuales hacia diferentes especies. Por ejemplo, en un estudio ovejas y cabras machos fueron criados por hembras nodrizas de especies opuestas. Al llegar a la edad adulta, las ovejas mostraron preferencia sexual por cabras, mientras que las cabras prefirieron a las ovejas.12 En conjunto, estos estudios indican que los animales pueden aprender a preferir estímulos que fueron percibidos durante periodos críticos en la edad temprana. En algunos casos esas preferencias pueden ser expresadas como comportamiento de cortejo únicamente, sin embargo, en otros casos se pueden expresar en los comportamientos copulatorios (p.e. preferencia eyaculatoria en ratas).
Se podría argumentar que la preferencia constante por características familiares o conocidas no debería ser preferida, ya que provocaría cruza entre animales genéticamente relacionados y por lo tanto endogamia. Se sabe que la endogamia constante puede resultar en la expresión fenotípica de genotipos indeseables, pasados a través de genes recesivos de una generación a otra sin ser expresados hasta que dos padres con genotipo similar se reproducen. De acuerdo a este argumento, las improntas no deberían ser la mejor estrategia para reproducirse y los animales deberían buscar parejas genéticamente diferentes con el fin de evitar la endogamia e incrementar la diversidad.
Estudios sobre las estrategias reproductivas de ratones indican que el apareamiento se evita con individuos que tienen un complejo mayor de histocompatibilidad (CMH) similar. Los genes responsables del CMH producen moléculas que ayudan al sistema inmune a distinguir organismos que son diferentes y que pudieran potencialmente causar enfermedad. Un CMH más heterogéneo tendrá un rango más amplio para reconocer lo que es familiar de lo que es diferente. Consecuentemente, entre más diferentes son los genes de los dos padres, más heterogéneo será el CMH de las crías, lo cual resulta en un sistema inmune más capaz. Se ha argumentado que los animales deberían haber evolucionado sistemas neurales que les permiten reconocer a parejas potenciales con un CMH diferente. Es decir, que la preferencia de pareja debería dirigirse hacia individuos no familiares para evitar genotipos indeseables. Existe evidencia indicando que la tendencia natural de los ratones para aparearse con una pareja de diferente CMH no es innata; ya que la preferencia sexual puede revertirse hacia parejas con el mismo CMH a través de las improntas. En un estudio, ratones fueron criados por madres nodrizas de una cepa genéticamente diferente a la de ellos. Al ser adultos, los ratones desplegaron preferencia copulatoria por hembras de su propia cepa (similar a ellos),13 lo cual sugiere que los parientes no fueron reconocidos como familia y por lo tanto fueron preferidos como pareja. Aprender a reconocer olores familiares pudiera indicar a un animal la identidad de su familia, y por lo tanto lo ayudaría a evitar el apareamiento con ellos. Penn y Potts14 mostraron que los ratones pueden reconocer el CMH de otros individuos a través de señales olfativas (producidas de manera única por el CMH de cada individuo) y que ese reconocimiento es aprendido a través de las improntas en periodos tempranos de vida. En su estudio, un grupo de ratonas fue criado por nodrizas que eran genéticamente diferentes (diferente CMH). Cuando las hembras se hicieron adultas se les permitió elegir entre machos con un CMH similar al de ellas, o similar al de las madres nodrizas. Muy parecido a los hallazgos de Yamazaki y colaboradores,13 Penn y Potts,14 mostraron que las hembras evitaron el apareamiento con machos que tenían un CMH similar al de las madres nodrizas, lo cual apoya la idea de que las improntas familiares dependientes del CMH son un mecanismo para evitar la endogamia.14
Bateson4 sugirió que las improntas sexuales facilitan el apareamiento con individuos genéticamente diferentes y evita que los animales tengan endogamia. Su planteamiento fue basado en una serie de experimentos de preferencia de pareja con codornices japonesas. Él mostró que los machos preferían a hembras cuyo color de plumaje era ligeramente diferente al de la madre por la que fueron criados, y que hembras con el mismo color que la madre no eran preferidas. Esto ha llevado a pensar que como resultado de las improntas, la elección de pareja se dirige hacia individuos que tienen características ligeramente diferentes a los familiares, lo cual se basaría en las memorias familiares consolidadas durante periodos críticos de edad temprana. De acuerdo a esto, las improntas facilitan las preferencias de pareja hacia un individuo que es ligeramente diferente para garantizar un vigor híbrido, pero al mismo tiempo garantiza el apareamiento con individuos cercanos, probablemente adaptados también a las mismas circunstancias ambientales. De cualquier forma, las causas y consecuencias de las improntas sexuales no están completamente entendidas y pudieran variar de una especie a otra. Aún se desconoce cuál es la neurobiología y neuroquímica de los comportamientos producidos por las improntas, o si olores artificiales son improntados del mismo modo que olores o características naturales (p.e. aquellos que resultan del CMH, o señales visuales).
Periodo infantil prepubertad (desarrollo de habilidades motrices y sociales)
En esta etapa la motivación innata y adquirida (a través de improntas) sirve para facilitar encuentros y experiencias en las que el animal desarrolla habilidades basadas en el aprendizaje y aprenderá a identificar y discriminar entre conductas sociales que indican amenaza y las que indican interacción social. Por ejemplo, el juego es la conducta más abundante en los animales infantes o pre púberes. El alto valor recompensante del juego incita a que los animales lo realicen con frecuencia y que de este modo adquieran habilidades motrices, sociales y cognitivas. Se piensa que muchas de las conductas estereotipadas que un animal realiza durante la cópula o el cortejo provienen de las que realizaba al jugar en la etapa juvenil. Recientemente en nuestro laboratorio encontramos que si una rata hembra infantil (31- 42 días de edad) juega con otra que porta un olor inicialmente neutro (limón o almendra) desarrolla una preferencia por copular con machos que porten el mismo olor en la edad adulta. Incluso se ha visto que cuando la rata copula con un macho que asocia con su compañero de juego infantil, no solo copula con más frecuencia sino que realiza un mayor número de conductas apetitivas tales como solicitaciones, y brincos y carreras cortas, las cuales se piensa son indicadores de la motivación sexual del animal. Esto sugiere que la recompensa que se obtiene durante el juego en una rata infantil no solo favorece su desarrollo físico sino que instruye al animal a comportarse sexualmente en la etapa adulta y a elegir una pareja con la cual aparearse.
Periodo pospubertad (primeras experiencias sexuales)
El periodo posterior a la pubertad es más flexible en tiempo que el periodo crítico posnatal, y típicamente involucra una cascada de experiencias que impulsan al animal hacia la cópula y la recompensa sexual. En esta fase es muy importante la activación que las hormonas hacen sobre las regiones cerebrales que modularán el comportamiento sexual; pero también son importantes los estímulos percibidos por los animales durante sus primeras experiencias sexuales. Hay evidencia que indica que los animales pueden desarrollar preferencia por lugares o parejas que sirven como señales predictivas de recompensa sexual:
Preferencia de lugar condicionado: Las ratas macho pueden desarrollar preferencia de lugar condicionado (PLC) por uno de los lados físicamente distintos de una arena PLC al asociarlos con eyaculación, pero no si está asociado únicamente con intromisiones, lo cual indica que la eyaculación crea un estado de recompensa que puede ser asociado con estímulos ambientales que predicen la recompensa.15 En esas circunstancias el lado distintivo de la arena PLC (EC) gana valor incentivo a través de una asociación Pavloviana con el estado de recompensa inducido por la eyaculación (EI). El desarrollo de la PLC producida por eyaculación puede ser bloqueada por la inyección de un antagonista de los receptores para opioides como la naloxona, pero no por un antagonista de dopamina como el pimozide.15, 16 Esto indica que el incremento de la actividad de opioides endógenos después de la eyaculación es el mediador de la recompensa. Las infusiones intracerebrales bilaterales del antagonista de opioides metilnaloxonium en el área preóptica media (APOm) de ratas macho también inhibe la PLC asociada por eyaculación,17 lo cual sugiere que la liberación de opioides en esta región es muy importante. Por el contrario, aunque las concentraciones de dopamina incrementan en el APOm y áreas límbicas con las montas y las intromisiones, también disminuyen drásticamente después de la eyaculación.18 Esto hace poco probable que la liberación de dopamina contribuya al estado de recompensa inducido por eyaculación.
Las hembras también desarrollan PLC si asocian un lado distintivo de la arena PLC con la posibilidad de controlar el contacto sexual con un macho.19 El control de los contactos sexuales permite que ella regule el tiempo que pasa con el macho, así como la distribución entre montas e intromisiones.20-22 El control sobre las intromisiones significa controlar la estimulación vagino-cervical (EVC) recibida, lo cual facilita la preñez al activar sistemas neuroendocrinos como los que incrementan la prolactina aproximadamente cada 12 hrs.23-25
En la naturaleza, el control de los contactos sexuales ocurre cuando la hembra despliega solicitaciones sexuales hacia el macho y luego corre, es perseguida y alcanzada a su intervalo preferido. En el laboratorio “el control” de los contactos sexuales ocurre en arenas divididas por una barrera con hoyos en su base, por los cuales solo ella puede pasar por ser de menor tamaño que el macho. La hembra puede correr de un lado a otro, controlando así las entradas a donde está el macho sexualmente experto. Por el contrario, la cópula no controlada ocurre en las mismas arenas pero sin la barrera de división. Para las hembras, la cópula controlada es recompensante y formarán preferencia por compartimentos de una arena PLC asociados con los efectos de la cópula controlada en relación al efecto de una cópula no controlada.19 De hecho, la EVC aplicada artificialmente con un émbolo de vidrio en patrones distribuidos, imitando la cópula controlada, produce PLC. Por el contrario, la EVC no distribuida, de manera intensa, no produce preferencia condicionada de lugar.26 Por lo tanto, se asume que el estado asociado con la EVC distribuida es un EI que facilita el desarrollo de una PLC. Al igual que con los machos, la expresión de PLC asociado a la cópula controlada es bloqueada con la inyección de naloxona, pero no con el antagonista de dopamina flupentixol durante el entrenamiento.27,28 La PLC y el comportamiento condicionado de aproximación son consistentes con la idea de que los animales siempre buscan y prefieren el contacto de estímulos condicionados que han sido asociados con recompensa (ver revisión de 29-31). Esto indica una estrategia de búsqueda basada en las experiencias pasadas, de tal forma que los animales tengan mayor probabilidad de entrar en contacto con estímulos que inducen un estado afectivo positivo, y el cual, si es encontrado en una pareja, puede representar un incremento en la adecuación reproductiva.32
Prerencia de pareja condicionada: Estímulos olfativos neutrales asociados con cópula hasta la eyaculación pueden convertirse en EC y alterar las respuestas neuroendócrinas y conductuales. Por ejemplo, Graham y Desjardins33 mostraron que en ratas macho, los niveles de hormona luteinizante y testosterona se incrementaban después de exponerlos a un olor condicionado (p.e. esencia de menta, Gaulteria spp) previamente asociada con cópula. El incremento hormonal fue parecido al que ocurrió cuando los machos fueron expuestos a olores vaginales de hembras en estro, lo cual sugiere que la asociación entre el olor y la recompensa sexual produce un condicionamiento Pavloviano, en el cual el olor se convierte en un EC con fuerza suficiente para desencadenar respuestas endocrinas condicionadas que preparan al animal para comportarse sexualmente.
Los olores condicionados a cópula también pueden facilitar la preferencia hacia una pareja. Por ejemplo, Kippin y Pfaus3 entrenaron un grupo de machos que denominaron Olor-asociado, al que enseñaron que el olor a almendra se presentaba siempre sobre la espalda y cuello de una hembra sexualmente receptiva, con la cual copulaban y eyaculaban. Otro grupo denominado Olor-no asociado tenía acceso a hembras receptivas que no portaban el olor. En una prueba final en una arena de campo abierto, los machos tuvieron acceso a dos hembras sexualmente receptivas, una de las cuales tenía olor a almendra y la otra no. Los machos del grupo Olor-asociado desplegaron una preferencia de pareja condicionada, en la cual las hembras con olor eran preferidas para recibir la primera eyaculación de los machos. Estudios siguientes revelaron que el aprendizaje de esta preferencia eyaculatoria requería del periodo post-eyaculatorio y de su periodo de refracción34 y que los machos se hacen más selectivos cuando la eyaculación está más cercana.35 Por lo tanto, las ratas pudieran aprender a tener preferencias de pareja que equivaldrían a un vínculo afectivo rudimentario a través de procedimientos Pavlovianos “simples” que facilitan la asociación de estímulos olfativos neutrales a la recompensa sexual. Tales hallazgos apoyan la idea de que lo que ocurre en el periodo post-eyaculatorio es suficiente de producir preferencias condicionadas, muy similar a lo que ocurre en la PLC que se desarrolla después de la eyaculación.15
Se ha utilizado la inmunoreactividad a la proteína Fos (Fos-IR) para estudiar las áreas que se activan con el olor condicionado, en relación a las áreas activadas por olores naturales de hembras en estro, los cuales normalmente producen motivación sexual en machos.36 En ese estudio, Kippin y colaboradores36 mostraron que olores de estro inducen actividad neural del núcleo accumbens (NAcc), parte medial del núcleo base de la estría terminal (BNSTm), APOm, hipotálamo ventromedial (HVM) y área ventral tegmental (AVT). El olor condicionado, sin embargo, induce actividad en la corteza piriforme (Cpir), porción anterior del hipotálamo lateral (HLa), y la amígdala basolateral (ABL). Consecuentemente, los autores concluyeron que las feromonas y los olores condicionados activan vías neurales similares (p.e. NAcc), pero también vías independientes en el sistema límbico e hipotálamo.
Influencia del condicionamiento instrumental en el comportamiento sexual
El aprendizaje Instrumental también es conocido como Operante. Este describe la contingencia entre respuesta-reforzador en la cual un animal aprende a “operar” en su ambiente.37, 38 El aprendizaje Instrumental ocurre cuando un animal adapta sus respuestas conductuales bajo ciertos esquemas de reforzamiento,39 circunstancias que han sido asociadas con la obtención de un reforzador (positivo si produce recompensa o negativo si remueve algo aversivo). Específicamente, cuando un individuo tiene algún comportamiento y éste es seguido de una recompensa, la frecuencia de dicho comportamiento (respuesta) incrementa y su latencia disminuye, lo cual se conoce como reforzamiento positivo. De manera similar, si el comportamiento es seguido de la eliminación de algo aversivo el comportamiento incrementará en frecuencia. Por el contrario, cuando un animal tiene algún comportamiento y éste es seguido de un castigo, la respuesta disminuirá en frecuencia y su latencia incrementa. Las respuestas que disminuyen la probabilidad de recibir un castigo son más probables de ser adoptadas a través del reforzamiento negativo. Por otro lado, las respuestas que eliminan la posibilidad del reforzamiento positivo (time-out periods) son menos probables de ser adoptadas por los animales.
Los animales con experiencia sexual pueden aprender una variedad de tareas que estén asociadas con el objetivo de tener acceso a una pareja, presuntamente por la asociación que hacen con la recompensa sexual.1 Se cree que la capacidad de experimentar recompensa durante el comportamiento sexual, evolucionó para facilitar la probabilidad de cópula. Por lo tanto, desde el punto de vista de la psicología, el sexo debe tener propiedades recompensantes si los estímulos que predicen la cópula incrementan la probabilidad de respuestas instrumentales apetitivas que facilitan la aproximación entre parejas potenciales. La cantidad de respuestas que un animal está dispuesto a llevar a cabo para obtener acceso a otro individuo pueden ser usadas para calcular el grado de motivación que induce una preferencia hacia un individuo en particular. Tales respuestas pueden indicar niveles de motivación sexual desencadenadas por las señales presentes en la pareja, aunque también pueden ser usadas para inferir preferencia de pareja si los animales tienen la opción de elegir entre varios individuos para copular al mismo tiempo.
Las ratas macho, por ejemplo, pueden aprender fácilmente a presionar una palanca para ganar acceso a hembras receptivas,40-42 y las hembras pueden también aprender a presionar una palanca para tener acceso a un macho sexualmente activo.40, 43, 44 Comúnmente, estos estudios involucran a una rata aprendiendo a presionar una palanca en una caja de Skinner, en la cual después de un cierto número de respuestas sobre la palanca, una pareja caerá sobre la caja.45 Otras especies también pueden aprender a trabajar por acceso a una pareja. Estas incluyen monos Rhesus presionando palancas46, 47 y pichones picoteando señales clave.48 En ratas, el aprendizaje Operante también incluye escalar sobre un obstáculo para tener acceso a una hembra receptiva,49 cavar a través de arena o cruzar rejas electrificadas,50 y girar en una rueda,51 para que con cierto número de giros se obtenga el acceso a la pareja.
Debido a que para copular primero se debe tener acceso a la pareja y con ello a experimentar recompensa sexual, las tareas Operantes funcionan también como comportamientos preparatorios que los animales llevan a cabo para obtener dichas recompensas.18, 22 En la naturaleza (y un poco en el laboratorio), los machos deben perseguir a las hembras después de cada solicitación por parte de ellas para lograr copular, y al hacer eso los machos parecen detectar mayor valor incentivo en las hembras, lo cual es un paso previo a la experiencia de la recompensa sexual. Por ejemplo, las ratas hembra tratadas sistemáticamente con el antagonista de dopamina haloperidol o flupentixol, dejan de ser proceptivas y no muestran solicitaciones, pero muestran un incremento en sus respuestas receptivas, es decir, en los coeficientes de lordosis (arqueamiento de la espalda para recibir el pene del macho).52, 53 Los machos que copulan con ellas no muestran gran interés, ni un adecuado comportamiento sexual (a pesar del incremento de lordosis) y típicamente tienen latencias más largas de intromisión y eyaculación, lo cual indica una disminución de la excitación sexual. Ciertamente, los machos castrados o inyectados en NAcc y estriado con un fármaco (6-hidroxidopamina) para conseguir que disminuya la cantidad de dopamina mesolímbica sin afectar locomoción, ni siquiera intentarán copular con esas hembras, pero sí copularán con hembras que muestran interés y solicitaciones.52, 54 Al igual que el comportamiento de persecución para los machos, el control de la cópula es un paso necesario para experimentar recompensa sexual en las hembras, ya que al hacer esto, ellas reciben el patrón de intromisiones que facilita recompensa y reproducción. En las arenas de cópula controlada que tienen una división media, las hembras deben cruzar a través de los hoyos para obtener las intromisiones y las eyaculaciones. Por lo tanto, controlar la cópula en dichas arenas es considerado un comportamiento Operante y también un comportamiento preparatorio para la cópula. Las conductas con las que una rata hembra invita a un macho a copular son llamadas conductas proceptivas. Se ha visto que cuando una rata hembra copula en condiciones poco recompensantes, como cuando no controla la copula, realiza un mayor número de conductas proceptivas. Lo cual sugiere que las conductas operantes son también un medio para modular el grado de recompensa que se obtiene durante la copula.
El papel de la recompensa sexual en las preferencias aprendidas
En machos, la recompensa sexual inducida por eyaculación funciona como un EI indispensable que consolida la preferencia posterior por estímulos que la predicen. Los machos sexualmente inexpertos expuestos a dos o más hembras muestran comportamientos apetitivos hacia todas ellas de manera casi azarosa (visitas, olfaciones, persecuciones por igual). Sin embargo, cuando logran ejecutar una intromisión los patrones de comportamiento se comienzan a observar más estables hacia dicha hembra. Sin embargo, es hasta la eyaculación cuando la preferencia se “cristaliza o consolida” de manera condicionada, de tal forma que en eventos futuros las intromisiones y las eyaculaciones serán más dirigidas hacia la pareja preferida.
Se ha planteado la hipótesis de que la preferencia condicionada de eyaculación reportada en las ratas pudiera ser una respuesta rudimentaria del comportamiento monógamo observado en otras especies de roedores.1 Por ejemplo, el apareamiento facilita los vínculos de pareja en ratones de pradera,55 lo cual ha servido para plantear la idea de que los vínculos afectivos que aparecen después de la cópula son debidos a la recompensa sexual experimentada,56 Los vínculos afectivos son observados cuando un ratón de especie monógama tiene la opción de dos parejas, una conocida con quien la cópula ocurrió previamente y otra nueva, a quien nunca antes ha visto. Un roedor vinculado a otro normalmente lo elige por encima de otro, pasa más tiempo con él y se reproduce con él. Algunos reportes indican que este comportamiento puede ser de por vida, aunque en ocasiones también se observa que animales vinculados pueden tener cópulas extra pareja.57 Es posible que un roedor vinculado a otro permanece monógamo por el reforzamiento positivo constante de la pareja durante el contacto social y las cópulas recurrentes. El estudio de Kippin y colaboradores36 indican que feromonas y olores condicionados asociados con eyaculación incrementan la expresión de Fos en algunas zonas exclusivas para responder a feromonas o a olores condicionados, pero también indica que hay otras zonas mesolímbicas e hipotalámicas que responden similar a feromonas u olores condicionados. De acuerdo a esos hallazgos, los roedores monógamos pudieran ser atraídos inicialmente por los efectos de las feromonas sobre la motivación, pero esta preferencia será reforzada por las cópulas continuas y la recompensa sexual. Como resultado de esto, las características específicas de la pareja (i.e. su olor particular) pudiera convertirse en preferido de manera condicionada y ser reforzado por la estimulación social y el apareamiento.
De acuerdo a lo anterior podemos decir que hay patrones conductuales sexuales “innatos” (Figura 1) que requieren de circuitos neurales formados perinatalmente y las hormonas sexuales que los activen en los periodos de pubertad. Es decir, todos los elementos del comportamiento sexual (excepto la eyaculación) ya existen desde antes de la pubertad pero se observan de manera aislada y fuera de contexto sexual (i.e. erecciones de recién nacidos, montas durante el juego, persecuciones de una pareja). La presencia de estos “elementos del comportamiento sexual” ocurre de manera discontinua, casi como los fonemas en el lenguaje de un bebé. Es decir, los bebés pueden hacer sonidos de vocales y consonantes, pero requerirán de un periodo crítico para asociarlas juntas en forma de palabras, y con el crecimiento y experiencia (junto con la maduración cerebral) se logrará formar sentencias y palabras para eventualmente darles un significado. Esto mismo pudiera ocurrir con algunos elementos del comportamiento sexual. Las ratas muestran patrones motores similares a los sexuales durante el juego pero es hasta la pubertad en que comienzan a asociarse en conjunto. Sin embargo, aún necesitan esa primera intromisión (con la respectiva estimulación peneana, de nervios pélvico y pudendo) para “completar” el conjunto de estimulaciones, las cuales se cristalizan en una preferencia o tendencia a preferir una pareja cuando ocurre la eyaculación.
Estímulos no sexuales que modulan nuestro aprendizaje sexual
Existen estímulos diferentes a los experimentados en la cópula que pueden facilitar la formación de preferencias de pareja o vínculos afectivos. Por ejemplo, en los machos monógamos, largos periodos de nado forzado pueden ser estresantes. Si los roedores se dejan nadar hasta el cansancio y posteriormente puestos a cohabitar con una pareja desconocida por unas seis horas (lo cual normalmente no es un tiempo suficiente para inducir vínculos de pareja en roedores), entonces el roedor estresado desarrolla un vínculo por la pareja con la que cohabitó.58, 59 Se creé que este comportamiento es facilitado por las hormonas que median la respuesta al estrés (p.e. los corticosteroides), porque las inyecciones de corticosterona en machos facilitan la formación de vínculos de pareja.59
Otros datos ya han indicado que hay muchos otros estímulos naturales que pueden facilitar el desarrollo de preferencias de pareja. Estas se pueden desarrollar lentamente como una consecuencia de la cohabitación, pero estímulos excitantes o activadores como el estrés y la recompensa pueden acelerar su formación. Se creé que la estimulación social en animales vinculados es recompensante porque reduce el estrés y la ansiedad. En especies sociales como los roedores monógamos, las situaciones estresantes podrían facilitar el contacto porque los vínculos sociales son una manera de contrarrestar el estrés y la ansiedad. Aún se desconoce si las preferencias de pareja y los vínculos afectivos que se desarrollan lentamente por cohabitación, o rápidamente por estrés o recompensa, tienen bases neurales similares. Es probable que las preferencias que se desarrollan rápido sean el resultado de la atención dirigida y el aprendizaje hacia estímulos que representan una ventaja para la reproducción y la sobrevivencia. Por lo tanto, estímulos que predicen recompensa sexual inducirán respuestas que preparan al animal para obtenerla.
Algunas especies desarrollan comportamientos compulsivos o son capaces de ignorar peligros cuando están en búsqueda de su pareja o una droga. A pesar de que el efecto de las drogas es más severo y dura más, se ha argumentado que la recompensa durante el sexo o la toma de drogas puede jugar un papel primordial en el proceso que conlleva a la formación de vínculos o adicciones. De hecho, se ha argumentado que los vínculos sociales pueden ser un “desorden adictivo” dadas las similitudes en función a los sistemas neurales que los subyacen.60
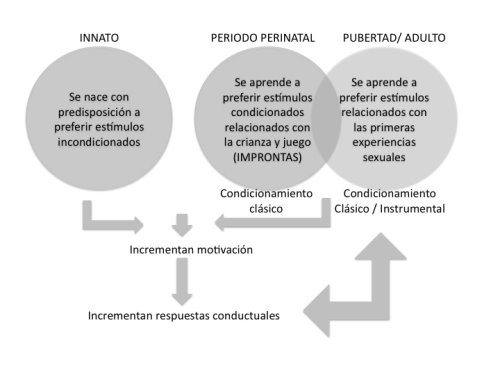
Figura 1. Sistemas de aprendizaje del comportamiento sexual. Las preferencias innatas aparecen sin necesidad de aprenderse como consecuencia de sistemas neurales presentes en cada especie y que permiten la preferencia por estímulos incondicionados que producen respuestas fisiológicas (olores del sexo opuesto). El aprendizaje ocurre a través del condicionamiento clásico e instrumental en periodos tempranos de vida (improntas) y periodos tardíos (experiencias sexuales a lo largo de la vida). Los estímulos condicionados (aprendidos) producen respuestas condicionadas que incrementan la motivación sexual o por la búsqueda y ejecución copulatoria, las cuales se consideran respuestas condicionadas. Las respuestas condicionadas pueden perpetuar el condicionamiento al volver a experimentar recompensa (o ausencia de aversión) en presencia de los estímulos condicionados.
Como se mencionó anteriormente, la recompensa sexual facilita la formación de preferencias de pareja en varias especies de roedores y potencialmente en humanos. En las especies monógamas como los ratones de pradera, la recompensa sexual es necesaria para inducir preferencias de larga duración y selectivas por una pareja en particular. En los roedores polígamos como las ratas, los olores condicionados dirigen a los machos a eyacular de manera preferencial con hembras que tienen la “señal” olfativa, esto a pesar de tener una preferencia innata por hembras nuevas o diferentes inferido por la existencia del efecto Coolidge.61 Por lo tanto, debemos considerar la idea de que la experiencia de cada individuo en relación a la recompensa sexual (y no-sexual temprana) puede “escribir” nuevos mapas cerebrales sobre lo que es presuntamente preferido de manera innata, como los apareamientos asortativos o ciertas estrategias de apareamiento (monogamia y poligamia). Esto a través del condicionamiento Pavloviano y Operante. De hecho, lo innato es aprender del ambiente de tal forma que se maximice la recompensa y se minimice lo aversivo, haciendo a las llamadas “causas próximas” (i.e. placer) un predictor más poderoso de los comportamientos sociales y la elección, comparado con las llamadas “causas últimas” (i.e. adecuación reproductiva o genética). En este sentido, encontrar regiones cerebrales comunes y sistemas neuroquímicos y endocrinos activados en especies monógamas y polígamas durante las primeras experiencias con recompensa sexual, debería tener un impacto profundo en nuestro comportamiento de la diversidad en la elección de pareja y estrategias de apareamiento.
Promep 103.5/08/3238 NPTC a GAC-A.
- Pfaus JG, Kippin TE, Centeno S: Conditioning and sexual behavior: a review. Horm Behav 2001 40(2):291-321.
- Pavlov I: Conditioned reflexes. Oxford: University Press; 1927.
- Kippin TE, Pfaus JG: The development of olfactory conditioned ejaculatory preferences in the male rat. I. Nature of the unconditioned stimulus. Physiol Behav 2001 73(4):457-469.
- Batenson P: Early experience and sexual preference. In Biological determinants of sexual behavior. Edited by Hutchinson JB: Chichester John Wiley & Sons; 1978 29-53.
- Luo S, Klohnen EC: Assortative mating and marital quality in newlyweds: a couple-centered approach. J Pers Soc Psychol 2005 88(2):304-326.
- Malina RM, Selby HA, Buschang PH, Aronson WL, Little BB: Assortative mating for phenotypic characteristics in a Zapotec community in Oaxaca, Mexico. J Biosoc Sci 1983 15(3):273-280.
- Salces I, Rebato E, Susanne C: Evidence of phenotypic and social assortative mating for anthropometric and physiological traits in couples from the Basque country (Spain). J Biosoc Sci 2004 36(2):235-250.
- Fillion TJ, Blass EM: Infantile experience with suckling odors determines adult sexual behavior in male rats. Science 1986 231(4739):729-731.
- Menard S, Gelez H, Coria-Avila GA, Jacubovich M, Pfaus JG: Impact of neonatal olfactory condit ioning on later sexual partner preference in the male rat. In Annual meeting of the Society for Behavioral Neuroendocrinology: 2006 Pittsburgh, PA. SBN
- Moore CL, Jordan L, Wong L: Early olfactory experience, novelty, and choice of sexual partner by male rats. Physiol Behav 1996 60(5):1361-1367.
- Burley NT: An eye for detail: selective sexual imprinting in zebra finches. Evolution 2006 60(5):1076-1085.
- Kendrick KM, Hinton MR, Atkins K, Haupt MA, Skinner JD: Mothers determine sexual preferences. Nature 1998 395(6699):229-230.
- Yamazaki K, Beauchamp GK, Kupniewski D, Bard J, Thomas L, Boyse EA: Familial imprinting determines H-2 selective mating preferences. Science 1988 240(4857):1331-1332.
- Penn D, Potts W: MHC-disassortative mating preferences reversed by cross-fostering. Proc Biol Sci 1998 265(1403):1299-1306.
- Agmo A, Berenfeld R: Reinforcing properties of ejaculation in the male rat: role of opioids and dopamine. Behav Neurosci 1990 104(1):177-182.
- Miller RL, Baum MJ: Naloxone inhibits mating and conditioned place preference for an estrous female in male rats soon after castration. Pharmacol Biochem Behav 1987 26(4):781-789.
- Agmo A, Gomez M: Sexual reinforcement is blocked by infusion of naloxone into the medial preoptic area. Behav Neurosci 1993 107(5):812-818.
- Blackburn JR, Pfaus JG, Phillips AG: Dopamine functions in appetitive and defensive behaviours. Prog Neurobiol 1992 39(3):247-279.
- Paredes RG, Alonso A: Sexual behavior regulated (paced) by the female induces conditioned place preference. Behav Neurosci 1997 111(1):123-128.
- Erskine MS: Solicitation behavior in the estrous female rat: a review. Horm Behav 1989 23(4):473-502.
- Gilman DP, Hitt JC: Effects of gonadal hormones on pacing of sexual contacts by female rats. Behav Biol 1978 24(1):77-87.
- Pfaus JG, Smith WJ, Coopersmith CB: Appetitive and consummatory sexual behaviors of female rats in bilevel chambers. I. A correlational and factor analysis and the effects of ovarian hormones. Horm Behav 1999 35(3):224-240.
- Adler NT: Effects of the male's copulatory behavior on successful pregnancy of the female rat. J Comp Physiol Psychol 1969, 69(4):613-622.
- Kornberg E, Erskine MS: Effects of differential mating stimulation on the onset of prolactin surges in pseudopregnant rats. Psychoneuroendocrinology 1994 19(4):357-371.
- Terkel J, Sawyer CH: Male copulatory behavior triggers nightly prolactin surges resulting in successful pregnancy in rats. Horm Behav 1978 11(3):304-309.
- Afonso VM, Pfaus JG: Hormonal and experiential control of female-male mounting in the female rat. Horm Behav 2006 49(1):30-37.
- Garcia Horsman P, Paredes RG: Dopamine antagonists do not block conditioned place preference induced by paced mating behavior in female rats. Behav Neurosci 2004 118(2):356-364.
- Paredes RG, Martinez I: Naloxone blocks place preference conditioning after paced mating in female rats. Behav Neurosci 2001 115(6):1363-1367.
- Nader K, Bechara A, van der Kooy D: Neurobiological constraints on behavioral models of motivation. Annu Rev Psychol 1997 48:85-114.
- Tzschentke TM: Measuring reward with the conditioned place preference paradigm: a comprehensive review of drug effects, recent progress and new issues. Prog Neurobiol 1998 56(6):613-672.
- Pfaus JG, Kippin TE, Coria-Avila G: What can animal models tell us about human sexual response? Annu Rev Sex Res 2003 14:1-63.
- Panksepp J, Knutson B, Burgdorf J: The role of brain emotional systems in addictions: a neuro-evolutionary perspective and new 'self-report' animal model. Addiction 2002 97(4):459-469.
- Graham JM, Desjardins C: Classical conditioning: induction of luteinizing hormone and testosterone secretion in anticipation of sexual activity. Science 1980 210(4473):1039-1041.
- Kippin TE, Samaha AN, Sotiropoulos V, Pfaus JG: The development of olfactory conditioned ejaculatory preferences in the male rat. II. Parametric manipulation of conditioning session number and duration. Physiol Behav 2001 73(4):471-485.
- Kippin TE, Pfaus JG: The nature of the conditioned response mediating olfactory conditioned ejaculatory preference in the male rat. Behav Brain Res 2001 122(1):11-24.
- Kippin TE, Cain SW, Pfaus JG: Estrous odors and sexually conditioned neutral odors activate separate neural pathways in the male rat. Neuroscience 2003 117(4):971-979.
- Skinner BF: Some contributions of an experimental analysis of behavior to psychology as a whole. American Psychologists 1953 8:69-78.
- Skinner BF: What is the experimental analysis of behavior? J Exp Anal Behav 1966 9(3):213-218.
- Fester CB, Skinner BF: Schedules of Reinforcement. New York: Appleton-Century-Crofts; 1957
- Beck J: Instrumental conditioned reflexes with sexual reinforcement in rats. Acta Neurobiol Exp (Wars) 1971 31(3):251-252.
- Beck J, Chmielewska J: Contact with estrus female as a reward for instrumental response in a growing male rat from the 3rd up to the 14th week of life. Acta Neurobiol Exp (Wars) 1976 36(5):535-543.
- Schwartz M: Instrumental and consummatory measures of sexual capacity in the male rat. J Comp Physiol Psychol 1956 49(4):328-333.
- Bermant G, Westbrook WH: Peripheral factors in the regulation of sexual contact by female rats. J Comp Physiol Psychol 1966 61(2):244-250.
- French D, Fitzpatrick D, Law OT: Operant investigation of mating preference in female rats. J Comp Physiol Psychol 1972 81(2):226-232.
- Everitt BJ, Cador M, Robbins TW: Interactions between the amygdala and ventral striatum in stimulus-reward associations: studies using a second-order schedule of sexual reinforcement. Neuroscience 1989 30(1):63-75.
- Michael RP, Keverne EB: Pheromones in the communication of sexual status in primates. Nature 1968 218(5143):746-749.
- Keverne EB: Sex attractants in primates. J Soc Cosmet Chem 1976 27(6):257-269.
- Gilbertson DW: Courtship as a reinforcement for key pecking in the pigeon,Columbia livia. Anim Behav 1975 23(4).
- Sheffield FD, Wulff JJ, Bakker R: Reward value of copulation without sex drive reduction. J Comp Physiol Psychol 1951 44:3-8.
- Anderson EE: The interrelationship of drives in the albino rat. Comparative psychology monographs 1938 14.
- Denniston RH, 2nd: Quantification and comparison of sex drives under various conditions in terms of a learned response. J Comp Physiol Psychol 1954 47(6):437-440.
- Everitt BJ: Sexual motivation: a neural and behavioural analysis of the mechanisms underlying appetitive and copulatory responses of male rats. Neurosci Biobehav Rev 1990 14(2):217-232.
- Kato A, Sakuma Y: Neuronal activity in female rat preoptic area associated with sexually motivated behavior. Brain Res 2000 862(1-2):90-102.
- Madlafousek J, Hlinak Z, Beran J: Decline of sexual behavior in castrated male rats: effects of female precopulatory behavior. Horm Behav 1976 7(2):245-252.
- Williams JR, Catania KC, Carter CS: Development of partner preferences in female prairie voles (Microtus ochrogaster): the role of social and sexual experience. Horm Behav 1992 26(3):339-349.
- Young LJ, Wang Z: The neurobiology of pair bonding. Nat Neurosci 2004 7(10):1048-1054.
- Getz LL, McGuire B, Pizzuto T, Hofmann J, Frase B: Social organization of the prairie vole, Microtus ochrogaster. J Mammal 1993 74.
- Carter CS: Neuroendocrine perspectives on social attachment and love. Psychoneuroendocrinology 1998 23(8):779-818.
- DeVries AC, DeVries MB, Taymans SE, Carter CS: The effects of stress on social preferences are sexually dimorphic in prairie voles. Proc Natl Acad Sci U S A 1996 93(21):11980-11984.
- Insel TR: Is social attachment an addictive disorder? Physiol Behav 2003 79(3):351-357
- Bermant G, Lott DF, Anderson L: Temporal characteristics of the Coolidge effect in male rat copulatory behavior. J Comp Physiol Psychol 1968 65(3):447-452.
Recibido: 30 de julio de 2010
Aceptado: 26 de agosto de 2010
Correspondencia: Dr. Genaro A. Coria-Avila, Programa de Neurobiología, Universidad Veracruzana, Xalapa, Ver.,Tel.: (228) 841-8900 Ext. 13609, Correo: gcoria@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
